不同极性没食子酸酯对水包油型乳状液物理和氧化稳定性的影响
朱梦婷 吴 辰 陈 奕 谢明勇
(南昌大学食品科学与技术国家重点实验室 南昌330047)
食品乳状液体系是许多食品体系不可缺少的组成部分,除了常规的奶油食品、色拉调味品、蛋白酱和肉类乳状液外,很多功能性物质(如营养素、香精、色素、抗菌剂、保健品等)也被制成O/W乳状液,在食品中使用和稳定储存[1]。由于油脂的存在,所以乳状液体系在储藏过程中会出现油脂氧化的问题。油脂氧化会导致食品感官品质和营养品质的下降,形成的一些氧化产物还会对人体造成极大危害,比如容易导致心血管疾病、癌症等[2]。添加抗氧化剂是目前控制纯油相体系中油脂氧化的常用方法。对于纯油相体系中油脂氧化历程已研究得比较清晰,且发现不同极性抗氧化剂在纯油脂体系中,抗氧化剂极性越强,抗氧化活性则越强[3]。对乳状液中油脂氧化的研究表明,油脂氧化后形成的过氧化物易于分布在乳状液的油水界面膜中,从而导致乳状液氧化稳定性降低。非极性物质可能更易于在油水界面上有一定的分布,因此在油脂乳化体系中非极性抗氧化剂应该较极性抗氧化剂的活性要强,此规律与纯油脂体系中恰好相反。这就是Porter 等[4]最早提出的“极性矛盾”(polar paradox hypothesis)学说。
后来这一学说相继被Frankel 等[5]用来评价乳状液体系中生育酚和维生素C 及其酯等抗氧化剂的作用,虽然这些研究似乎证实了抗氧化极性悖论,但最近的一些研究表明这一假说并不能准确预测所有不同极性抗氧化剂的抗氧化行为。比如Alemán,Laguerre 等[6-7]将迷迭香酸、羟基酪醇、脱羟基咖啡酸和芦丁等通过与不同长度的烷基链(1~20 个碳原子)进行酯化合成后,测定它们在水包油乳液中的抗氧化活性,根据“极性矛盾”假说,随着烷基链的增长,化合物的非极性增加,抗氧化活性应该也会随之增加,然而事实上当烷基链长超过一定程度后,抗氧化活性反而急剧下降。在水包油乳液体系中,抗氧化物质的分布与其极性之间不一定呈现简单的线性关系。作者推测,当上述这些物质的烷基链增加到一定程度后,有可能会产生一定的疏水性,从而使其更易分布于油相而不是界面膜。另外,非极性很强的化合物也很容易和乳状液中的乳化剂结合形成胶束,影响它在乳液中的分布。为了对上述假想进行验证,有必要对不同极性抗氧化物质在乳状液中的抗氧化性能和其分布的关系进行研究。
没食子酸(Gallic acid)是一种天然酚类抗氧化剂,已应用于食品、医药、日用化工等行业中,然而,其易溶于水、难溶于油的特性限制了它在乳状液氧化抑制中的应用。将它与脂肪醇酯化后,可提高分子的脂溶性,且烷烃链越长,烷基酯脂溶性越好。目前国内外关于没食子酸及其烷基酯对乳状液氧化稳定性影响的相关研究甚少[8]。本文以不同极性没食子酸酯为研究对象,通过比较它们对水包油型乳状液的物理和氧化稳定性的影响,并结合它们在水相和界面膜中的分布,探讨没食子酸及其酯类化合物在乳状液中的抗氧化作用和其分布的关系。本研究结果可为提高乳状液体系氧化稳定性提供重要的试验依据与理论指导,同时也能拓展没食子酸酯的应用领域,为综合开发、合理利用这一天然资源奠定理论基础,为乳状液氧化稳定性研究提供新的思路。
1 材料与方法
1.1 材料与试剂
玉米油(试剂级、不含抗氧化剂),上海迈瑞尔化学技术有限公司;没食子酸、没食子酸丙酯、没食子酸辛酯、 没食子酸月桂酯、 没食子酸十八酯,上海百灵威化学技术有限公司;吐温 20、NaN3、十二烷基硫酸钠、尼罗红、D-α-生育酚(≥96%分析纯)、三氟化硼乙醚络合物、亚硝酸叔丁酯,上海阿拉丁试剂有限公司;十六烷基苯胺、己醛(≥99%),美国sigma 公司;甲醇(色谱级),德国Meker 公司;硫氰酸钾、氯化钡、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、七水硫酸亚铁、异辛烷、异丙醇、乙醚、丙酮,上海国药集团。
1.2 仪器与设备
Ultra Turrax T 25 型高速分散机,德国IKA公司;GYB 30-6S 高压均质机,上海东华高压均质机厂;Nano-ZS90 纳米粒径电位分析仪,英国马尔文公司;TU-1900 双光束紫外可见分光光度计,北京普析通用仪器有限公司;Agilent 7890A/7000 气相色谱-质谱联用仪、Agilent 1260 高效液相色谱系统,美国安捷伦公司。
1.3 试验方法
1.3.1 乳状液的制备 先配制10 mmol/L 的磷酸盐缓冲液(pH 7.0):分别称取8 g NaCl、0.2 g KCl、1.38 g Na2HPO4和0.2 g KH2PO4,用去离子水溶解定容至1 L。将质量分数0.1%的Tween 20 溶解于PBS 缓冲液中配制成乳状液的水相溶液。将玉米油从冰箱取出,待其溶解后取1%玉米油和99%水相溶液用分散机搅拌2 min,再将乳状液用高压均质机在40 MPa 均质2 次,得到的乳状液加入NaN3(0.02%,w/w)作为抑菌剂。1%玉米油和99% 水相溶液用高速分散机搅拌2 min,再用高压均质机(40 MPa)均质2 次得到乳状液,加入0.02% NaN3作为抑菌剂。
1.3.2 抗氧化剂对乳状液颗粒性质的影响 按照1.3.1 节的方法制备乳状液,在制备好的乳状液中分别加入30,60 和90 μmol/L 的没食子酸及其酯类化合物(R3、R8、R12 和R18)和α-生育酚(TOH)甲醇溶液,搅拌1 h 使其混合均匀,避光保存,定期测定乳状液颗粒粒径和ζ-电位。测定方法参考Ramírez-Suárez 等[9]的方法:用马尔文Nano-ZS90 纳米粒径电位分析仪分别测定乳状液的粒径和ζ-电位。为了降低多重光散射效应,分析前用蒸馏水将乳状液稀释100 倍。
1.3.3 抗氧化剂对乳状液氧化稳定性的影响 按照1.3.1 节的方法制备乳状液,在制备好的乳状液中分别加入30 μmol/L 的没食子酸及其酯类化合物甲醇溶液,搅拌1 h 使其混合均匀,取5 mL 转移至20 mL 顶空瓶中,用聚四氟乙烯隔垫密封在25 ℃暗处保存,定期测定乳状液的过氧化值和己醛含量。
1.3.3.1 可见分光光度法测定乳状液的过氧化值[10]
Fe2+储备液:1 体积0.132 mol/L BaCl 和1 体积0.144 mol/L FeSO4·7H2O 混合,离心取上清液;Fe3+标准贮备溶液:4.9769 g FeSO4·7H2O 溶于 50 mL去离子水中,加入100 mL 浓H2SO4,加温溶解后滴入20% KMnO4溶液,直至溶液红色褪色且保持30 s 不变,定容至1 000 mL,摇匀,储备液每毫升含100 μg Fe3+;Fe3+标准工作液:取10 mL Fe3+标准贮备液于100 mL 容量瓶中,用甲醇∶正丁醇(2∶1,V/V)混合液定容,混匀静置得标准工作溶液,工作液每毫升含10 μg Fe3+。
Fe3+标准曲线的制作:分别移取0,10,20,40,80,100,200,400 μL 的Fe3+标准工作溶液于10 mL 试管中,分别加入20 μL 3.94 mol/L 硫氰酸钾溶液,用甲醇∶正丁醇(2∶1,V/V)混合溶液定容至5 mL。涡旋混合10s,室温避光静置20 min,甲醇正丁醇混合液作为空白对照,在510 nm 波长下测定吸光度值。重复3 次测定,以吸光度平均值对相应Fe3+的含量(μg)绘制标准曲线。
乳状液的过氧化值的测定:从顶空瓶中取1 mL 乳状液到试管中,加入5 mL 异辛烷∶异丙醇(2∶1,V/V)混合溶液,涡旋混合,再以5 000 r/min离心5 min。取1 mL 上清液,加入20 μL 硫氰酸钾和氯化亚铁溶液,再用甲醇∶正丁醇(2∶1,V/V)混合溶液定容至5 mL,涡旋混合10s,室温下避光静置20 min,以甲醇正丁醇混合溶液作空白对照,在510 nm 波长下测定吸光度值。
过氧化值计算公式:POV=(A×n×0.5 × K)/(55.86×m×2)×1 000
式中:POV——样品的过氧化值,meq/kg;A——测得样品液的吸光度;K——测得Fe3+标准曲线的斜率;55.86——Fe 的原子量;m——样品中油脂的质量,g;0.5——O/Fe 的物质的量比;n——吸取上清液的体积分数;2——氧换算为过氧化值的系数。计算结果精确至0.01。
1.3.3.2 顶空进样-GC-MS 法测定乳状液的己醛含量[11]己醛标准曲线的制作:配制含0.001 mol己醛的标准液,分别稀释成含己醛0.002,0.005,0.01,0.02,0.04,0.06,0.08,0.1,0.2,0.4,0.6,0.8 μmol 的梯度标准液,以己醛浓度为横坐标,己醛峰面积为纵坐标做标准曲线。
顶空进样条件:炉温65 ℃;定量环温度110℃;传输线温度130 ℃;GC 平衡时间13 min;进样瓶加热平衡时间10 min;顶空瓶瓶内压10 psi;瓶加压时间0.5min;填充定量环时间0.5 min;定量环平衡时间0.5 min;进样时间1 min。
GC-MS 工作条件:色谱柱:Agilent HP-5MS(30 m×250 μm×0.25 μm);分流比:7∶1;流速1 mL/min;柱温65 ℃;传输线温度280 ℃;离子源温度230 ℃;四级杆温度150 ℃。
1.3.4 抗氧化剂在乳状液中的分布[12]
1.3.4.1 抗氧化剂在水相中的分布 没食子酸及其烷基酯和α-生育酚紫外最大吸收波长的确定:称取没食子酸及其烷基酯和α-生育酚各标准品,用甲醇配成浓度为100 μmol/L 的标准储备液,以甲醇为空白对照,在200~500 nm 范围内紫外扫描,得到紫外吸收曲线。
没食子酸及其烷基酯和α-生育酚标准曲线的绘制:将100 μmol/L 的标准储备液,逐级稀释得到梯度浓度为5,20,40,50,60,80,100 μmol/L 的标准液,过0.22 μm 有机滤膜,进液相测定得各浓度对应的峰面积,以浓度梯度为横坐标,峰面积为纵坐标做标准曲线。
样品测定:分别取适量含100 μmol/L 没食子酸及其烷基酯和α-生育酚的乳状液于试管中,加入200 μmol/L EDTA 溶液以降低试验过程中乳状液的氧化,4 ℃下15 000 r/min 高速离心1 h,取下层乳清再次离心30 min,小心吸取下层水液,合并两次水液过0.22 μm 有机滤膜,待测。
液相色谱条件:色谱柱:Hypersil ODS2-C18(250 μm×4.6 μm×5 μm);流动相A:甲醇,B:3 mmol/L 磷酸水溶液;R0、R3、R8 和R12 梯度洗脱条件:0 min 5%甲醇,15 min 100%甲醇,20~25 min 5%甲醇;R18 和TOH 梯度洗脱条件:0 min 20%甲醇,15~30 min 100%甲醇,40~45 min 20%甲醇。
1.3.4.2 抗氧化剂在界面层的分布 界面层中抗氧化剂测定引用一种化学探针——十六烷基重氮苯离子16-ArN2+,由十六烷基苯胺重氮化得到的两亲性物质,其合成方法参照Doyle 等[13]的研究。
由于不能将乳状液三相完全分离,为测定没食子酸及其烷基酯和α-生育酚在乳状液界面层中的分布情况,只能采用间接手段来测定。在乳状液界面层中,16-ArN2+与抗氧化剂的反应速率能间接反映抗氧化剂在界面层的分布情况,NED 与16-ArN2+结合能产生一种偶氮染料,偶氮染料在572 nm 下其含量与吸光度值呈正相关关系,因此,只要在反应液中加入过量的NED 溶液,16-ArN2+与抗氧化剂的反应速率Kobs,可用16-ArN2+在反应过程中含量衰减量(即吸光度值衰减值)随时间变化所做曲线的斜率来表示。
试验过程参照Sánchezpaz 等[12]的方法,按照
1.3.1 节的方法制备乳状液,取1 mL 现配的乳液于2 mL EP 管中,分别取20 μL 浓度30 mmol/L的没食子酸及其烷基酯和α-生育酚标液加入乳液中,涡旋1 min,超声处理30 min 得到含抗氧化剂的乳液;10 μL 浓度0.017 mol/L 的16-ArN2+乙腈溶液与30 μL 含抗氧化剂的乳液混合得40 μL混合物,再与1 mL 浓度0.01 mol/L 的NED 乙醇溶液混合反应,每隔1 min 测定反应液在572 nm的吸光度值,直至吸光度值不变为止;根据吸光度值随时间的变化得到二级反应速率常数Kobs。
1.4 数据统计分析
所有试验经过至少3 次重复(n≥3),试验得到的数据用Origin 8.0 进行处理。
2 结果与讨论
2.1 抗氧化剂对乳状液颗粒性质的影响
2.1.1 不同抗氧化剂对乳状液颗粒性质的影响没食子酸及其烷基酯和α-生育酚作为抗氧化剂以30 μmol/L 的浓度加入乳液中,乳状液在30 d内的粒径和ζ-电位变化见图1。由图1a可知,未添加抗氧化剂的乳状液粒径约300 nm,添加抗氧化剂的乳液粒径大小都在250 nm 左右,可见添加抗氧化剂使得乳状液分散更加均匀,此结果与Atarés 等[14]的报道一致。添加等浓度的R0、R3、R8、R12、R18 和TOH 的乳状液粒径在30 d 内较稳定,说明等浓度没食子酸及其烷基酯和α-生育酚对乳液粒径没有产生差异性的影响,这与Luo等[15]测定的银椴苷、芦丁和柚皮苷3 种黄酮类抗氧化剂对乳状液粒径作用效果不同,这可能是因为黄酮类物质间的乳化能力差别大且粒径(8~35 μmol/L)远大于用Tween20 配制的乳液。
图1b为添加等浓度的没食子酸及其烷基酯和α-生育酚的乳液在30 d 内的ζ-电位,未添加抗氧化剂的乳液ζ-电位约-45mV,不同抗氧化剂对乳状液ζ-电位产生的影响不同。在添加30 μmol/L R0,R3,R8 和α-生育酚的条件下,乳液的ζ-电位降低至-20 mV 左右,而添加30 μmol/L R12 和R18,ζ-电位与未添加前相差不大。R0,R3和R8 的水溶性较好,α-生育酚几乎不溶于水,而R12 和R18 的脂溶性较大,说明ζ-电位的变化可能与各抗氧化剂的水溶性强弱相关,没食子酸及其烷基酯和α-生育酚在乳液微环境中的分布对油滴表面电荷产生了影响。Shao 等[16]在大豆蛋白稳定的乳液相关研究中,发现离子强度和pH 等因素对乳液油滴表面电荷会产生影响继而改变乳液ζ-电位。

图1 抗氧化剂对乳状液粒径(a)和ζ-电位(b)的影响Fig.1 Effects of antioxidants on particle size (a)and ζ - potential (b)of emulsion
2.1.2 抗氧化剂浓度对乳状液颗粒性质的影响在玉米油水包油乳状液(Tween 20,质量分数0.1%)中加入浓度分别为30,60 和90 μmol/L 的没食子酸月桂酯和α-生育酚甲醇溶液,30 d 内乳状液中颗粒粒径和ζ-电位变化情况见图2,数据表明这些乳液的颗粒粒径约250 nm 且在30 d 内相对稳定,ζ-电位随着没食子酸月桂酯和α-生育酚的浓度增加而递减,表明乳状液液滴所带负电荷减少了,类似的结果有其他研究报道[17-19]。

图2 抗氧化剂浓度对乳状液粒径(a)和ζ-电位(b)的影响Fig.2 Effect of antioxidant concentration on particle Size (a)and ζ - potential (b)of emulsion
2.2 没食子酸及其烷基酯对乳液氧化稳定性的影响
试验以过氧化物值 (POV)和己醛为评价指标,考察了抗氧化剂对玉米油O/W 乳状液氧化稳定性的影响。选择测定过氧化物值(POV)和己醛是因为这两种方法测定得到的结果分别反映了油脂氧化的初级产物和次级产物含量,同时使用这两种指标可以较为可靠地反映油脂氧化的程度。以Fe3+含量(μg)为横坐标,吸光度为纵坐标绘制POV 测定的标准曲线,回归方程为y =0.78912x-0.02376,相关系数R2=0.99649,根据每天测得的吸光度值带入公式计算即可得到样品的过氧化值POV。以己醛浓度(μmol)为横坐标,其峰面积为纵坐标绘制己醛测定的标准曲线,标准曲线的回归方程y=4.0567×107x+22 015,相关系数R2=0.99898。
图3显示的是,添加30 μmol/L 没食子酸及其烷基酯乳状液的POV 值和己醛含量随着氧化天数的变化情况,与空白组对照,没食子酸及其烷基酯都提高了乳状液的氧化稳定性,比较乳状液氧化过程中氢过氧化物和己醛的生成滞后时间长短,得出抗氧化强弱顺序为:R3>R12>R8>R0>R18。R3、R12 和R8 的抗氧化性强于R0,表明抗氧化剂非极性越强其在乳状液中抗氧化性越强。这与“极性矛盾学说”是一致的。但是,R3 抗氧化性强于R8,R12 和R18,R18 非极性最大但在乳液中的抗氧化性却最弱,这种现象与“极性矛盾学说”相违背,Ferguson 和Balgavý 等[20-21]将这种现象命名为“cut-off effect”,是生物细胞毒性研究中较普遍的一种生物学现象,但是,抗氧化剂在乳状液中抗氧化研究是初次涉及该理论。绿原酸,咖啡酸,迷迭香酸和没食子酸等酚酸及其烷基酯在乳状液中的抗氧化研究已有报道类似的试验结果[6-7,22-25],说明抗氧化剂在乳状液中的抗氧化活性不仅与其极性相关,还与其他因素,比如抗氧化剂在乳液中的分布及疏水性强弱等因素相关。
2.3 没食子酸及其烷基酯和α-生育酚在乳状液中的分布测定
2.3.1 抗氧化剂在乳状液水相中的分布 没食子酸酯及α-生育酚的紫外扫描最大吸收比波长分别为,没食子酸270 nm,没食子酸丙酯,辛酯,月桂酯和十八酯280 nm,α-生育酚295 nm,最终采用这几个波长应用于HPLC 的紫外检测波长。
在相应的色谱条件下,根据没食子酸及其烷基酯与α-生育酚的浓度与色谱图峰面积关系,作图得出了各抗氧化剂的标准曲线,如图4,各标准曲线回归方程的相关性都很好,R2介于0.960~0.998。
依据标准曲线的回归方程和添加各抗氧化剂后乳状液的色谱图的峰面积,计算得出添加100 μmol/L 没食子酸及其烷基酯乳状液水相中各抗氧化剂的含量,如图5所示,各抗氧化剂含量分别为R0:94.9735 μmol/L,R3:18.669 μmol/L,R8:19.485 μmol/L,R12:27.356 μmol/L,R18:2.9285 μmol/L,α -生育酚:0.1384 μmol/L。可见,没食子酸90%以上分布在水相中,与乳状液油滴接触概率最小,在乳状液界面层分布自然也特别少,在乳状液中抗氧化活性较弱。没食子酸丙酯,辛酯,月桂酯在水相中含量约20%~30%,主要分布在油滴内部或界面层,在乳液中有较强的抗氧化活性。没食子酸十八酯在水相中含量特别低约3%,但是抗氧化活性最弱,Panya 等有类似研究的报道,他们猜想迷迭香酸二十酯在乳状液中发生自我凝聚,形成水溶性差的聚合物或与Tween20 形成胶束结构,因此在水相中含量低且抗氧化活性较弱。
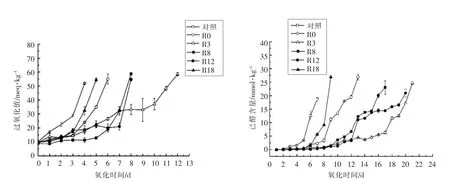
图3 不同极性没食子酸酯对乳状液过氧化值(a)和己醛(b)的影响Fig.3 Effects of different polar gallic acid esters on the peroxide value (a)and hexanal (b)of the emulsion
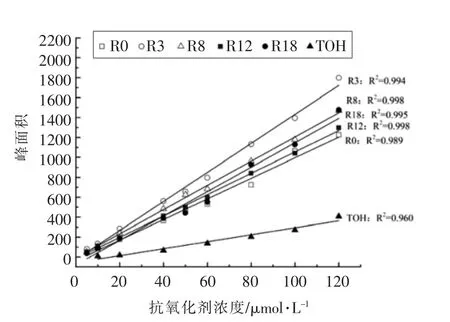
图4 没食子酸及其烷基酯与α-生育酚的HPLC 测定的标准曲线Fig.4 Calibration curves for gallic acid esters and α-tocopherol with HPLC
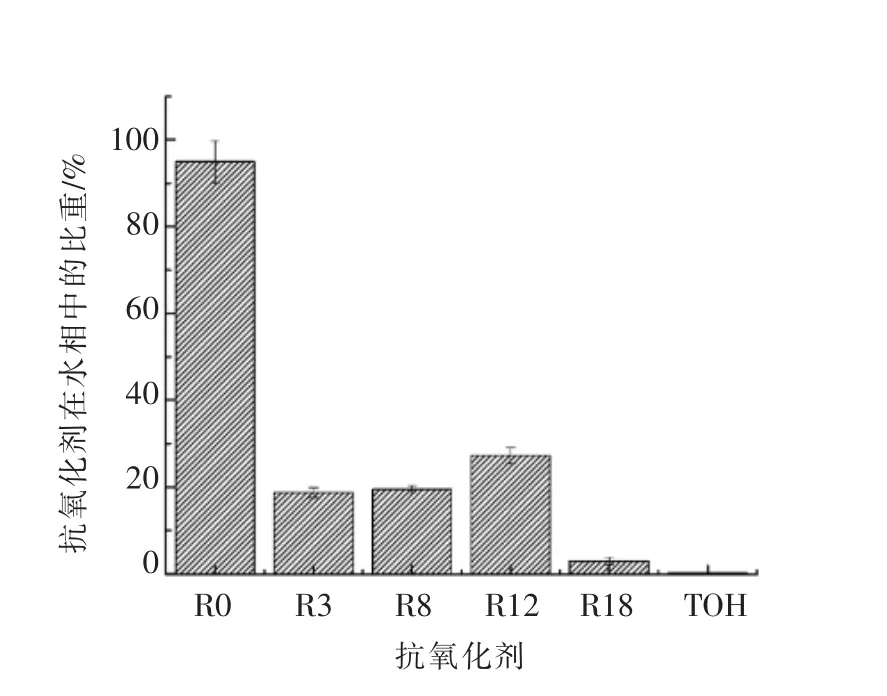
图5 没食子酸酯与α-生育酚在乳状液水相中的分布Fig.5 Distribution of gallate and α-tocopherol in aqueous phase of emulsion
2.3.2 抗氧化剂在乳状液界面层中的分布 参照Doyle 等[13]的研究方法,首先制备获得十六烷基重氮苯离子16-ArN2+化合物,为了验证制备是否成功,采用KBr 压片法,测得十六烷基苯胺及合成产物的红外扫描结果见图6,从图谱(a)可知十六烷基苯胺的特征谱峰归属如下:波长3 372.2 cm-1处为-NH 伸缩振动的特征吸收峰;1 626.1 cm-1处,为-NH 的弯曲振动特征吸收峰;1 466.9,1 518.09处为苯环中C=C 伸缩振动特征吸收峰;723.6 cm-1处为-(CH2)n-指纹区特征吸收峰。对比十六烷基苯胺及合成产物的红外图谱发现,合成产物在波长2 262.8~2 561.4 cm-1这一区域明显增添了好几个吸收峰,即为重氮化合物C-N=N 和N=N 伸缩振动特征吸收峰。因此,由红外光谱初步确定合成产物中含有N=N 的重氮化结构。

图6 十六烷基苯胺(a)及合成产物(b)的红外图谱Fig.6 FTIR spectra of hexadecylaniline(a)and 16-ArN2+(b)
由于探针离子16ArN2+化合物结构十分独特,它既是油不溶性(由于含有阳离子基团),同时又是水不溶性(十六烷基烃链的结果)化合物,这意味着它和抗氧化物质的反应只会在位于乳液界面膜区域发生。因此参照Sánchezpaz 等的方法,乳状液界面层中抗氧化剂的分布测定可通过测定其在界面层中与探针离子16ArN2+的化学反应速率来实现。表1列出了30 μmol/L 没食子酸及其烷基酯和α-生育酚与170 μmol/L 的16ArN2+在界面层的化学反应速率。没食子酸丙酯二级反应速率常数381M-1s-1最大,与其他烷基酯相比大小顺序为:R3>R12>R8>R18>R0。
如图7所示,没食子酸丙酯在乳液中抗氧化活性最强,且其他烷基酯在乳液中的抗氧化活性强弱与二级反应速率常数大小顺序相关,即抗氧化剂的二级反应速率常数越大,在乳状液界面层的分布越多,在乳状液中的抗氧化活性越强,可见,没食子酸及其烷基酯和α-生育酚在乳状液中的抗氧化活性与其在乳状液界面层中的分布紧密相关。此研究结果与Losada 等[26]的报道一致,对乳状液中油脂氧化的研究表明,油脂氧化后形成的过氧化物易于分布在乳状液的油水界面膜中,分布在乳状液界面上的脂过氧化物和水相中过渡金属离子的相互作用是导致乳状液氧化稳定性降低的重要原因,因此,理想情况下,若自由基清除剂分布在油脂氧化自由基生成的部位,其抗氧化效率则最高。
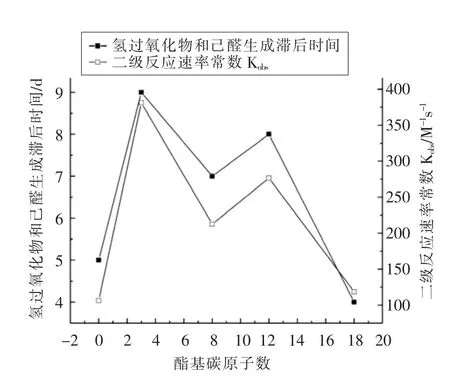
图7 玉米油乳状液的氧化稳定性的变化(氢过氧化物和己醛的生成滞后时间)与乳液界面层中抗氧化剂分布的相关性Fig.7 Correlation between the variation in the oxidative stability of corn emulsions (expressed as the lag time of hydroperoxide and hexanal)and the distribution of antioxidants in the interfacial region of the emulsions

表1 抗氧化剂与16-ArN2+在乳状液界面层中的反应速率常数KobsTable 1 Reaction rate constant for antioxidants and 16-ArN2+ in the emulsion interfacial layer Kobs
3 结论
不同抗氧化剂对乳状液中的物理稳定性的影响主要与其疏水性大小以及添加浓度有关。而不同极性抗氧化剂在乳状液中的抗氧化活性不仅与其极性相关,还与其在乳状液中的分布有关。抗氧化剂在乳状液水相的含量可间接反映其抗氧化活性,但在界面层中的含量与其在乳液中的抗氧化活性强弱呈正相关。目前国内外在水包油型乳状液体系中抗氧化物质的研究多局限于不同来源抗氧化活性物质的单纯应用,而对不同抗氧化物质之间的协同作用机制的研究不多。因此,就食品体系中抗氧化剂的作用机制,不仅要研究单一抗氧化剂的促/抗氧化机制,也要对复合抗氧化剂的相互作用机制进行深入的研究,以找到一个有效的控制乳状液体系氧化的方法,这对于促进乳状液的抗氧化机制研究也有一定的借鉴意义,同时对促进乳状液体系在各领域的应用提供一定的理论参考价值和实际意义。

