模式体系谷氨酸-葡萄糖美拉德反应程度研究
张凤梅 汤高奇 田 玮 柳艳霞* 赵改名 赵莉君
(1 河南农业大学食品科学技术学院 郑州450002 2 河南省肉制品加工与质量安全控制重点实验室 郑州450002 3 河南农业职业学院 郑州451450 4 河南农业大学牧医工程学院 郑州450002)
美拉德反应,也称羰氨反应、非酶褐变(Nonenzymatic browning),是指食品在加工、贮藏过程中含有的羰基化合物和氨基化合物在一定温度下发生的一系列复杂反应的总称,对食品品质具有重要影响[1-2]。美拉德反应极为复杂,其反应历程、反应产物的性质及结构不仅受氨基酸与糖种类、性质的影响,同时与反应温度、时间、pH 值及金属离子等有关[3]。美拉德反应物主要是醛、酮、还原糖和氨基酸、肽及蛋白质,其反应产生的活性中间体及杂环类化合物不仅为食品提供了独特的风味,还具有抗氧化、抗诱变等特性,在食品、香料、色素等行业应用广泛[4]。鉴于美拉德反应所受影响因素较多,生成产物的种类较多且结构、性质较为复杂等因素,科学家大多通过建立模式美拉德体系来研究产物的性质,通过控制糖、氨基酸种类和反应条件来生成不同组成的美拉德产物混合物[5-6]。张凌燕等[7]对模式体系美拉德的研究主要是针对高温环境下进行的,得到3 种氨基酸和葡萄糖美拉德产物的相关物理特性;孙丽平等[8]主要以赖氨酸-葡萄糖为原料研究模式美拉德反应中挥发性产物,研究得出pH 和加热时间对反应产物均具有重要影响;贺湘等[3]对模式美拉德体系主要采用高压脉冲电场进行研究,得出体系褐变度、抗氧化活性与反应时间及电场强度均呈正相关;朱文辉等[9]对于谷氨酸-葡萄糖的美拉德反应主要采取固相的反应条件,对各反应阶段热解产物的逸出规律进行研究;赵景丽等[10]对于温和条件下的模式美拉德反应仅采取单一的温度条件和反应时间,研究出主要的挥发性产物,不能很好地解释从反应开始到结束的物化性质的变化。目前,关于游离氨基酸在温和条件下的美拉德反应研究,其体系或高温条件或反应时间单一,模式体系下美拉德反应程度以及如何变化的尚不清楚。
针对当前研究现状,本试验采用模式美拉德反应体系,以葡萄糖和谷氨酸为反应物,磷酸盐缓冲液为反应体系,探讨反应温度和时间对温和条件下谷氨酸-葡萄糖美拉德反应程度的影响,以期对温和条件下的模式美拉德反应提供理论依据。
1 材料与方法
1.1 试验材料与主要仪器、设备
D-(+)-葡萄糖,纯度≥99.50%,L-谷氨酸,纯度≥99%,美国Sigma-Aldrich 公司;0.2mol/L pH 6.0 的磷酸盐缓冲溶液,北京索莱宝科技有限公司;0.22 μm 滤菌膜,德国MEMBRANA 公司;UV-2600 型紫外分光光度计,日本岛津企业管理(中国)有限公司;DNP-9272 型电热恒温培养箱,上海精宏实验制备有限公司;PEN3 便携式电子鼻系统,德国Airsense 公司;HH-501 数显超级恒温水浴锅,金坛市杰瑞尔电器有限公司;台式酸度计pH213,意大利哈纳。
1.2 谷氨酸-葡萄糖美拉德反应体系的构建
准确称取一定质量的D-葡萄糖和L-谷氨酸,分别溶解于pH 6.0、浓度0.2 mol/L 的磷酸盐缓冲液,在无菌操作台上经0.22 μm 滤菌膜过滤除菌。分别移取一定体积上述溶液于15 mL 的顶空萃取瓶中混合均匀,使得二者最终浓度分别为0.02,0.06 mol/L,置于10,20,30,40 ℃的培养箱中,反应时间为10,20,30,40,50,60 d,以0 d 为对照组。样品反应结束后置于-25 ℃冰箱中,以待检测。
1.3 测定方法
1.3.1 美拉德反应体系pH 值的测定 将美拉德反应液调节至室温25 ℃,采用台式酸度计pH 213进行测定,待pH 读数稳定后记录数据。测定样品前,采用“两点法”对其进行校准。
1.3.2 初级阶段产物和中级阶段产物的测定 以蒸馏水为对照,用UV-2600 型紫外分光光度计在294 nm[11]、360 nm[12]处测定MRPs 吸光度值,分别作为表征美拉德反应初级阶段、 中级阶段反应程度的指标。A294表示波长为294 nm 处吸光度测定值,A360表示波长为360 nm 处吸光度测定值。
1.3.3 美拉德反应挥发性成分电子鼻测定 德国PEN3 电子鼻由10 种金属氧化物传感器构成,每种传感器对不同种类物质的敏感性存在差异,具体性能如表1所示。
参照党亚丽[13]试验方法稍作修改,用3 层保鲜膜将15 mL 顶空瓶封口,测试样品在50 ℃恒温水浴锅中平衡30 min,载气为干燥空气,采样时间间隔1 s,清洗时间120 s,归零时间5 s,样品测定时间80 s,进样流速为300 mL/min。
1.3.4 反应体系葡萄糖含量测定 色谱条件:色谱仪:Dionex IC S-3000 离子色谱仪,分析柱:CarboPacPA10 分离柱 (4 mm×250 mm)与CarboPacPA10 保护柱 (4 mm×50 mm),淋洗液:50 mmol/L NaOH,流速:0.8 mL/min,柱箱温度:30℃,进样体积:25 μL。检测方式:电化学检测器,脉冲安培检测模式。
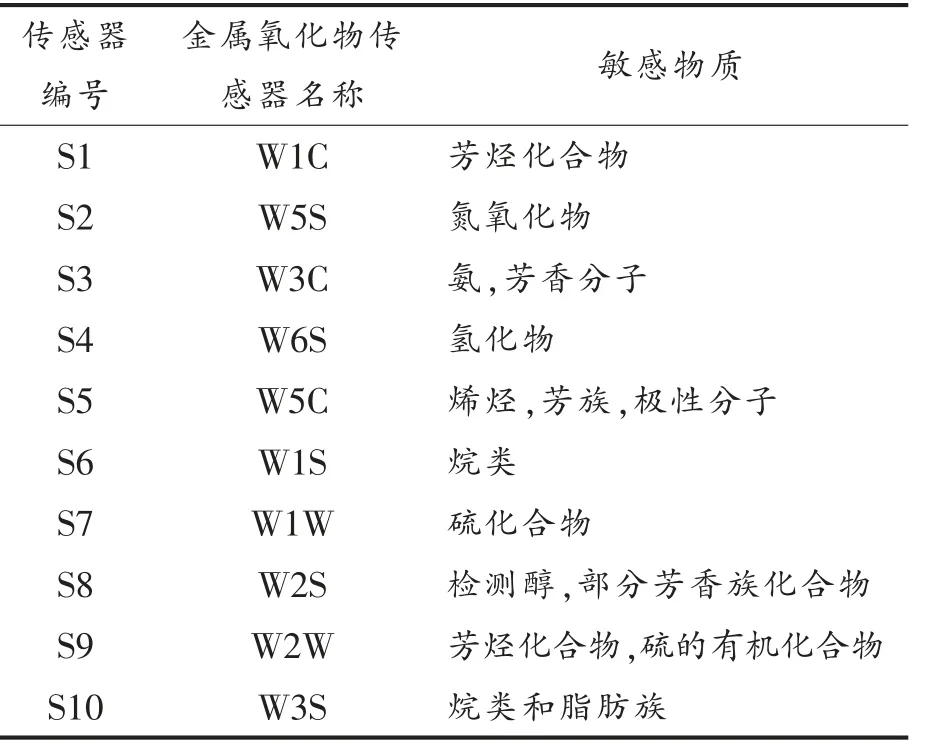
表1 化学传感器及相应的敏感物质类型Table 1 Chemical sensors and the corresponding types of volatile substances
1.4 数据处理方法
试验数据均采用EXCEL2007,SPSS13.0 进行数据处理与统计分析,Origin8.0 作图。数据间多重对比采用Duncan 检验分析显著性,P<0.05 表示存在显著性差异。
2 结果与分析
2.1 反应温度和时间对美拉德反应体系pH 的影响
美拉德反应体系pH 对反应的速率和产物种类具有重要影响,其影响是通过羰基与氨基在不同的pH 环境中进行不同程度的离子化实现的。各反应温度、 时间对美拉德体系pH 的影响见表2。
由表2可知,谷氨酸-葡萄糖美拉德反应体系pH 测定结果在同一时间——20,30,40 d 时,不同温度下均存在显著性差异(P<0.05),其中20 d 时在40 ℃时反应体系pH 降至最低,30,40 d 时反应体系分别在30,40 ℃的pH 值最低。而同一温度不同时间下,仅10 ℃条件下,不同反应时间美拉德反应体系pH 值存在显著差异(P<0.05),且反应至60 d 时体系pH 值最低。

表2 谷氨酸-葡萄糖美拉德反应体系pH 变化Table 2 Changes in pH of glutamic acid and glucose Maillard reaction system
2.2 反应温度和时间对美拉德反应初级阶段、中级阶段产物的影响
据报道[11],294 nm 处的紫外吸光度值可用来表征美拉德反应初级阶段的反应程度,吸光度值越大,表明初级阶段生成的产物越多。反应时间和温度对美拉德反应体系294 nm 处的吸光度影响如表3所示,可以看出,美拉德反应体系294 nm处吸光度值在同一温度下均随着反应时间的增加而增大,在同一时间不同温度条件下随温度升高吸光度也逐渐增大,其中30,40 ℃条件下的美拉德反应体系吸光度值分别在40,30 d 以后增长较快,10,20 ℃条件下则在50 d 时增幅较大。
反应时间和温度对美拉德反应体系360 nm处的吸光度影响如表4所示,可以看出,美拉德反应体系360 nm 处吸光度值随着温度升高、反应时间的增加,整体呈上升趋势。其中40 ℃条件下的美拉德反应体系吸光度值在50 d 之前增幅较大,50 d 之后趋于平稳,10,20,30 ℃整个反应阶段增长缓慢。
2.3 谷氨酸-葡萄糖美拉德体系挥发性成分测定
2.3.1 描述性统计 采用SPSS13.0,对各反应温度、反应时间下的谷氨酸-葡萄糖美拉德反应试样挥发性成分电子鼻测定数据进行描述性统计,如表5。

表3 谷氨酸-葡萄糖美拉德反应体系A294 变化Table 3 Changes in A294 of glutamic acid and glucose Maillard reaction system

表4 谷氨酸-葡萄糖美拉德反应体系A360 变化Table 4 Changes in A360 of glutamic acid and glucose Maillard reaction system

W3S 1.65±0.02 1.66±0.00 1.65±0.03 1.65±0.04 1.65±0.02 1.65±0.01 1.69±0.05 1.44±0.06 1.48±0.01 1.45±0.02 1.31±0.02 1.36±0.02 1.34±0.01 1.30±0.04 1.31±0.03 1.34±0.02 1.48±0.03 1.41±0.01 1.50±0.25 1.30±0.03 1.23±0.01 1.22±0.01 1.21±0.01 1.18±0.00计统性述描分成性发挥系体应反德拉美糖萄-葡酸氨谷5 表Descriptive statistics of volatile components from the Maillard reaction in glutamic acid and glucose model system W2W W2S W1W W1S W5C W6S W3C W5S W1C 1.97±0.22 2.57±0.12 4.16±0.76 2.67±0.13 1.27±0.02 1.14±0.01 1.38±0.03 3.26±0.55 1.62±0.06 1.86±0.10 2.59±0.08 3.71±0.38 2.58±0.08 1.26±0.02 1.20±0.01 1.37±0.02 2.92±0.27 1.59±0.04 1.76±0.04 2.62±0.05 3.10±0.08 2.59±0.03 1.28±0.04 1.18±0.03 1.40±0.03 2.56±0.09 1.63±0.04 1.82±0.18 2.44±0.12 3.61±0.74 2.41±0.18 1.25±0.04 1.19±0.04 1.36±0.04 2.91±0.59 1.57±0.07 1.88±0.17 2.42±0.14 3.89±0.66 2.37±0.14 1.24±0.02 1.16±0.01 1.34±0.03 3.07±0.43 1.55±0.05 1.72±0.10 2.47±0.16 3.11±0.25 2.40±0.17 1.25±0.03 1.20±0.04 1.34±0.05 2.47±0.12 1.54±0.08 1.91±0.13 2.18±0.17 4.17±0.45 2.37±0.23 1.22±0.04 1.15±0.01 1.31±0.06 2.75±0.31 1.48±0.09 1.93±0.22 1.94±0.20 4.30±0.75 2.12±0.25 1.25±0.05 1.10±0.04 1.29±0.10 3.21±0.35 1.47±0.08 1.85±0.15 1.96±0.07 3.91±0.59 2.10±0.11 1.22±0.03 1.10±0.01 1.30±0.04 2.66±0.44 1.44±0.05 1.72±0.10 1.68±0.44 3.38±0.42 2.00±0.10 1.22±0.03 1.11±0.01 1.29±0.03 2.45±0.27 1.42±0.04 1.86±0.50 1.76±0.19 3.79±1.66 1.89±0.26 1.20±0.06 1.11±0.04 1.26±0.07 3.27±1.72 1.38±0.11 2.04±0.30 2.09±0.11 4.28±0.88 2.22±0.15 1.27±0.03 1.14±0.05 1.35±0.05 3.68±1.03 1.51±0.07 1.82±0.16 1.92±0.03 3.59±0.63 2.01±0.03 1.22±0.01 1.12±0.01 1.29±0.02 2.99±0.53 1.42±0.01 1.77±0.13 2.05±0.18 3.11±0.13 2.13±0.21 1.28±0.09 1.09±0.01 1.37±0.09 2.69±0.05 1.50±0.12 1.96±0.08 1.98±0.02 4.13±0.18 2.12±0.00 1.25±0.01 1.17±0.01 1.33±0.00 3.88±0.15 1.48±0.00 2.27±0.05 2.23±0.03 5.12±0.16 2.38±0.02 1.31±0.02 1.24±0.04 1.40±0.00 5.38±0.13 1.59±0.00 1.35±0.02 2.00±0.11 5.30±0.64 2.10±0.13 1.26±0.03 1.13±0.02 1.33±0.04 2.83±0.58 1.42±0.06 1.32±0.00 1.98±0.14 4.20±0.55 2.02±0.19 1.25±0.06 1.10±0.02 1.33±0.06 2.33±0.48 1.41±0.08 1.31±0.06 2.34±0.97 4.83±1.16 2.43±1.04 1.29±0.14 1.19±0.04 1.39±0.20 2.69±0.67 1.49±0.28 1.25±0.01 1.79±0.20 4.29±0.84 1.87±0.26 1.23±0.08 1.17±0.05 1.29±0.08 2.45±0.58 1.34±0.10 1.62±0.09 1.55±0.08 3.35±0.45 1.57±0.10 1.17±0.03 1.07±0.02 1.20±0.03 1.80±0.21 1.28±0.05 1.54±0.15 1.53±0.12 2.87±0.85 1.54±0.15 1.16±0.05 1.07±0.03 1.20±0.05 1.65±0.32 1.27±0.07 1.68±0.19 1.54±0.09 3.77±1.03 1.57±0.12 1.18±0.03 1.09±0.04 1.21±0.03 2.03±0.42 1.29±0.05 1.63±0.05 1.49±0.05 3.45±0.28 1.51±0.05 1.17±0.03 1.11±0.01 1.20±0.02 1.85±0.12 1.27±0.02 Table 5 号编1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24。差准标±别类10 ℃20 ℃30 ℃40 ℃10 ℃20 ℃30 ℃40 ℃10 ℃20 ℃30 ℃40 ℃10 ℃20 ℃30 ℃40 ℃10 ℃20 ℃30 ℃40 ℃10 ℃20 ℃30 ℃40 ℃值均平为均据10 d 20 d 30 d 40 d 50 d 60 d 数中:表注
2.3.2 主成分分析 在对谷氨酸-葡萄糖美拉德反应体系电子鼻测定数据描述性统计的基础上,对不同反应条件下24 类试样挥发性成分进行主成分分析。
由表6、图1和表7结果分析可知,第一主成分的贡献率为64.70%,相当于6.470 个原始指标的作用,可以反映原始信息量的64.70%,主要反映醇类,芳香族化合物,脂肪族,烃类物质信息。第二主成分的贡献率为14.80%,相当于1.480 个原始指标的作用,可以反映原始信息量的14.80%,主要反映硫化合物信息。第三主成分的贡献率为11.33%,相当于1.133 个原始指标的作用,可以反映原始信息量的11.33%,主要反映芳烃化合物,硫的有机化合物,氮氧化物信息。前3 个主成分的累积贡献达到90.83%,基本代表原始变量的绝大部分信息,因此,应选用前3 个主成分数据作为数据分析的有效成分。

表6 主成分的特征根及方差贡献率Table 6 Eigenvalues of principal components and their variance contributions

图1 主成分分析碎石图Fig.1 Screen plot of PCA(principal component analysis)

表7 旋转后的载荷因子Table 7 Rotated component matrix(a)
本研究中,第一主成分为64.70%,第二主成分为14.80%,二者包含了原始信息量的79.50%。由图2(a)可以直观地看出美拉德反应体系挥发性成分与PC1 和PC2 的关系:编号为19 及1,2,3,4,5,6,7,14 的样品分别分布在PC1 和PC2 构成的第一、第四区间,表明该反应条件下的美拉德体系产生的挥发性成分醇类、芳香族、脂肪族及烃类化合物相对较多,含量相对较高。编号为8,12,15,16,17,18,20 的样品分布在PC1 和PC2 构成的第二区间,表明该类样品硫化合物含量相对较高,可能是来源于磷酸盐中含有微量的杂质硫元素与产物之间发生复杂反应导致。编号为9,10,11,13,21,22,23,24 的样品依次分布在PC1 和PC2 构成的第三区间,表明这4 种样品产生的挥发性成分相对较低,或者生成的产物之间相互反应又生成了不易挥发的物质。
第三主成分包含了原始信息量的11.33%,由图2(b)可知各反应条件下美拉德反应体系挥发性成分与PC1 和PC3 的关系:编号为1,2,4,5,7,14 的样品分布在PC1 和PC3 构成的第一区间,表明生成的挥发性成分主要为醇类、芳香族、脂肪族及烃类化合物,此外硫化合物的含量也较高。编号为8,9,10,11,12,13,15,16 的样品分布在PC1 和PC3 构成的第二区间,表明挥发性成分以硫化合物含量相对较高,其来源可能是由磷酸盐中含有的微量硫元素与产物相互反应生成。编号为17,18,20,21,22,23,24 的样品分布在PC1 和PC3 构成的第三区间,表明生成的挥发性成分相对较少,或产物之间相互反应生成了不易挥发的物质而电子鼻无法识别。编号为19 的样品分布在PC1 和PC3 构成的第四区间,表明该条件下生成的挥发性成分所属种类较多,且含量相对较高。

图2 旋转后的主成分载荷图Fig.2 Biplot of rotated principal component analysis (PCA)
2.3.3 聚类分析 实际问题中,样本对象往往具有多种特征,要想实现对其作出全面综合性地分析,通常需要针对样本所具有多种特征进行分类,而聚类分析就是一种可以根据样本特征的相似程度逐渐聚合,最终实现按照类别的综合性质完成聚类分析的方法。实际应用中简便、 分类效果较好。本研究在主成分分析的基础上,采用SPSS13.0软件,以类间平均距离(Between-groups linkage)作为测量方法,对提取的3 大主成分作为综合指标进行聚类分析。
图3中“0~25”的标度是将各类检测对象的不同评价指标,按照统一尺度映射后的结果。当标度距离一定时,不同类别样品间差异较小,谷氨酸-葡萄糖美拉德反应体系的香气轮廓相似度较大,可聚为一类。由图3所示,当标度为5 时,可将该体系24 类香气成分聚为5 类。其中,第一大类包含7 种,占总种类数的29.17%,第二大类包含8种,占总种类数的33.33%,第三大类有1 种,占总种类的4.17%,第四、五大类各有4 种,均占总种类数的16.67%。对比主成分分析各类样品分布结果发现,聚类分析与PC1 和PC2 以及PC1 和PC3的主成分分析结果基本一致,可相互印证、互为补充。
2.4 反应温度和时间对美拉德反应体系葡萄糖浓度的影响

图3 聚类分析图Fig.3 Dendrogram of hierarchical cluster analysis
根据动力学原则,任何反应的反应程度均可以通过监测反应物的减少或反应产物的增加来描述[14]。由表8可知,在同一温度下,随着反应时间的延长葡萄糖含量逐渐减少,且在0~40 d 时反应时间对葡萄糖浓度的减少存在显著性差异(P<0.05)。当反应至50,60 d 时,虽然各温度下葡萄糖浓度仍然降低,但是,葡萄糖浓度减少较小,不具有显著性差异,推测此时反应速率较低或谷氨酸过量不再发生反应。在同一时间下,10,20 d 时不同温度下葡萄糖浓度减少,但无显著性差异,反应至30,40 d 时,随着反应温度的升高,葡萄糖浓度减幅较大,且具有显著性差异(P<0.05)。反应至60 d 时虽然具有显著性差异,但是差异较小,究其原因可能是新生成的产物与葡萄糖发生进一步反应导致葡萄糖含量降低。此外,在50 d 时,不同反应温度下葡萄糖浓度无显著性差异,推测此时体系中美拉德反应速率非常小或者已不发生反应。整体而言,反应至50 d 时,推断美拉德反应体系反应速率较小或者由于葡萄糖含量的减少谷氨酸过量二者不再发生反应。

表8 谷氨酸-葡萄糖美拉德反应体系葡萄糖浓度变化Table 8 Changes in glucose concentration of glutamic acid and glucose Maillard reaction system
2.5 谷氨酸-葡萄糖美拉德反应体系反应底物葡萄糖含量动力学模型研究
为探究温和条件下谷氨酸-葡萄糖美拉德反应体系葡萄糖残余含量与反应时间及温度的关系,针对HPLC 法测定反应物葡萄糖的残余量,采用Origin8.0 软件中的非线性函数进行拟合,构建动力学方程。根据Origin8.0 软件中各个模型的拟合参数及相关系数R2、 残差进行分析,最终确定Boltzmann 模型较为理想。本试验中构建的各个温度下,葡萄糖含量随时间变化的Boltzmann 模型的R2均大于0.90(R2越接近1 表示拟合度越好),且残差结果分布较均匀,认为拟合性能最佳。Boltzmann 模型动力学方程为:y=A2+(A1-A2)/(1+exp((x-x0)/dx)),以下是针对各个反应温度下葡萄糖浓度(g/L)随时间变化符合的具体动力学方程:
y1= 3.33+0.29/{1+exp〔(x-24.98)/12.41〕}(R2=0.9875)
y2= 3.31+0.26/{1+exp〔(x-26.31)/5.55〕}(R2=0.9602)
y3= 3.24+0.41/{1+exp〔(x-25.25)/15.09〕}(R2=0.9456)
y4= 3.30+0.31/{1+exp〔(x-20.29)/8.87〕}(R2=0.9305)
注:y1——10 ℃下葡萄糖残余量;y2——20 ℃下葡萄糖残余量;y3——30 ℃下葡萄糖残余量;y4——40 ℃下葡萄糖残余量。

图4 葡萄糖浓度随时间变化的Boltzmann 曲线Fig.4 The Boltzmann curve of glucose concentration change with time
同理,经反复筛选最终确定各个时间下,葡萄糖含量随温度变化情况也遵循Boltzmann 模型。各个反应时间下葡萄糖质量浓度(g/L)随温度变化符合的具体动力学方程如下所示:
Z1=3.35+774.30/{1+exp〔(x+88.34)/10.85〕}(R2=0.9702)
Z2= 3.36+0.22/{1+exp〔(x-9.42)/0.47〕}(R2=0.9138)
Z3= 3.32+17.16/{1+exp〔(x+22.02)/5.27〕}(R2=0.9817)
Z4=3.27+205.27/{1+exp〔(x+47.36)/7.28〕}(R2=0.9912)
注:Z1——30 d 下葡萄糖残余量;Z2——40 d下葡萄糖残余量;Z3——50 d 下葡萄糖残余量;Z4——60 d 下葡萄糖残余量。10,20 d 时葡萄糖浓度随温度变化动力学拟合效果较差,不能较好地构建符合动力学方程,在此不再列出。
3 讨论
反应介质的pH 对葡萄糖和氨基酸发生美拉德反应的活性形式具有决定性作用。发生美拉德反应的前提要求还原糖呈开链式,氨基化合物是非质子化合物,羰基和氨基随着反应体系H+浓度的变化发生不同程度的离子化,在酸性体系中,氨基质子化无法进行亲核进攻,羰-氨的亲核加成难度较大,含氮物质的种类和产量都比较低,易于发生糖的异构体和脱水反应,产生糠醛类物质。本试验中整个阶段美拉德体系反应发生的介质环境基本稳定,推断其可能原因是体系中谷氨酸过量,并且体系pH 值较低,因而多余的谷氨酸并未参加反应。这与曾茂茂等人[15]的研究结果较为一致,后期可以设置不同的浓度比进行验证。
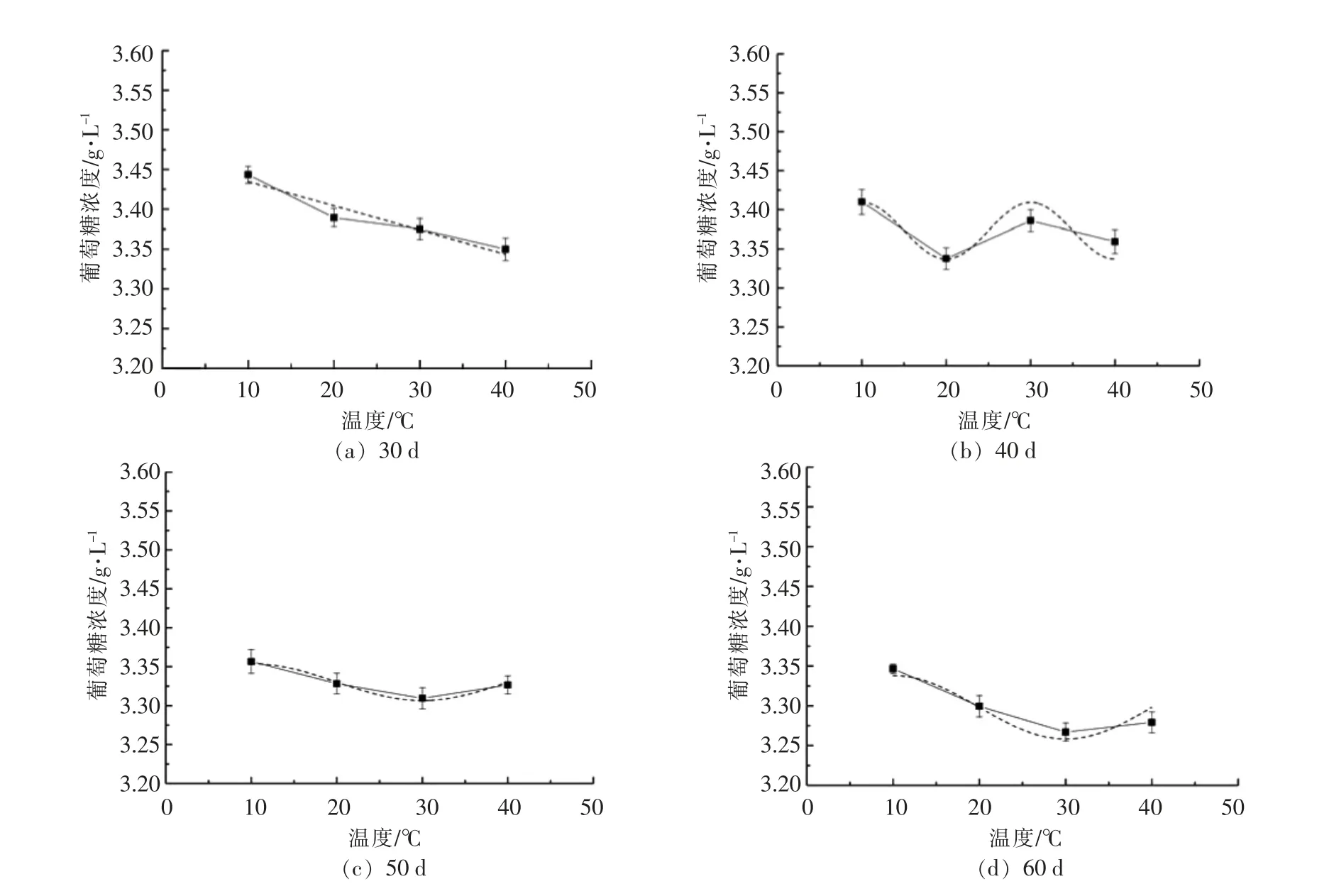
图5 葡萄糖浓度随温度变化的Boltzmann 曲线Fig.5 The Boltzmann curve of glucose concentration with temperature
美拉德反应是食品色泽、 风味的重要来源之一。本试验中,模式体系美拉德反应294 nm 处的吸光度值随着温度的升高、 反应时间的延长逐渐增大,与温度、时间呈正相关关系,表明美拉德反应初始阶段无颜色中间产物的生成量较大。360 nm 处的吸光度值随着温度的升高呈先增大后趋于平缓的趋势,推测可能是一方面美拉德反应中间产物转化为类黑精等终产物,另一方面随着加热时间的延长,新生成的产物发生分解或合成其它物质。本试验结果与赵谋明[16]、胡礼[17]研究结果较一致。
本试验针对模式体系中挥发性成分确定样本与“变量”间的联系,结合聚类分析原理,对各反应条件下的谷氨酸-葡萄糖美拉德体系挥发性成分进行分析,最终以聚为5 类较为恰当,其中以30℃,50 d(编号19 的样品)时的样本中检测到的挥发性成分较多,推断该条件可能是反应的“拐点”,其它条件下体系中的挥发性成分检测量较低,可能是反应体系中的挥发性成分的确较少,反应程度较小,也可能是反应生成的挥发性成分进一步发生反应生成了不易检测的非挥发性物质。
葡萄糖作为该模式体系中的反应物之一,其含量的变化可以用于推断该反应进行的程度。由表8结果可知,在不同的反应温度条件下,模式体系中葡萄糖的含量均随着反应时间的延长逐渐降低,且温度越高葡萄糖含量降低越快。这一结果与李伶俐[18]高温条件下的研究结果基本一致。此外,为探究温和条件下谷氨酸-葡萄糖美拉德反应体系葡萄糖残余含量与反应时间及温度的关系,采用Origin8.0 构建动力学方程,拟合效果较佳。
4 结论
谷氨酸-葡萄糖模式美拉德反应始终在酸性条件下进行,发生美拉德反应的介质环境总体稳定 (pH 值始终在5.0 左右),反应产物量(A294nm,A360nm)与温度和时间呈正相关,各温度、时间下葡萄糖含量变化符合Boltzmann 模型,符合动力学方程y=A2+(A1-A2)/{1+exp〔(x-x0)/dx〕},(R2均大于0.90),拟合效果较佳。

