食盐诱导的蛋黄凝聚行为研究进展
徐丽兰 赵 燕 徐明生 姚 瑶 涂勇刚*
(1 江西农业大学食品科学与工程学院 南昌330045 2 南昌大学食品科学与技术国家重点实验室 南昌330047)
凝胶化是蛋黄蛋白质的一个重要功能特性。禽蛋蛋黄含有丰富的低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、卵黄高磷蛋白和卵黄球蛋白等多种蛋白质,丰富的蛋白质组成对凝胶的形成奠定了物质基础。凝胶的形成不仅可以改善食品的形态和质地,而且在提高持水力、增加黏度、保持脂肪和粘结性等方面有诸多的应用。加热、高压、冷冻、乳化表面活性剂、酶、金属离子等均能诱导蛋黄蛋白质形成凝胶,而形成凝胶的物化特性、微观结构、凝聚机制上均有差异。
禽蛋在腌制过程中,高浓度食盐的作用,使咸蛋黄出现收缩、凝固和硬化,经过高温熟化后形成独特的“鲜、细、嫩、松、沙、油”等品质。在获得诸多特异品质的同时,大量的食盐被引入禽蛋中,尤其使咸蛋白中食盐含量高达7%~10%[1]。众所周知,过量钠的摄入会导致高血压,引起各类心脑血管疾病的发生[2]。近年来,全球掀起了降低食盐含量,开发食盐替代品的研究热潮。咸蛋作为一种大宗蛋制品,首当其冲成为重要的降低食盐含量的研究对象之一。随着蛋制品加工行业的蓬勃发展和咸蛋加工规模的日益增长,科研工作者对咸蛋加工做了大量的研究,并取得一定的进展[3-6],然而在低盐化技术方面的结果却不甚理想。究其原因在于目前咸蛋的成熟过程与凝胶形成机制尚不完全明确,使低盐化工艺改进缺乏针对性。
本文在阐述蛋黄凝胶化行为的基础上,重点综述食盐诱导下蛋黄凝聚行为的研究进展,为咸蛋品质的控制与工艺改进提供理论指导。
1 蛋黄的凝聚行为
蛋黄的组成成分复杂且多样,其通过轻微的离心可被分成浆液(plasmas)和颗粒(granules)两个部分,且不会引起蛋白质变性[7]。浆液由LDL(85%)和卵黄球蛋白(15%)组成,占蛋黄干物质的78%;颗粒主要是由HDL(70%)、LDL(12%)和卵黄高磷蛋白(16%)组成,占蛋黄干物质的22%[8]。无论是蛋黄还是其组分浆液和颗粒均能在适当的条件下发生凝胶化作用。蛋黄凝胶化行为经过蛋白质分子链的展开、结合和聚集等几个历程,充分伸展的蛋白质分子链相互交联形成三维网状结构,并能固定大量的水分,形成凝胶[9]。目前,蛋黄凝胶诱导方法主要可分为物理 (加热、 高压、冷冻)、化学(金属离子、乳化表面活性剂)和生化(各种酶反应)等诱导方法,且这些不同的诱导方法均能使蛋黄蛋白质分子链发生改变,引起蛋白质构象与构型发生改变,但凝聚的分子作用力不同,从而使蛋黄蛋白质形成不同类型和功能各异的凝胶结构,具体总结如表1。

表1 不同诱导方式对蛋黄凝胶形成的影响Table 1 Effect of different induction methods on yolk gelation formation
2 食盐诱导的蛋黄凝胶物化特性和微观结构
2.1 食盐对蛋黄物化特性的影响
蛋黄随着食盐的腌制作用会发生物理和化学性状的改变,如水分含量、食盐含量、pH 值、出油率、流变与质构特性等。腌制成熟的咸蛋黄可以划分为外层蛋黄和内层蛋黄两个区域,在食盐作用下两区域的理化特性变化略有不同。
2.1.1 水分与食盐含量 随着腌制时间的延长,蛋黄的水分含量逐渐下降,食盐含量逐渐上升。Chi 等[24]研究发现鸭蛋在腌制7 周后外部蛋黄的水分含量下降了9.3%,内部蛋黄的水分也下降了10%左右。在之后Kaewmanee 等[25]的研究结果显示在鸭蛋腌制2 周后,内部蛋黄的水分含量下降了7.3%,外部蛋黄的水分含量下降了23.46%。虽然,水分含量下降的幅度在两者的研究中不一样,但总体的趋势相似,其原因可能是腌制方法、腌制液食盐浓度、腌制时间等差异所产生。但是过长时间的腌制蛋黄中的水分含量增加。Lai 等[4]长期采用盐水浸泡法对鸭蛋蛋黄品质的变化研究发现将蛋黄腌制24 周后,水分含量增加,可能是随着盐含量的增加削弱了蛋黄膜,使得蛋白中的水分进入蛋黄中。这也提示将蛋黄蛋清分离腌制时,要注意蛋黄膜不能被破坏。
在食盐的作用下,蛋黄内的亲水基团和亲脂基团分离,蛋黄内自由的水分子相对增加,并透过膜结构和蛋白层,逐渐扩散转移到蛋壳外,且随着食盐腌制的深入,蛋黄食盐含量愈多,含水量越低、蛋黄脱水加剧,腌制成熟的咸蛋黄含水量降至20%以下,较腌制前下降了30%以上[25-26]。
2.1.2 出油率 高出油率是咸蛋黄独特理想的特征之一,Lai 等[27]在研究鸭蛋在腌制过程中生熟蛋黄的出油率时发现,在腌制第5 周后,生咸蛋的内部蛋黄的出油率值不到0.03,而外部蛋黄的出油率明显比内部蛋黄的高;加热处理后的咸蛋蛋黄在腌制任何时期都比未加热处理的咸蛋蛋黄出油率高。蛋黄出油增加的原因可能是,在食盐的作用下,使得LDL 结构被破坏和盐析导致出油率增加。
2.1.3 pH 值 由于食盐的渗入和脱水作用,会破坏蛋清中的溶菌酶等碱性蛋白、 蛋内含水量下降与蛋内二氧化碳的排出及蛋黄脂肪百分含量的增加,促使蛋内pH 值发生变化。在腌制的30 d 中,蛋清pH 值下降,由碱性向中性发展;而蛋黄的pH值则继续向酸性发展,从腌制前的6.42 下降到6.03,下降趋势较缓[28]。Haiyang 等[5]研究表明蛋黄pH 值轻微的减小对LDL 凝胶的形成有重要的影响,会增加LDL 表面的电荷密度;pH 值接近等电点,蛋白质与蛋白质分子间的静电斥力减小,促进蛋白质与蛋白质、蛋白质与溶剂之间的相互作用,促进凝胶的形成。
2.1.4 流变与质构特性 随着腌制时间的延长,蛋黄内食盐的含量增加,脱水作用增加,蛋黄本身稳定的溶胶状态被破坏,黏度增加,密度增大,由原来溶胶状态转变为质地坚硬而具有弹性的凝胶。Harrison 等[29]研究发现,添加食盐含量为10%时,能够增加鸭蛋黄的黏性。后来,Kaewmanee等[30]研究指出食盐含量和渗透脱水作用对鸭蛋黄的黏度和加热诱导凝胶性质有着重要的影响,当食盐含量在0%~3%范围内时就能诱导蛋黄溶胶-凝胶的转变,导致黏弹性发生显著的变化;当用高浓度食盐处理蛋黄时,能够导致蛋黄蛋白质分子的聚集,形成较好的凝胶网络结构;加热处理时,当食盐含量达到1.5%时,脱水作用是凝胶网络结构形成的主要原因,鸭蛋黄添加食盐能够稳定蛋白质分子并提高变性温度延缓凝胶网络的形成。
蛋黄在腌制过程中盐分由外向内渗入,造成蛋黄中水分不断由内向外迁移,水分减少,蛋黄由外向内变硬,硬度不断增加。Kaewmanee 等[31]研究发现随着腌制时间的增加,蛋黄硬度增加,到达2~3 周时蛋黄的硬度达到最大,再继续腌制后硬度又减小。同时,卫惠萍等[32]研究也得出相似的结论。随着腌制的进行,蛋黄油逐渐被析出与蛋黄球颗粒随之破裂,导致蛋黄硬度逐渐减小。
2.2 食盐对蛋黄微观结构的影响
2.2.1 蛋黄球的微观结构 Bellairs 等[33]用扫描电镜观察发现蛋黄球颗粒主要有深色蛋黄球颗粒(25~150 μm)和浅色蛋黄球颗粒(4~75 μm)两种,两者的表面均有次颗粒结构,且黄色蛋黄球颗粒的次颗粒结构较小而多,浅色蛋黄球颗粒的次颗粒结构紧密。Hsu 等[34]利用冷冻扫描电镜观察蛋黄球体的结构特征,指出其为表面和边缘形状不均匀、大小为50~100 μm 的球形多面体。目前没有证据表明这些相邻的蛋黄多面球体之间发生了交联作用[35]。
Kaewmanee 等[36]用透射电子显微镜观察咸蛋黄发现,蛋黄球体表面有球形的油滴(droplets),而在新鲜蛋黄球体中没有发现,这可能是食盐的腌制作用,LDL 结构被破坏和部分脂质从蛋黄内被释放出来而变得游离;利用共焦激光扫描显微镜中可以看出,新鲜蛋黄中的脂质和蛋白质分布均匀,而在腌制14 d 后的咸蛋黄中的脂质和蛋白质的形状、大小不同,可能原因是,随着腌制的进行,咸蛋黄黏度和硬度变大导致蛋黄很难分散在染色液中。随着食盐腌制时间的延长,蛋黄球体呈接近球形表面平滑的多边体结构,蛋黄球体逐渐变小,直径在30~75 μm 范围变动,蛋黄球体之间连接得更加紧密,但是蛋黄球体之间有裂缝,这些裂缝的形成可能是由于蛋黄球水化作用煮熟后流露出的蛋黄油填充在蛋黄球颗粒之间;在腌制期间蛋黄球表面出现纤维网状结构,这些丝状结构蛋白可能是LDL[27]。早先,有研究指出蛋黄球体的完整性是咸蛋黄具有坚韧质地的原因[24-25]。后来,Lai 等[27]的研究也证明了蛋黄在腌制过程中,蛋黄球体虽然在构像上发生了变化,但是蛋黄球体结构依旧完好无损;然而,Chi 等[23]却发现盐能够使蛋黄球发生破裂。上述两者研究出现差异的原因可能是由于食盐腌制液浓度、腌制时间、腌制方法等不同导致。近来,Kaewmanee 等[30]用不同浓度食盐和不同程度脱水作用对蛋黄微观结构的研究发现,在不加食盐处理时,发现有大量的圆形小球(粒径为1~5 μm)被困于纤维网络结构中,这些圆形小球代表的是蛋黄颗粒,悬浮在凝胶结构中;随着食盐含量的增加,这些蛋黄颗粒结构被破坏、孔洞直径变小和网络结构变得更加致密,蛋黄凝胶体是由被破坏的蛋黄颗粒和类似毛孔的结构组成。
2.2.2 蛋黄颗粒蛋白的微观结构 蛋黄颗粒是由HDL、LDL 和卵黄高磷蛋白通过钙磷桥连接在一起,在它们连接之间会有丝氨酸残留,形成不溶性的复合物[37]。Chang[38]用透色电子显微镜观察蛋黄颗粒的微观结构指出蛋黄颗粒是由复杂的、 高度致密的电子子单元构成。HDL 与LDL 相比,含脂质量少,并且脂质大部分存在于分子的内部,通过5 个二硫键、一些离子和疏水相互作用,与卵黄高磷蛋白形成复体,存在于颗粒结构中。Causeret 等[39]认为颗粒蛋白形成球形结构的原因是HDL、LDL和卵黄高磷蛋白通过离子键的连接而导致的。另外,有研究[40]指出LDL 被困于HDL-卵黄高磷蛋白的复合结构体中,连接在HDL 之间,如图1所示。
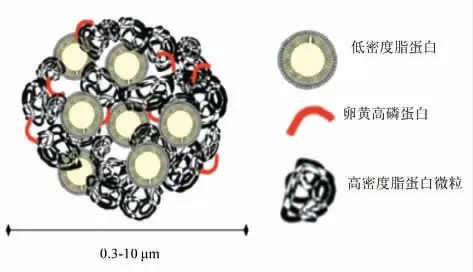
图1 蛋黄颗粒在pH 6.5 时模型示意图Fig.1 Schematic model proposed for egg yolk granule at pH 6.5
电子显微镜观察发现生蛋黄颗粒表面是由完整的圆形体紧密地堆积在一起,每个圆形颗粒形体的直径平均在0.5~2 μm 范围内变化[41]。之前Chang 等[37]研究指出蛋黄颗粒的直径在0.3~2 μm范围内变动。然而,最近Strixner 等[39]使用不同的离心力测定蛋黄颗粒的直径在0.8~10 μm 范围内变化。由此可见,在不同的操作条件下,蛋黄颗粒的分子结构差异显著。Chang 用透射电子显微镜观察蛋黄颗粒的微观结构发现,HDL 是致密的电子微粒。Naderi[42]利用共焦激光扫描电镜观察生蛋黄颗粒得出,在低浓度食盐时,蛋黄颗粒被破坏并朝着同一个方向形成致密的结构;当食盐浓度达到0.25~0.55 mol/L 时,颗粒被溶解,形成假颗粒(颗粒结构被扩展)的直径变得比原来大。直径变大的原因可能是卵黄高磷蛋白被破坏,离子桥减少。然而,Causeret 等[7]采用电子显微镜观察发现,不论蛋白质浓度为多少,当蛋黄的食盐浓度达到0.58 mol/L 时,这时就会发生颗粒体的崩裂,是因Na+取代Ca2+致使颗粒中的磷-钙架裂解。
总的来说,蛋黄在食盐腌制期间会发生一系列物理化学性状和微观结构的变化,随着腌制时间的延长,蛋黄水分含量和pH 值降低;食盐含量、出油率、黏度和硬度增加。在低浓度的食盐作用下,蛋黄颗粒蛋白的溶解度较低,大量钙磷桥导致HDL-卵黄高磷蛋白通过离子键的连接形成复杂的颗粒蛋白球形体和微弱的疏水作用;在高浓度食盐作用下,使蛋黄球体和蛋黄颗粒破裂,蛋黄球体直径变小,逐渐从不规则的多面体结构变成圆形的球体结构;蛋黄颗粒破裂后,Na+取代Ca2+的位置使形成的新的颗粒蛋白或HDL、 卵黄高磷蛋白等颗粒的释放,被释放的蛋白质聚集体与蛋黄球高度交联,促进蛋黄的凝胶,蛋黄产生沙质感可能是由于蛋黄球和颗粒结构的变化引起的。
3 食盐诱导的蛋黄凝胶内在分子凝聚机制
3.1 食盐对蛋黄蛋白质乳化特性和溶解性的影响
蛋黄中的LDL、 HDL、 卵黄高磷蛋白及卵黄球蛋白均能吸附到油水界面,具有较低的表面张力,所以蛋黄具有极佳的乳化能力。在较低离子强度下,颗粒主要是由不溶解的HDL-卵黄高磷蛋白通过钙磷桥连接在一起,这是因为HDL 和卵黄高磷蛋白含有较高含量的磷酸丝氨酸能够与Ca2+较好地结合在一起,大量的钙磷桥使得颗粒的结构更复杂,疏水性更弱,从而导致外部因素的作用下使蛋白质变性形成凝胶[7]。浆液的主要成分是LDL,由于LDL 具有相对较低的密度,因此能够在任何溶液中溶解。乳化特性与蛋白质的溶解性有着密切的关系,浆液在任何离子强度下都能被溶解[43]。浆液和颗粒乳化和溶解特性的相关研究总结见表2、表3。
由于浆液和颗粒的各自结构不同,在不同的条件拥有不同的乳化性。颗粒在高食盐浓度和中性条件下溶解性较好,相反地,在酸性条件下溶解性较差。然而,浆液在任何条件下都能溶解。随着食盐浓度的增加,浆液和颗粒的溶解度也随之增加。食盐能够降低浆液和颗粒的乳化稳定性,在酸性条件下浆液对乳化特性的影响最大;在中性条件下,乳化特性是由浆液和颗粒共同维持。在较低食盐浓度作用时,颗粒溶解度低与它的结构有关,此时,颗粒主要以HDL-Phosvitin 通过钙磷桥形成复合物的形式存在。当食盐浓度增大到一定值时,钙磷桥中的钙离子被钠离子取代,由于Phosvitin是可溶性蛋白质,HDL 也表现出溶解性,因此蛋黄颗粒蛋白质溶解度是随着食盐浓度的增加而增加。食盐浓度会影响蛋黄蛋白质的溶解度,从而影响其乳化性。然而,Chung 等[44]研究得出食盐浓度大于或等于0.5 mol/L 时,乳化稳定性会降低,分析其原因可能是脂肪小滴融合造成。迟玉杰等[45]研究不同的食盐浓度对全蛋粉乳化性质的影响发现,在较低的盐浓度范围内,随着食盐浓度的增加,全蛋粉的乳化活性和乳化稳定性呈先增加后减小的趋势,在0.5 mol/L 时达到最大。这可能是因为,加入较低浓度食盐会产生盐溶作用,蛋白质分子中带相反电荷的物质与粒子相互作用,形成了粒子群双分子层,加大了蛋白质分子之间的静电相互作用,从而增强了蛋白质的溶解作用[46];然而,在高浓度食盐的作用下,胶体的扩散双电层厚度被盐离子压缩,使得乳状液油滴表面电位减小,乳状液体系的斥力电位下降,油滴之间容易产生聚集,乳化稳定性减低。Nandi 等[47]指出添加食盐或破坏蛋白质之间的离子吸引力,影响氢键而间接加强蛋白质疏水性区的相互作用,也就是盐类会抑制水分与蛋白质亲水基的交互作用,进而影响蛋白质的溶解度。从中我们也可以看出食盐对蛋黄蛋白质的溶解性及功能性都有较大影响。因此在研究蛋黄及其组成成分的功能特性时要尽量保证其蛋白质溶解度尽可能大,比较三部分的功能特性时也尽量在相同溶解度条件下比较。

表2 蛋黄浆液和颗粒的乳化特性的相关研究Table 2 Survey of the literature on egg yolk plasma and granule related to emulsifying properties

表3 蛋黄浆液和颗粒的溶解特性的相关研究Table 3 Survey of the literature on egg yolk plasma and granule related to solubility properties
3.2 食盐对蛋黄蛋白质分子作用力的影响
3.2.1 二硫键 二硫键是维持蛋白质高级结构主要的次级键之一,在许多物理、化学及其他作用的条件下,二硫键会被破坏,形成巯基,从而破坏蛋白质的空间结构。有研究表明蛋黄中主要参与凝胶行为的蛋白质是LDL[54]。薛慧君[55]利用SDSPAGE 检测证实了LDL 中蛋白质成分包含5 种分子质量分别为130,80,65,60,15 ku 脱辅基蛋白,并且巯基基团存在于分子质量为15 ku 的唯一脱辅基蛋白中。郑华等[56]研究了食盐对咸蛋黄蛋白质特性的影响。结果表明,在食盐腌制过程中,蛋黄蛋白质中的巯基含量发生了变化,且在第3 周时,巯基含量达到最大值,而随后巯基含量逐渐减少。分析认为随着蛋黄中食盐含量的增加,维持蛋白质空间结构的二硫键在食盐作用下被破坏而断裂,生成巯基;而巯基含量的减少可能是由于蛋黄脱水,使蛋黄逐渐失去流动性,蛋白质浓度升高,且蛋黄中食盐含量也逐渐增加,蛋白质在食盐的进一步作用下,使巯基在新作用力的作用下又结合形成新的二硫键。
3.2.2 疏水相互作用 疏水相互作用是非极性分子之间的一种弱的、非共价的相互作用。这些非极性分子(如一些中性氨基酸残基,也称之疏水残基)在水相环境中具有避开水而相互聚集的倾向。疏水相互作用为蛋白质分子的折叠提供了主要的推动力,与蛋白质凝胶的形成直接相关。一定的疏水性对于蛋白质凝胶的组成和功能性质有较大的影响[18]。然而,食盐诱导蛋黄凝胶对疏水性的影响,在国内外鲜有研究。早前Harrison 等[29]的研究中指出,在低离子(食盐)强度下,食盐能够改变蛋黄蛋白质的静电相互作用;在高离子(食盐)强度下,食盐能够稳定蛋白质结构,是因为食盐的诱导作用使蛋白质周围的水分重新排列,水分子会优先和Na+结合,可能会引起蛋白质表面疏水性减弱,疏水相互作用增强。因此,这可能导致蛋白质分子之间的相互作用超过了蛋白质与溶剂之间的相互作用,从而导致蛋白质分子发生凝集作用[57]。
3.2.3 氢键 氢键是一类数量极大的弱偶极键,是蛋白质凝胶形成和维持凝胶结构的重要的分子作用力。有关蛋白质凝胶形成过程中氢键的变化研究较多,但有关食盐诱导蛋黄蛋白质凝胶的形成过程中氢键的变化,在国内外的研究中均鲜见报道。蛋白质的二级结构指的是蛋白质分子局部区域内,多肽链沿一定方向盘绕和折叠的方式,主要是由分子内的氢键维系的局部空间排列,包括α 螺旋、β 折叠、转角、无规卷曲等,而α 螺旋和β折叠结构中都含有大量的氢键,转角和无规卷曲无氢键。有研究表明:蛋黄在腌制过程中,二级结构中氢键变化较为明显,腌制成熟过程蛋白质的α 螺旋和β 折叠结构含量下降明显,成熟以后(第5 周)几乎无变化。而咸蛋黄呈现起沙现象的初期(第3 周)出现外部含量明显低于内部蛋黄的现象,这是由于外部脱水作用比内部强烈,导致外部氢键减弱明显,而内部变化缓和,和新鲜蛋较为接近[56]。
3.3 食盐对蛋黄蛋白质分子构象的影响
蛋黄凝胶化的形成是由于蛋白质天然分子结构发生变化,该变化使蛋黄由半流动的黏稠状变成固体或半固体(凝胶)状态。蛋白质的凝固分为两个阶段:变性和结块。变性就是在外界因素的作用下,(例如当蛋在受到热、高压、盐、机械等作用的干预时会发生变性凝固)蛋白质分子构象发生变化,主要是由于蛋白质分子天然结构中的次级键(如氢键、二硫键、盐键等)的变化,使蛋白质有规则的肽链结构(二级、三级、四级结构)打开呈松散型不规则结构。郑华等[56]通过研究FTIR 光谱对腌制过程中咸蛋黄中蛋白质二级结构的分析发现腌制过程导致了咸蛋黄蛋白质发生了二级结构的改变,即是蛋白质发生了变性;新鲜蛋黄蛋白质的二级结构以α 螺旋和β 折叠结构为主,食盐腌制后的α、β 结构部分转化为T 转角,二级结构中氢键明显减弱;SDS-PAGE 分析结果表明,腌制过程中尽管食盐对蛋黄蛋白质的空间结构造成了一定程度的改变,但并未对蛋白质的肽链结构发生作用,即使是腌制到第15 周,蛋白质的肽链结构与未经腌制时几乎是相同的;DSC 扫描表明盐分对蛋黄蛋白质的耐热性有促进作用。早先由Lydia等[58]的研究报道,在特定的加热温度以及加热时间下,混有金属盐的蛋黄液的蛋白质变性程度与离子浓度呈正相关性。近来,Drotleff 等[15]研究对蛋黄蛋白质分子构像的变化阐明,食盐能够增大蛋黄蛋白质的耐热性,且随着食盐浓度的增加,蛋黄蛋白质的变性温度上升;在高浓度食盐作用下,能够增强蛋白质的网络结构。
综上所述,蛋黄是一个复杂的乳化体系,食盐诱导后蛋黄蛋白质分子构象发生变化,蛋黄出现凝胶化,蛋黄蛋白质的乳化特性和溶解度发生变化,蛋黄蛋白质二硫键被破坏,疏水相互作用、氢键和静电力等作用力也可能发生改变。然而,目前国内外对单一食盐诱导蛋黄蛋白质作用力的改变研究较为薄弱,多数研究集中在食盐与其他诱导方式的协同作用对蛋黄蛋白质内在分子凝集的影响。因此,单一食盐诱导对蛋黄蛋白质内在分子凝集作用机制的影响仍需要进一步研究。
4 结语
咸蛋加工历史悠久,产量巨大,但科研者对咸蛋研究的重视程度却与其重要性远不相匹配,使其加工方式仍处于较为落后的状态。多年来,对咸蛋的研究主要集中在腌制过程中的物化特性变化、影响因素、加工工艺改进等方面,也取得了一定成果,并对促进咸蛋的科学生产起到了重要作用。但是,咸蛋加工过程中风味、质构、出油等品质形成的机理仍然未被完全阐明,尤其是对结构复杂的蛋黄球体的凝聚机制研究极其薄弱,这已成为阻碍进一步开展咸蛋工艺改进研究的瓶颈。鉴于此,后续应重点研究食盐诱导蛋黄凝胶化过程中蛋白质分子间的相互作用、 蛋白质构象变化以及蛋白质凝胶网络结构的主导作用力和参与凝胶组装的关键蛋白质组分,另外,蛋黄中高含量的脂肪在凝聚过程中必然与蛋白质发生交互作用,因此,脂肪在蛋黄凝聚过程中的作用也值得重点关注。

