单增李斯特菌核糖核酸酶Rnase III RncS氨基酸突变对其降解RNA活性的影响
王立霞 孟庆玲 乔军 蔡扩军 王登峰 伍晔晖 郭晶 才学鹏
(1. 石河子大学动物科技学院,石河子 832003;2. 乌鲁木齐市动物疾病控制与诊断中心,乌鲁木齐 830063;3. 新疆畜牧科学院兽医研究所,乌鲁木齐 830000;4. 中国农业科学院兰州兽医研究所,兰州 730046)
单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种革兰氏阳性人兽共患胞内寄生菌[1],能引起人和动物的李斯特菌病。作为重要的食源性致病菌之一[2],LM广泛存在于自然环境中,可在高盐、低温和低pH 值条件下生存,严重威胁食品安全和公共卫生[3-5]。同时,LM也是一种最常见的腐生菌,易污染动物饲草料,给畜牧业的发展造成严重的损失[6]。研究发现,LM的环境耐受能力和致病性与其基因组上编码的多种应激因子(VirR、Sigma B)和调控因子(PrfA、CodY)有着密切的关系[7],而非编码 RNAs(non-coding RNAs,ncRNAs)与这些蛋白分子组成了复杂的调控网络,对LM毒力和环境应激相关基因在转录、转录后和翻译水平进行精细调控[8]。
RibonucleaseⅢ(RnaseⅢ)是一种保守性较高的双链RNA特异性核酸内切酶,其中细菌RNase III主要在rRNA成熟,mRNA降解和sRNA加工、转换和sRNA依赖性mRNA降解中起作用[9-10]。前期研究证实[11],LM RnaseⅢ是一种依赖于二价金属阳离子的磷酸二酯酶,当镁离子存在时,该酶可发挥降解双链结构的RNA的活性,且随镁离子浓度不同其降解活性不同。然而,LM RnaseⅢ发挥酶活中的关键氨基酸位点至今尚未报道。鉴于此,本研究利用SOE-PCR技术构建LM- RnaseⅢ-D50A、LMRnaseⅢ-E122A突变体,通过体外酶活试验检测其对RNA降解活性的变化,为深入揭示LM RnaseⅢ的作用特点和调控ncRNAs的分子机制奠定前期基础。
1 材料与方法
1.1 材料
LM-SB5野毒株由石河子大学动物疾病防控兵团重点实验室保存;大肠杆菌DH5α、BL21(DE3)和pET-32a(+)原核表达载体由本实验室保存;重组RnaseⅢ RncS由本实验室前期构建保存;Taq DNA聚合酶、dNTPs、pMD19-T载体、限制性核酸内切酶EcoRⅠ、XhoⅠ、T4 DNA Ligase、DL-2 000 DNA Marker、DL-5 000 DNA Marker、蛋白 Marker、Trizol购自TaKaRa公司;MgCl2和MnCl2均购自北京北化精细化学品有限责任公司;兔抗LM阳性血清由本室制备;细菌基因组DNA提取试剂盒、质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒、辣根过氧化物酶标记的山羊抗兔IgG、低背景化学发光检测试剂盒购自TIANGEN公司。
1.2 方法
1.2.1 引物设计 根据前期扩增的rncS基因序列及生物信息学分析结果,通过Primer 5.0软件设计扩增rncS基因突变型D50A、E122A的特异性引物:D50A、E122A fragment1的扩增引物分别为H1、H2和R1、R2;D50A、E122A fragment1的扩增引物分别为H3、H4和R3、R4;重叠延伸PCR的引物分别为H1、H4和R1、R4;分析表达载体pET-32a(+)多克隆位点的情况,在H1、H4和R1、R4引物的5’端分别加酶切位点EcoRⅠ和XhoⅠ(下划线)及保护性碱基(斜体)(表1)。引物由北京六合华大基因生物公司合成。
1.2.2 LMrncS基因结构域分析及突变位点的选择 应用在线生物信息学分析软件SMART(http://smart.embl-heidelberg.de/smart/)预测 RnaseⅢ RncS蛋白结构域;在NCBI中检索大肠杆菌、金黄色葡萄球菌、嗜热杆菌、布鲁氏菌等的RnaseⅢ氨基酸序列,利用DNAMAN 5.2.2软件进行多序列比对,选择高度保守的关键氨基酸进行突变。
1.2.3 LMrncS突变基因D50A、E122A的构建与测序鉴定 提取LM-SB5菌株基因组DNA,以基因组DNA为模板,用H1/H2 和H3/H4两对引物分别扩增D50A fragment1和fragment2,用R1/R2 和R3/R4两对引物分别扩增E122A fragment1和fragment2。SOEPCR 采用 25 μL反应体系:水 14.8 μL,fragment1和 fragment2 各 3 μL,10 × PCR buffer 2.5 μL,2.5 mmol/Lol/L dNTPs 1.5 μL,TaqDNA 聚 合 酶 0.2 μL。PCR反应条件:94℃预变性5 min;94℃变性45 s,55℃退火40 s,72℃延伸45 s,13个循环;再加入H1/H4和R1/R4引物各0.5 μL扩增片段的全长,反应条件:95℃预变性4min;95℃变性50 s,65℃退火40 s,72℃延伸1 min 40 s,30个循环;72℃延伸l0 min。经1%琼脂糖凝胶电泳鉴定后回收目的片段,并将目的片段克隆至pMD19-T Simple载体中,挑取阳性单克隆进行测序,构建突变质粒pMD19-TD50A和pMD19-T-E122A。

表1 构建突变型D50A、E122A的特异性引物
1.2.4 突变型重组表达载体的构建与鉴定 将pET-32a(+)原核表达载体与测序正确的pMD19-TD50A和pMD19-T-E122A质粒用限制性核酸内切酶EcoRⅠ和XhoⅠ同时进行双酶切。回收目的片段和载体片段后用T4 DNA连接酶连接,构建突变型重组表达载体。经菌液PCR和双酶切鉴定,将鉴定正确的突变型重组表达质粒命名为pET32a(+)-D50A和 pET32a(+)-E122A。
1.2.5 突变型重组蛋白的诱导表达、纯化及Western blot鉴定 将鉴定正确的突变型重组表达质粒转化至大肠杆菌BL21(DE3)中,在Amp抗性的液体LB培养基中37℃培养至OD600nm为0.6-0.7,用IPTG进行诱导8 h,同时设置空载体对照,然后进行SDS-PAGE分析,利用镍离子亲和层析法纯化突变型重组蛋白,同时,以兔抗LM阳性血清为一抗,辣根过氧化物酶标记的山羊抗兔IgG为二抗,进行Western blot分析。
1.2.6 突变型重组RnaseⅢ D50A和RnaseⅢ E122A对RNA降解活性研究 提取LM 总RNA,分析LM重组 RnaseⅢ RncS突变对RNA降解活性的影响。设立RNA的空白对照和未突变的重组RnaseⅢRncS对照,同时,设立不同浓度的MgCl2和MnCl2,采用 20 μL 反应体系:RNA 7 μL、RnaseⅢ RncS、RnaseⅢ D50A 和 RnaseⅢ E122A 均 3 μL、MgCl2(MnCl2)X,加Urtrapure water 10-X μL。将纯化好的重组RnaseⅢ RncS及突变型重组LM RnaseⅢ D50A和LM RnaseⅢ E122A适当稀释,在不同浓度MgCl2(MnCl2),37℃条件下水浴15 min,反应产物经琼脂糖凝胶电泳后用凝胶成像系统观察,定性地分析LM重组RnaseⅢ RncS突变对RNA降解活性的变化。同时,选取最佳浓度的MgCl2和MnCl2,按上述操作步骤,37℃条件下水浴15 min后分别测定各组的RNA浓度,并利用统计学方法定量分析LM重组RnaseⅢ RncS突变对RNA降解活性的变化。
2 结果
2.1 LM rncS结构域分析及突变位点的选择
SMART 软件分析结果显示,LM-RnaseⅢ蛋白氨基酸序列含有1个核酸酶结构域(RIBOc,19-154)和1个双链RNA结合结构域(DSRM,160-227),其中核酸酶结构域RIBOc中有含有5个活性位点(active,43、46、50、119、122)(图 1)。通过DNAMAN多序列比对发现,这5个活性位点高度保守。
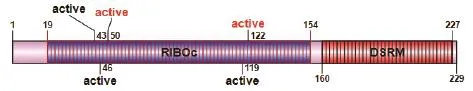
图1 LM-RnaseⅢ RncS蛋白结构域模式图
2.2 LM rncS基因突变型D50A、E122A fragment1、
fragment2的扩增及重叠延伸PCR扩增结果
以LM 基因组DNA为模板,用H1/H2、H3/H4及R1/R2、R3/R4特异性引物分别扩增突变型D50A、E122A的fragment1和fragment2,分别扩增得到161 bp、529 bp、374 bp、316 bp的目的条带,与预期结果一致。采用重叠延伸 PCR技术融合fragment1和fragment2,得到与预期值690 bp 相符的目的条带(图2);阳性克隆pMD19-T-D50A和pMD19-T-E122A测序后的对比分析表明D50A、E122A已成功突变。
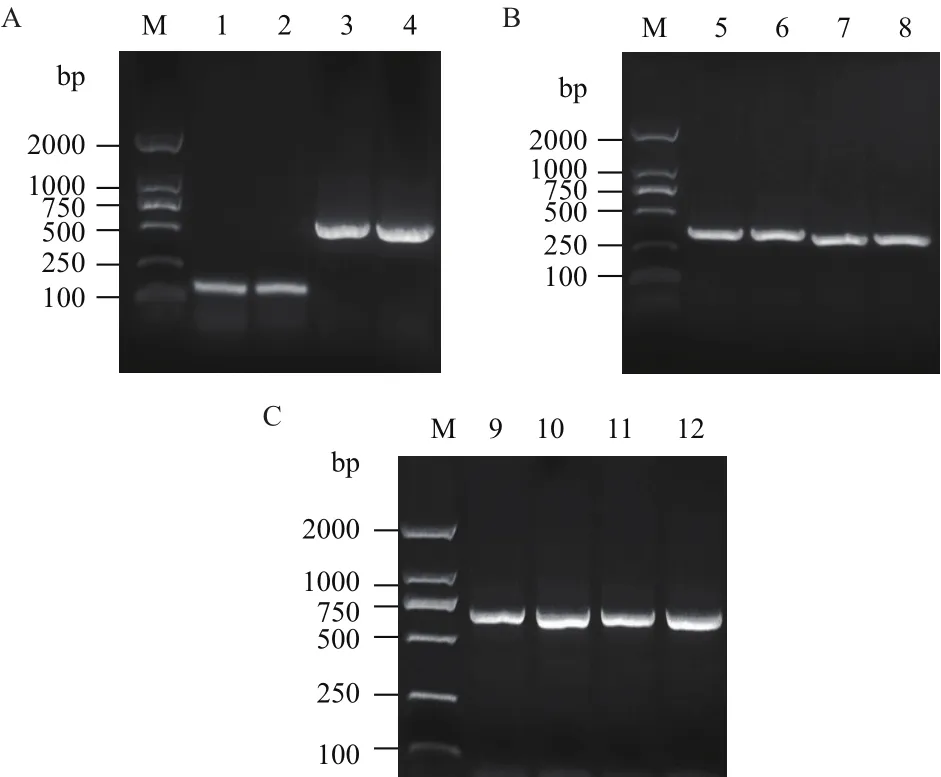
图2 rncS基因突变株的克隆结果
2.3 突变基因重组表达载体的构建与鉴定
突变型重组质粒pET-32a(+)-D50A和pET-32a(+)-E122A用EcoRI/XhoI双酶切得到均为690 bp的目的条带和5 900 bp的pET-32a(+)片段(图3),表明成功构建了pET-32a(+)-D50A和pET-32a(+)-E122A突变型重组原核表达载体。
2.4 重组突变体D50A和E122A的诱导表达、纯化与Western blot分析鉴定

图3 rncS基因突变型重组质粒双酶切鉴定
将构建好的突变型重组表达载体pET-32a(+)-D50A和pET-32a(+)-E122A转化至大肠杆菌BL21(DE3)感受态细胞,筛选阳性菌,经IPTG诱导表达8 h后,通过SDS-PAGE分析,突变型重组菌pET-32a(+)-D50A和pET-32a(+)-E122A均出现了分子质量为42.5 kD的特异性蛋白条带。纯化蛋白经 SDS-PAGE分析显示,在相对分子质量约42.5 kD处可见单一条带,大小与预期值一致,结果表明纯化的蛋白效果较好。经Western blot分析鉴定,该突变型重组蛋白能与兔抗LM阳性血清发生特异性反应,表明克隆的LMrncS基因突变型D50A、E122A在大肠杆菌中获得表达(图4)。

图4 突变型重组蛋白SDS-PAGE和Western blot分析
2.5 重组突变体RnaseⅢ D50A和RnaseⅢ E122A降解RNA活性分析
结果(图5、图6)显示,当缺乏Mn2+时,RnaseⅢ不能降解RNA,在低浓度的Mn2+和Mg2+条件下,RnaseⅢ的降解活性都较低,随着离子浓度的增大,其降解活性也升高,其中Mn2+浓度为50 mmol/L,Mg2+浓度为10 mmol/L时,RnaseⅢ具有较强的降解活性,但当Mn2+浓度大于100 mmol/L时,其降解活性减弱;在Mn2+浓度为50 mmol/L,Mg2+浓度为10 mmol/L的条件下,与对照组相比,将RnaseⅢ RncS第50位的天冬氨酸突变后,其降解活性减弱(P<0.001),第122位的谷氨酸突变后降解活性显著下降(P<0.000 1)(图7),表明RnaseⅢ发挥降解活性依赖于Mn2+或Mg2+,其中第122位的谷氨酸是维持RnaseⅢ RncS活性的关键位点。

图5 Mn2+对RnaseⅢ及其突变型降解活性的检测
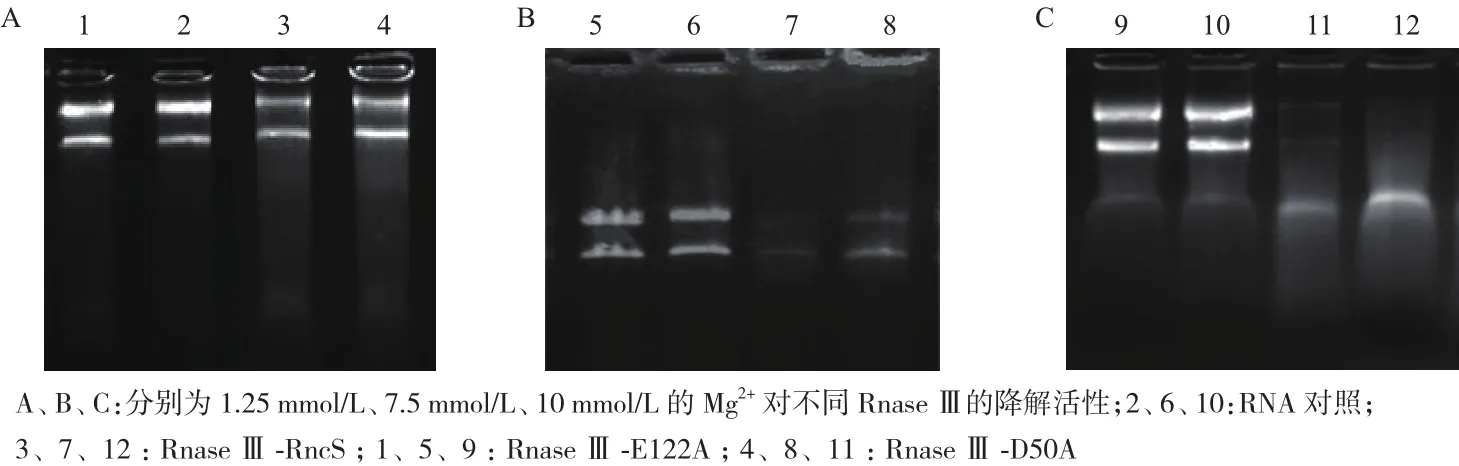
图6 Mg2+对RnaseⅢ及其突变型降解活性的检测

图7 RnaseⅢ及其突变型降解活性的检测
3 讨论
RnaseⅢ是一种广泛存在于细菌、真核生物及噬菌体中的能够切割具有双链结构RNA的核酸酶,Wanger[12]和 Darfeuille[13]等在大肠杆菌和沙门氏菌中研究证实,RnaseⅢ均参与了ncRNA的调控,影响基因的表达,从而调控细菌在宿主体内的生存。研究发现,ncRNA在LM毒力和环境应激适应过程具有重要的作用[14],然而,目前有关RnaseⅢ介导的ncRNA对其调控作用尚未研究。
序列比对发现,不同来源的细菌RNase III是一种保守性较高的酶家族,均含有9个保守氨基酸(ERLEFLGDA)组成的RNase III 识别基序,是维持其酶降解活性的重要位点。RNase III起同源二聚体的作用,通过核糖核酸酶结构域发生二聚化,两个核糖核酸酶结构域组合形成单个加工中心,每个结构域有助于双链底物的一条RNA链的水解[15]。Blaszczyk等[16]在嗜热杆菌(Aquifex aeolicus)Aa-RNase III与dsRNA复合体晶体结构中研究发现,两个RNase III单体通过NucD区的疏水作用和氢键结合形成二聚体结构,在两个单体作用界面形成一个催化谷(valley)结构用于结合RNA。因为单体蛋白靠近,来自同一亚基的五个酸性残基E38、E41、D45、D114和E117和一个来自伴侣亚基的E65簇位于催化谷的两端组成一个活性中心。在大肠杆菌中研究发现,E38参与蛋白质二聚化;E65参与底物识别和裂变键选择[15];D45、D114和D117螯合Mn2+离子[17];E41、D45、D114和 E117进行易断裂键的水解[18]。本研究通过生物信息学分析发现,LM-RNaseIII含有1个核酸内切酶结构域(RIBOc)和1个dsRNA结合结构域(DSRM),且核酸酶结构域RIBOc中的5个活性位点在其它细菌RNaseIII中高度保守。
目前,细菌RNaseIII蛋白是研究最广泛的一类磷酸二酯酶[19]。Sun等[17]研究发现大肠杆菌RNaseIII发挥降解活性依赖于Mn2+或Mg2+。另外,Blaszczyk等[20]在嗜热杆菌中研究发现,Mn2+或Mg2+离子为RNase III发挥活性所必须;当其第110位的E突变为K后,Aa-RNase III-E110K能与dsRNA结合,但失去切割活性。Lioliou等[21]将金黄色葡萄球菌RNase III中的残基E135和D63均突变成丙氨酸后,证实Sa-RNase III-D63A和Sa-RNase III-E135A降解活性显著降低。许先进[22]将布鲁氏菌 RNase III中的E54、D61、E81、E133均突变成丙氨酸后,证实这四种突变蛋白均能与布鲁氏菌自身编码的dsRNA BM-pre-0015结合,但RNaseIIIE133A的结合能力和切割活性显著降低,表明E133是其发挥酶活所必须的。本研究通过体外酶活试验检测发现,不同浓度的Mn2+或Mg2+对LM-RNaseIII的降解活性不同,其中Mn2+为50 mmol/L、Mg2+为10 mmol/L时具体较好的降解活性。另外,构建的LM-RNase III-E122A突变体降解活性显著降低,提示LM-RNase III中的第122位谷氨酸是其维持酶活性的关键位点,为进一步揭示RnaseⅢ对LM ncRNA的作用方式和调控机制奠定前期基础。
4 结论
本研究利用生物信息学软件分析了LM-RNaseIII结构域,结果显示,LM-RnaseⅢ氨基酸序列含有1个核酸酶结构域(RIBOc)和1个双链RNA结合结构域(DSRM),其中结构域RIBOc中有含有5个活性位点;应用SOE-PCR技术构建了突变型LM-RnaseⅢ-D50A和LM-RnaseⅢ-E122A,并通过体外酶活实验检测显示,RnaseⅢ发挥降解活性依赖于Mn2+或Mg2+,将其第50位天冬氨酸突变后,RnaseⅢ RncS的降解活性有所降低;第122位谷氨酸突变后,RnaseⅢ RncS 降解活性显著下降,提示第122位谷氨酸是维持LM RnaseⅢ RncS酶活性的关键位点。

