C57BL/6J 背景基因修饰小鼠精子冷冻保种及品系恢复方法
牛博文, 陈丽香, 朱孟敏, 彭秀华, 秦波音, 李 峰
(上海市公共卫生临床中心, 上海 201508)
TALEN、CRISPR/Cas9 等基因编辑技术的出现和发展极大缩短了基因修饰小鼠的制备周期,大量的靶位点修饰、转基因小鼠被应用于基因功能的研究,这些品系小鼠的活体保种工作也成为各研究机构工作的重要部分。配子冷冻保种是将小鼠精子、卵子以及胚胎保存在极低温度下,使其新陈代谢完全停止的一种保种方式,被认为可以替代活体保种[1]。配子冷冻保存一方面可以防止品系的遗传漂变,减少各种因素造成的品系丢失,另一方面可以减少活体保种带来的人力财力消耗。常用的品系保存方法包括胚胎冷冻法和精子冷冻法。精子冷冻相比于胚胎冷冻操作更加简单,仅需要少量的雄鼠即可完成,同时在复苏后可以在短时间内繁育出大量后代。对于大多数品系小鼠而言最常用的冷冻液由18%棉子糖和3%脱脂奶粉组成,但是对于C57BL/6J 等品系小鼠,该冷冻液复苏后受精率在10%以下[2,3], 而大多数基因修饰鼠以C57BL/6J为背景鼠,所以改善该品系的精子冷冻和复苏效率尤为重要, 本文主要围绕精子冷冻液、精子复苏方法和冷冻精子体外受精(IVF)等方面进行探索及优化。
1 材料与方法
1.1 实验动物
3~6 月龄C57BL/6J 雄鼠、4 周龄C57BL/6J 雌鼠、8 周龄ICR 雌鼠均为SPF 级, 购自上海西普尔-必凯实验动物有限公司[SCXK(沪)2013-0016]; 基因修饰小鼠为上海市(复旦大学附属)公共卫生临床中心实验动物部 [SCXK(沪)2015-0002]保种品系, 均饲养于上海市公共卫生临床中心实验动物部[SYXK(沪)2015-0008]SPF 动物设施内,饲喂以高压灭菌水和60Co 辐照饲料,饲养室相对湿度(50±10)%,温度(23±3)℃, 光照12 h 明暗交替。
1.2 主要试剂仪器
M2 培养液(MR-015P-D)、KSOM 培养液(MR-020P-5F)、HTF 培养液(MR-070-D)、棉子糖(R0250)、MTG(56454)、GSH(G4251)、聚乙烯醇(polyvinyl alcohol,PVA,P8136)均购自德国Merck 公司; 脱脂奶粉(A600669)、D-PBS 均购自生工生物工程(上海)股份有限公司; 孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG)均购自宁波第二激素厂, 0.25 mL 细管(005565, 法国卡苏公司),培养皿(美国Corning 公司),体式显微镜(SZ61,日本Olympus 公司),显微手术镊(苏州施强医疗器械公司),水浴锅(上海精宏实验设备公司)。
1.3 主要溶液配制方法
1.3.1 冷冻保护液配制 R18S3 冷冻液: 将9 g 棉子糖加至30 mL 去离子水中, 80 ℃水浴锅中加热30 s使其完全溶解, 再加入1.5 g脱脂奶粉, 定容至50 mL,室温15 000×g 离心20 min,弃沉淀,重复两次直至上清液透明,0.22 μm 过滤器过滤。M-R18S3冷冻液: 每50 mL R18S3 冷冻液中加入2 μL MTG,0.22 μm 过滤器过滤,分装,-20 ℃保存[11]。
1.3.2 GSH配制 准确称取GSH 30.4 mg,用1 mL无菌超纯水, 0.22 μm 过滤器过滤, 分装,-20 ℃保存,此溶液浓度为100 mmol/L,使用前每100 μL HTF 培养液中加入1 μL 进行稀释。
1.4 实验方法
1.4.1 冷冻装置 冷冻装置为高约20 cm 的泡沫保温盒,液氮高度为10 cm,将厚度约为0.5 cm 的泡沫板漂浮在液氮表面,在冷冻前30 min 泡沫盒中加入液氮预冷泡沫漂浮板。
1.4.2 冷冻方法 ①低浓度精子冷冻法:无菌取出3~6 月龄雄鼠附睾尾及1.5 cm输精管,在D-PBS中用显微镊剥离脂肪和血管,清洗干净后放入含有1 mL 冷冻液的培养皿中,用1 mL 注射器针头将附睾尾划破,挤压出附睾尾及输精管中的精子, 37 ℃温箱中放置10 min。培养结束后,取1 μL 精子于D-PBS 中稀释10 倍,观察精子运动状况, 选择运动状况良好的精子, 按照图1 所示装入0.25 mm冷冻细管中, PVA 封口结束后立即放入预冷的液氮漂浮板上预冷10 min,之后投入液氮中长期保存。②高浓度精子冷冻法: 采集和冷冻方法同低浓度组,用120 μL 冷冻液悬浮撕开的附睾尾及输精管,每支细管装入10 μL(0.5 cm)冷冻精子。
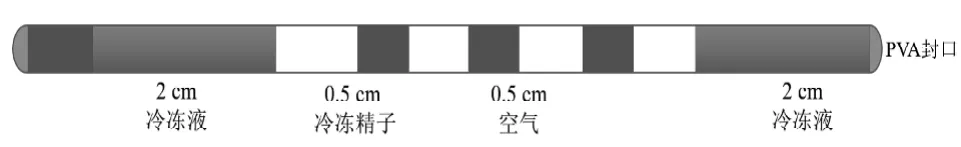
图1 0.25 mm 冷冻细管填装冷冻精子示意图
1.4.3 冷冻精子复苏 在雌鼠注射hCG后12 h开始复苏精子。将细管从液氮中拿出,在空气中停留5 s,立即投入37 ℃水浴锅中,1 min 后取出,擦干细管表面水分,剪掉两端冷冻液,将精子吹入空的培养皿中。①低浓度精子冷冻组,用枪头将10 μL 复苏的精子(约106个)吹入含200 μL HTF 培养液的受精皿中,37 ℃,体积分数5% CO2培养箱中孵育1 h; ②高浓度精子冷冻组,用10 μL 枪头将复苏的精子(约107个)吹入含80 μL HTF 的获能皿中,37 ℃,体积分数5% CO2培养箱中放置30 min 后用枪头在获能滴的边缘吸入10 μL 活动精子并转移至含200 μL HTF 的受精皿中,培养箱中孵育30 min。
1.4.4 体外受精(IVF) 小鼠超数排卵: 4周龄C57BL/6J 雌鼠按每只5 IU 腹腔注射PMSG,47 h 后按每只5 IU 腹腔注射hCG; 在精子复苏后30 min开始收集卵丘卵母细胞复合体(COCs)。无菌取出超数排卵的雌鼠输卵管,在体式显微镜下用1 mL 注射器针头撕开输卵管壶腹部,轻轻挤压出COCs, 在HTF培养液中清洗3 遍; 用200 μL 枪头将COCs 转移至含有精子的受精液中。4~6 h 后用枪头吹散粘附在卵母细胞表面的精子, 转入M2培养液中清洗5遍后将胚胎转移至过夜平衡的KSOM 培养液中培养。
1.4.5 胚胎移植 取0.5 d假孕ICR受体鼠, 麻醉, 剔除背部毛发,酒精及碘酊消毒,剪开脊柱背侧皮肤,剪开脊柱两侧0.5 cm 处肌肉层,在此创口处用钝头镊子夹住脂肪垫拉出附带的卵巢及输卵管,用脂肪夹固定,在体视显微镜下找出输卵管壶腹部,用1 mL 注射器针头在壶腹部前侧刺一切口,之后将移卵针中的卵裂胚胎经此切口吹入输卵管壶腹部(可用气泡作为标记),再将输卵管及卵巢放回腹腔,分别缝合肌肉层及皮肤,碘酊消毒。
2 结果
2.1 不同组合精子冷冻液及IVF液的冷冻复苏效率
以低浓度精子冷冻法进行精子冷冻,复苏后与C57BL/6J 品系雌鼠卵子孵育进行IVF,对比表1中几种不同组合的精子冷冻液和IVF液的胚胎发育情况(表1),用R18S3 或M-R18S3 进行精子冷冻,复苏后以HTF培养液进行IVF,2-细胞发育率分别为8.4%及20.6%,而复苏后采用浓度1 mmol/L GSH 的HTF 液进行IVF,2-细胞发育率可分别达到25%及43.5%,若用M-R18S3 进行精子冷冻,复苏后用浓度为1.5 mmol/L GSH 的HTF 培养液进行IVF,2- 细胞发育率降至21.4%。
2.2 两种不同精子密度的冷冻和复苏方法比较
M-R18S3 作为冷冻保护液,分别用高、低浓度精子冷冻及复苏法进行IVF,高浓度精子冷冻组相比于低浓度精子冷冻组,2-细胞发育率由41.3%(31/75)提高至64.2%(36/64)。

表1 不同组合冷冻液及IVF 液胚胎发育情况
2.3 不同类型基因修饰小鼠的冷冻效果
用高密度精子冷冻法对本中心保种的四种C57BL/6J 背景的基因修饰小鼠进行精子冷冻、复苏及IVF,结果(表2)显示,冷冻精子IVF 后2-细胞发育率34%~90%,将部分2-细胞移植入假孕受体鼠输卵管中,4 种小鼠均有子代出生,出生率40%~57%。

表2 几种基因修饰小鼠冷冻精子IVF 后胚胎发育及出生情况
3 讨论
随着基因修饰方法的不断改进和发展,基因修饰动物已经成为科学研究中常用的实验材料,传统的保种方式大多采用活体保种,这种方式往往会出现遗传变异,同时对动物设施要求较高。低温冷冻保存方式可以克服这些缺点,与胚胎冷冻相比,精子冷冻技术具有方便、快速、成本及设备要求低等特点,正被广泛应用。
精子冷冻即将精子保存在极低温度下(-196 ℃),完全抑制精子的新陈代谢,精子复苏后能够恢复受精能力。在这一过程中,由于渗透压、温度等的变化,精子细胞会受到一系列的损伤,导致精子死亡或者失去受精能力[4],所以相比于新鲜精子,冷冻精子的受精率往往较低。目前,小鼠精子冷冻方法较多,包括冷冻液、冷冻容器、冷冻装置以及精子处理方法等方面均有相关的研究[5,6]。本实验室通过试验对比多种冷冻装置及容器,我们认为泡沫漂浮板及0.25 mm冷冻细管进行精子冷冻操作更加简便,冷冻效果较为稳定,且对于非专业技术人员较容易掌握。
小鼠精子冷冻常用的冷冻液是R18S3,但是由于不同品系对于冷冻损伤的敏感性不同[3],NOD、FVB、DBA 及杂交小鼠冷冻精子复苏后2-细胞发育率可以达到35%~70%,C57BL/6J、BALB/c、129S3/SvIm 等品系小鼠冷冻精子复苏后2-细胞发育率仅为6%左右[2],本实验中C57BL/6J品系小鼠冷冻精子复苏后2-细胞发育率为8.4%。实验证明,在R18S3冷冻液基础上加入抗氧化剂例如GSH、谷氨酰胺、褪黑激素、橡黄素、红景天多糖等可以提高精子冷冻复苏效率,这是由于在冷冻降温和复苏后,精子呼吸代谢会产生大量的活性氧(ROS),ROS 能够氧化精子质膜,损伤精子功能,而抗氧化剂可以清除这些ROS[7-9]。参考相关研究[2,10,11],本研究在R18S3 冷冻液中加入终浓度为477 μmol/L 的MTG,2-细胞发育率由8.4%升高至20.6%,这可能与MTG 的抗氧化作用有关。冷冻精子在复苏后运动能力下降50%左右,这类精子细胞往往缺乏受精能力[12],为了避免这些精子产生ROS 影响受精率,往往需要将复苏后的精子进行洗涤处理。在家畜精子复苏中通常采用浮游法和密度梯度离心法进行洗涤,但是密度梯度离心法需要离心处理,可能对精子造成二次损伤[13],本研究参考浮游法筛选获得活力较高的精子。此外,为保证IVF时有足够的精子量,本研究也采用高浓度精子冷冻法[10],精子复苏后在受精滴中用IVF液将高浓度精子稀释至合适的浓度,孵育一定时间后活力较强的精子将浮游至液滴边缘,用此类精子进行IVF,C57BL/6J 小鼠的受精率可由41.3%提高至64.2%。GSH 是人体内一种重要的内源性抗氧化物,是存在于精子和精浆内的 ROS 清除剂之一,在保护精子对抗氧化损伤的防御机制中起着重要作用[14]。本研究在IVF 液中加入1 mmol/L GSH,可使受精率显著提高,达到43.5%。有观点认为适当水平的ROS 在精子的高活跃性运动、获能、顶体反应中具有重要作用[14],本研究在受精液中加入1.5 mmol/L GSH 时,受精率下降至21.4%,这可能与GSH 消除较多的ROS 导致精子获能及顶体反应受到影响有关。
根据Jackson实验室统计,目前以C57BL/6J 为背景的基因修饰小鼠约占75%[2],为验证本研究建立的方法是否适合这些基因修饰小鼠的保种工作,我们选取本中心几种C57BL/6J背景的基因修饰小鼠进行精子冷冻。冷冻精子IVF 后2-细胞平均发育率可以达到50%,且移植后均有子代出生。这说明本研究中所用方法可以作为C57BL/6J背景基因修饰小鼠的保种方法。
综上所述,以M-R18S3 作为冷冻保护液,采用高浓度精子细管冷冻法进行精子冷冻,冷冻精子复苏后通过受精滴浮游法进行筛选, 在含1 mmol/L GSH 的HTF 培养液中进行IVF,这一技术体系可以作为C57BL/6J 背景基因修饰鼠的保种方法,为常规实验室进行精子冷冻提供了较理想的方法。

