不同时间紫外线照射对SD 大鼠的皮肤光毒性损伤作用
孙 侠, 刘香梅, 庞增雄, 刘冬虹, 徐颖愉, 江 漪, 李 敏, 丘智峰, 黄宇锋
(广州质量监督检测研究院, 广州511447)
太阳光中的紫外线会对生物产生损伤, 依据不同的生物学损伤效应,可根据波长分为短波紫外线(UVC, 100~280 nm)、中波紫外线(UVB, 280~320 nm)和长波紫外线(UVA, 320~400 nm)[1]。其中波长最短的UVC 可对生物产生较强的破坏作用,但由于臭氧层的存在,UVC 几乎到达不了地球表面; UVB具有中等穿透力,主要穿透皮肤的角质层和表皮层,仅有不足2% 能到达地球表面,它对皮肤较浅的人体皮肤产生的效应主要是急性的红斑反应以及随后一定程度的色素沉积; 地球表面超过98%的紫外线是UVA,UVA 具有很强的穿透力,能穿透人体的角质层、表皮层、真皮层从而殃及皮下组织,可造成严重和持久的皮肤危害[2]。
根据《卫生部化妆品检验规定》(2002 年版)要求[3], 具有紫外线吸收功能的化妆品必须进行光毒性试验安全性检验。在卫生部“化妆品卫生规范”(2007年版)中皮肤光毒性试验方法规定了30 min的皮肤光毒性试验[4]。但日常生活中, 太阳光的照射时间常常大于30 min, 为探讨不同辐射时间紫外线引起的皮肤光毒性损伤作用, 本实验采用UVA(4.5mJ·cm-2·s-1)+UVB(0.036mJ·cm-2·s-1)辐射的方法,建立紫外线致皮肤光毒性损伤实验动物模型,并对不同时间紫外照射引起的SD大鼠皮肤光毒性损伤进行了比较分析,为皮肤光毒性损伤研究提供背景数据,并为进一步防晒功效评价提供合适的动物模型。
1 材料与方法
1.1 实验动物
SPF 级雌性SD 大鼠, 28 只, 体质量180 ~220 g,由广东省医学实验动物中心提供[SCXK(粤)2013-0002]。动物饲养于广州质量监督检测研究院毒理实验室[SYXK(粤)2014-0137]。动物实验方法经院动物福利和伦理委员会审核批准,所有操作均符合3 R 原则。
1.2 主要试剂
抗波形蛋白(Anti-Vimentin)抗体、抗黑色素瘤(Anti-Melanoma)抗体和抗CD34 抗体均购自英国Abcam 公司; 小鼠和兔二步法试剂盒购自中杉金桥公司; DAB显色试剂盒购自武汉博士德生物技术有限公司。
1.3 主要仪器
皮肤光毒性试验检测仪(型号: HOPE-MED 8130B)购自天津开发区合普工贸有限公司; ES全封闭组织脱水机(型号: Excelsior)、组织包埋机(型号:HistoStar)、石蜡切片机(型号: HM340E)、烘片机(型号: Slimline Hotplate)、自动染片机(型号: Gemini AS) 和自动封片机(型号: CTM 6)均购自赛默飞世尔科技(中国)有限公司; 显微镜(型号: ZEISS Lab. A1)购自卡尔蔡司光学(中国)有限公司; 电子天平(型号: 双杰JJ3000)购自双杰电子天平公司。
1.4 造模方法
28 只大鼠随机分成空白对照组、模型1 组、模型2 组和模型3 组,每组7 只。除空白对照组外,其余各组予以紫外线照射。每次照射前,在大鼠背部3 cm×3 cm 区域内剃毛,使皮肤充分暴露, 将大鼠放在皮肤光毒性试验检测仪(UVA+UVB)灯具正下方的30 cm 处照射, 辐射参数设为UVA(4.5 mJ·cm-2·s-1)+ UVB(0.036 mJ·cm-2·s-1),每周照射2 次, 连续照射4 周, 共8 次。模型1 组8 次照射时间分别为6 min、12 min、24 min、36 min、48 min、60 min、72 min、84 min,8 次累计共342 min。模型2 组8 次照射时间分别为20 min、30 min、40 min、50 min、60 min、70 min、80 min、90 min,累计共440 min。模型3 组8 次照射时间分别为30 min、40 min、50 min、60 min、70 min、80 min、90 min、100 min,累计共520 min。
1.5 检测指标
1.5.1 皮肤刺激反应 每次照射后观察皮肤反应,并按表1 对皮肤刺激反应进行评分(红斑和焦痂形成、水肿分别积分,最高积分为8 分)。
1.5.2 病理学观察 取照射部位皮肤1 cm×1 cm大小, 用质量分数4%中性甲醛溶液固定, 进行常规脱水、包埋、切片, HE 染色, 光学显微镜观察并照相, 观察各组之间照射部位皮肤病理学形态差异。在高倍显微镜下, 用ZEN2病理图文分析软件测量皮肤的表皮厚度和真皮层皮脂腺的横截面积, 参照GB7919-87《化妆品安全性评价程序和方法》按表2进行皮肤损伤评分, 总分按(a+b+c+d+e+f+g+i+j+k)或(h+i+j+k)选择总分较大者。
1.5.3 免疫组织化学检测 用黑色素瘤特异性标记(HMB45)抗体检测皮肤表皮层黑素细胞变化,用Vimentin 抗体检测真皮层成纤维细胞增生情况,用CD34 抗体检测真皮层微血管的生成情况。
1.6 统计分析
所测数据采用Excel录入和SPSS21.0统计分析软件进行统计分析,组间差异采用t 检验、方差分析和多重比较(LSD 法),以P<0.05 为差异有统计学意义。
2 结果
2.1 皮肤组织大体观察
正常对照组大鼠皮肤未见明显异常, 模型1 组、模型2 组、模型3 组大鼠皮肤略黄,各组均未见明显红斑和水肿形成。

表1 大鼠皮肤刺激反应评分Table 1 Score of skin irritation response

表2 大鼠皮肤损伤评分标准Table 2 Score standard of skin injury
2.2 皮肤组织病理学观察
正常对照组大鼠的背部皮肤表皮由角质层、颗粒层、棘细胞层和基底细胞层构成,颗粒层和棘细胞层的细胞数较少,表皮厚薄均匀(图1A1); 真皮层由乳头层(真皮浅层)和网状层(真皮深层)组成,胶原纤维是真皮结缔组织中最为丰富的成分,弹力纤维数量较胶原纤维少,较均匀散在分布在胶原束之间(图1A2); 真皮层皮肤附件由毛囊、皮脂腺组成,均未见明显异常(图1A3)。模型1 组大鼠背部部分皮肤表皮角化过度(角质层、颗粒层增厚),棘层肥厚(表皮为正常厚度1.6~2.7 倍),表皮厚薄不均,皱纹明显加深,真皮层散在的成纤维细胞增生(图1B1、图1B2); 真皮层毛囊增大,皮脂腺增生(图1B3)。模型2 组大鼠背部部分皮肤表皮角化过度(角质层、颗粒层增厚),棘层肥厚(表皮为正常厚度1.5~2.9 倍),表皮厚薄不均,皱纹明显,真皮层少量胶原纤维变性伴少量成纤维细胞增生,局部散在炎细胞浸润(图1C1、图1C2); 真皮层毛囊增大,皮脂腺增生(图1C3)。模型3 组大鼠背部部分皮肤表皮角化过度(角质层、颗粒层增厚),棘层肥厚(表皮为正常厚度1.5~3.7 倍),表皮厚薄不均,皱纹明显,部分表皮细胞空泡化,真皮层纤维排列较乱,部分胶原纤维变性伴部分成纤维细胞增生,局部少量炎细胞浸润(图1D1、图1D2); 真皮层毛囊增大,皮脂腺增生(图1D3)。
2.3 各组大鼠皮肤表皮厚度和真皮层皮脂腺横截面 积比较
表皮厚度和真皮层皮脂腺横截面积测定结果显示(表3),模型1 组、模型2 组、模型3 组均较正常对照组显著增厚或增大(P<0.05),且随着辐照时间增加,增厚或增大更为明显。
2.4 皮肤损伤评分
模型1 组: 棘层肥厚1 分,角质层增厚1 分,颗粒层增厚1 分; 模型2 组: 棘层肥厚1 分,角质层增厚1 分,颗粒层增厚1 分,真皮层少量炎细胞浸润1 分,少量胶原纤维变性伴少量成纤维细胞增生1 分; 模型3 组: 棘层肥厚1~2 分,角质层增厚1 分,颗粒层增厚1 分,部分表皮细胞空泡化1 分,真皮层炎细胞浸润1 分,部分胶原纤维变性伴部分成纤维细胞增生1 分。与正常对照组比较,模型1 组、模型2 组、模型3 组皮肤损伤评分均显著升高(P<0.05),且照射时间越长,皮肤损伤的程度越重(表4)。
2.5 免疫组织化学观察
根据图2 结果,正常对照组(图2a1)、模型1组(图2b1)皮肤未见明显HMB45 的表达; 模型2组(图2c1)、模型3 组(图2d1)局部皮肤可见少量细胞表达HMB45,表达部位位于表皮基底层和毛囊的上皮层。
正常对照组(图2a2)皮肤真皮层见散在的成纤维细胞Vimentin表达(细胞数≤10个/高倍视野); 模型1组(图2b2)皮肤真皮层见成纤维细胞Vimentin表达增多(细胞数>10 且≤20 个/高倍视野); 模型2 组(图2c2)、模型3 组(图2d2)皮肤真皮层见成纤维细胞Vimentin表达明显增多(细胞数>20个/高倍视野)。

图1 紫外线照射大鼠皮肤组织病理学观察
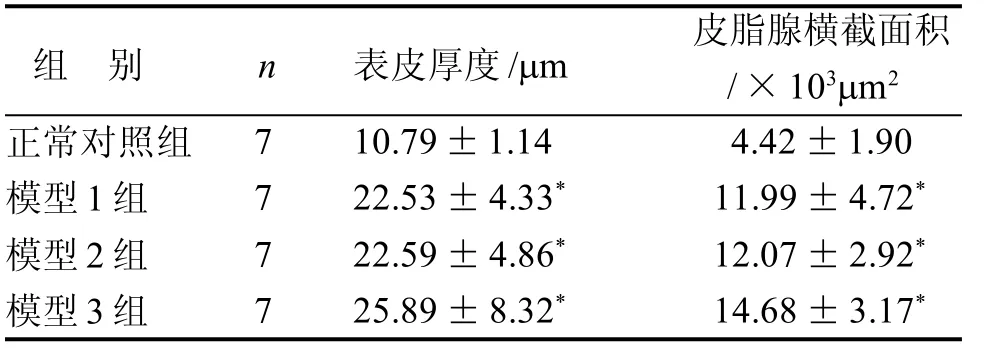
表3 各组大鼠皮肤表皮厚度和真皮层皮脂腺横截面积比较Table 3 Comparison of skin epidermal thickness and cross section area of sebaceous glands in dermis of SD rats in each group

表4 各组大鼠皮肤损伤评分比较 Table 4 Comparison of skin injury scores of SD rats in each group
正常对照组(图2a3)SD大鼠背部皮肤真皮层毛细血管CD34 的表达较少; 模型1 组(图2b3)、模型2 组(图2c3)、模型3 组(图2d3)大鼠背部皮肤真皮层毛细血管CD34 的表达均较正常对照组明显增多。
3 讨论
本研究在辐照参数UVA(4.5 mJ·cm-2·s-1)+UVB(0.036 mJ·cm-2·s-1)不变的基础上,通过延长辐照时间,设置了3个不同辐照剂量的模型组,其中, 模型1 组累计辐照时间为342 min,模型2 组累计辐照时间为440 min, 模型3 组累计辐照时间为520 min。根据皮肤组织病理学分析结果, 模型1 组大鼠皮肤表皮损伤较明显, 真皮损伤较轻; 模型2组大鼠皮肤表皮损伤较明显, 真皮损伤较模型1 组加重; 模型3组大鼠皮肤表皮损伤和真皮损伤均较模型1 组加重。可见,随着紫外照射时间的延长,皮肤损伤程度也逐渐加重。杨汝斌等[5]采用UVA+UVB辐射成功建立SD 大鼠光老化模型, 造模结束时UVA、UVB 辐照强度累计分别为148.5J·cm-2和21.38J·cm-2。楼彩霞等[6]采用更接近日光UVA、UVB 比例的辐照参数,造模结束时UVA、UVB 辐照强度累计分别为123J·cm-2和5J·cm-2, 成功建立了大鼠光老化模型,皮肤损伤程度较杨汝斌等报道的有所减轻。本实验采用的UVA 累计照射量与上述报道基本一致, 而UVB 累计照射量则明显降低,真皮层未见明显的出血改变,皮肤病理改变也相应减轻,更能模拟人类皮肤经紫外线照射后的表现,也更适合于防晒化妆品的防晒功效评价。

图2 紫外线照射大鼠皮肤组织免疫组织化学观察
HMB45是Gown等[7]发现的能与黑素瘤的一种抗原结合的单克隆抗体, 它能识别前黑素小体球蛋白,可与增生活跃的黑素细胞及黑素瘤细胞起反应[8]。Vimentin 是间质细胞中最主要的中间纤维,与皮肤损伤后修复及瘢痕增生有关[9]。CD34 是细胞表面的一种磷酸化糖蛋白,选择性地表达于造血干/祖细胞、小血管内皮细胞等表面[10],也可作为微血管再生的一个标记蛋白[11]。本实验结果显示: 空白对照组和模型1 组大鼠皮肤未见明显HMB45 的表达,模型2 组、模型3 组大鼠局部皮肤可见少量细胞表达HMB45,而3个模型组的Vimentin和CD34表达都增多。结果表明长时间紫外线照射可促进皮肤黑色素细胞增生,紫外辐照可造成皮肤损伤,紫外辐照可促进微血管的生成,这些效应可随辐照时间延长而更加严重。
本实验采用UVA+UVB紫外线辐射的方法,成功建立了皮肤光毒性损伤实验动物模型,同时结合毒性病理学评价方法,分析比较了表皮厚度、表皮黑色素细胞H M B 4 5 表达、真皮成纤维细胞Vimentin 表达、真皮毛细血管CD34 表达、皮肤损伤评分等病理学指标。这些指标易于观察和量化,相比人体防晒系数(SPF)和防晒时间(PA)测试结果,更能直观反应防晒化妆品对紫外线引起的皮肤深层光损伤的防护作用,可用于防晒化妆品防晒功效评价。本实验的模型2 组、模型3 组SD 大鼠皮肤HMB45 表达、皮肤光毒性损伤程度均明显加重,或可作为评价防晒化妆品功效的动物模型。

