胰岛素抵抗合并高尿酸血症大鼠模型的建立及其比较
刘孟渊, 冯学轩, 黎莉斯, 张美艺
(1. 广州市中医医院, 广州 510130; 2. 广东省医学实验动物中心, 佛山 528248)
高尿酸血症(hyperuricemia, HUA)目前已经成为继糖尿病之后最为常见的代谢性疾病。HUA 是痛风最重要的生化基础[1]。临床上,单纯HUA 及痛风较为少见,尤其在中老年患者。大量流行病学及临床研究显示,HUA 和代谢综合征(metabolic syndrome, MS)往往聚集性出现在同一个体,MS 患者70%同时合并HUA,HUA 也常与MS 各项指标伴发,如HUA 合并3 种以上代谢性危险因素的比例,男性和女性分别高达76.92%和67.64%[2,3]。MS 的发病率随着血尿酸水平的增加而升高,而HUA 亦常伴随着MS 、IR 及高胰岛素血症。因此有人认为MS 与HUA 可能互为因果关系,提出将HUA 纳入MS 的一个组分[4]。
胰岛素抵抗(insulin resistance, IR)是MS 的病理基础和病理生理过程的核心环节[5]。从HUA 与MS的紧密联系亦可以推测HUA 与IR 密切相关,大量的临床研究也证实了这一点[6-8]。鉴于目前尚无理想而符合人类HUA发病过程的HUA动物模型。本实验模拟人类高脂高糖饮食诱导IR 状态,,分别制备了大鼠IR-HUA 模型、HUA 模型及IR 模型,并对这三种模型之间的相关性进行了比较分析。
1 材料与方法
1.1 实验动物
SPF级雄性SD 大鼠40 只, 体质量146.5~172.8 g,由广东省医学实验动物中心提供 [SCXK(粤)2013-0002]。饲养于SPF 级动物实验室[SYXK(粤)2013-0002]。
1.2 药物、试剂与仪器
自制高脂饲料(每千克高脂饲料含15 g 食盐、100 g 白糖、200 g 猪油、22.5 g 蛋黄粉, 662.5 g普通饲料), 由广东省医学实验动物中心生产。结晶果糖购自山东西王糖业有限公司(批号201606232),使用时配制成质量分数10%果糖水。酵母膏购自北京奥博星生物技术有限责任公司生产( 批号20161028),使用时用纯净水配制成0.8 g/mL 酵母膏。多聚甲醛购自广东光华科技股份有限公司(批号20161107)。日立7020 全自动生化分析仪购自日本日立公司。
1.3 方法
1.3.1 动物分组 40只雄性SD大鼠适应性喂养后,测量身长和称重,按体质量随机分为正常对照组(A 组)、HUA 组(B 组)、胰岛素抵抗-高尿酸血症(IR-HUA)组(C 组)、IR 组(D 组),每组10 只大鼠。
1.3.2 动物造模 动物分组后, A 组、B 组喂饲普通饲料, 饮用动物饮用水; C 组、D 组喂饲自配高脂饲料, 饮用10%果糖水; 共造模8 周。第6 周始,HUA 组、IR-HUA 组按20 mL/kg 体质量每日灌胃0.8 g/mL 浓度的酵母膏(相当于16 g/kg), 连续21d。
1.3.3 指标检测 造模第6 周末,各组大鼠称重,测体长,采集各大鼠6 h 尿液,采集尿液期间禁食并换为正常饮用水, 其后大鼠按10 mL/kg 体质量腹腔注射(i.p.)质量分数3%戊巴比妥钠溶液麻醉,眼眶静脉窦采血,3 000 r/min 离心10 min 收集血清,检测空腹血糖(fasting plasma glucose, FPG),空腹胰岛素(fasting insulin, FINS),血尿酸(serum uric acid, SUA)及尿尿酸(urine uric acid, UUA)含量。
造模第8 周末,试验结束前1 d,各大鼠称重,量体长,并收集6 h 尿液,测量尿液体积,检测UUA 及尿肌酐(urine creatinine, UCr)。试验结束当日, 禁食6 h 并换为正常饮用水后, 每只大鼠按20 mL/kg 体质量i.p.3% 戊巴比妥钠溶液麻醉, 腹主动脉采血致死, 3 000 r/min离心10 min收集血清, 检测FPG、FINS、SUA 及血清肌酐(serum creatinine,SCr); 并摘取两侧肾脏、胰腺、小肠(空肠),以质量分数4% 多聚甲醛固定,作组织病理学检测。
完成各组大鼠的理化检测后,计算以下指标:①Lee’s指数体 长 ( c m ) , ,②尿酸排泄总量=尿尿酸浓度×排尿体积,③尿酸排泄分数(fraction excretion of uric acid, FEUA)=(尿尿酸×血肌酐/尿肌酐×血尿酸)×100%, ④稳态模型胰岛素抵抗指数(insulin resistance index in homeostasis model, HOMA-IR)=FPG×FINS/22.5。
1.4 统计学处理
2 结果
2.1 各组大鼠体质量
与A 组比较, 各组大鼠体质量均下降。B 组自实验开始至酵母膏灌胃前的大鼠体质量与A组的差别无统计学意义, 而给予酵母膏灌胃后的体质量下降较明显(均为P<0.01)。喂饲高脂高糖的C 组、D组大鼠体质量自8 d 始下降,而且体质量下降较明显(均为P<0.01)。
各模型组之间比较,造模56 d,B 组大鼠体质量高于C 组和D 组(均为P<0.01)。
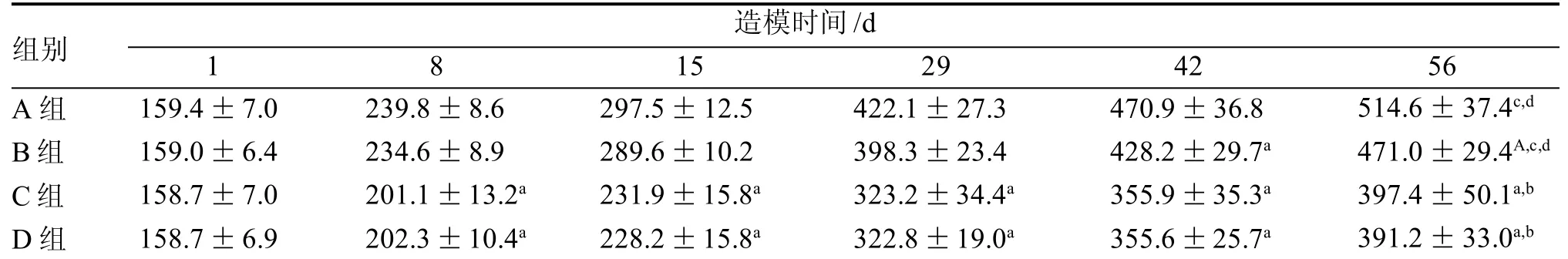
表1 HUA、IR-HUA、IR 模型的建立及比较实验期间各组大鼠体质量 g
2.2 各组大鼠Lee’s 指数
与A 组相比, 第6 周末,B 组Lee’s 指数下降(P<0.01); 第8 周末,D 组Lee’s 指数下降(P<0.05)(表2)。
PCR扩增法检测99株CNS的耐药基因mecA,了解β-内酰胺类药物耐药机制。本研究中从A组结核合并感染患者中分离的CNS中,PCR法与MIC法检出率均为92.6%,50株MRCOS检出了mecA基因;从B组非结核患者中分离的CNS中,PCR法检出率为84.4%,而通过MIC法检出率为86.7%,39株MRCOS只有38株检出了 mecA基因;PCR法检测B组MRCOS中有1株没有检出mecA基因,考虑与mecA基因存在异质性改变有关[14],但两组MRCNS的耐药性及耐药基因检出率基本相符。因而可以推断mecA基因在结核和非结核感染的MCNS中有很高携带率,严重耐药性不容小觑。
各模型组之间比较, 第6 周末, B 组Lee’s 指数低于C 组及D 组(均为P<0.01); 第8 周末,C 组的Lee’s 指数高于D 组(P<0.05)。

表2 各组大鼠Lee’s 指数比较
2.3 各组大鼠相关生化指标
2.3.1 大鼠SUA、UUA、SCr、UCr含量 与A组相比,第8 周末B 组SUA 升高(P<0.05),其余各模型组于第6 周末、第8 周末的SUA均略有升高,但差异无统计学意义(P>0.05)(表3)。
与A 组相比,第6 周末,D 组UUA 浓度上升(P<0.01),C 组和B 组的UUA 浓度分别略有升、降(但P>0.05); 第8 周末,B 组、C 组及D 组UUA 的浓度上升(均为P<0.01)。
与A 组相比,第8 周末,D 组SCr 浓度及UCr浓度均升高(分别为P<0.01、P<0.05)。
各模型组之间比较,第6、8 周末,各模型组的SUA 水平之间差异无统计学意义。
第6 周末,B 组的UUA浓度低于C 组(P<0.05)和D 组(P<0.01); C 组的UUA 浓度高于B 组而低于D组(均为P<0.05); D组的UUA浓度高于B组(P<0.01)和C 组(P<0.05); 第8 周末,B 组的UUA 浓度低于D 组(P<0.05);
第8 周末, D 组的SCr 及UCr 均值最高。D 组的SCr 高于C 组(P<0.05), D组的UCr高于B组(P<0.01)。
各模型组之间比较, 第6 周末,B 组的排尿体积高于其余两个模型组(均P<0.01); 第8 周末,B组的排尿体积高于C 组(P<0.05)和D 组(P<0.01)。
第6、8 周末, B 组的尿酸排泄总量均高于C 组和D 组(均P<0.01); 第8 周末,C 组的尿酸排泄总量低于B 组(P<0.01)而高于D 组(P<0.05); D 组的尿酸排泄总量低于B 组(P<0.01)和C 组(P<0.05)。
第8 周末,依B 组→C 组→D 组,FEUA 逐渐下降,但各模型组间差异无统计学意义。
2.3.3 大鼠FPG、FINS、HOMA-IR水平 与A组相比(表5),第6 周末,各组FPG 值差异无统计学意义(P>0.05); 第8 周末, D 组FPG 值升高(P<0.05)。与A 组相比, 第6、8 周末, C 组、D 组的FINS 含量均下降(分别为P<0.05、P<0.01); 第6、8 周末,B 组FINS 含量与A 组差异均无统计学意义。FINS含量下降可能与胰岛损伤,胰岛素分泌减少有关。

表3 各组大鼠SUA、UUA、SCr、UCr 水平的比较
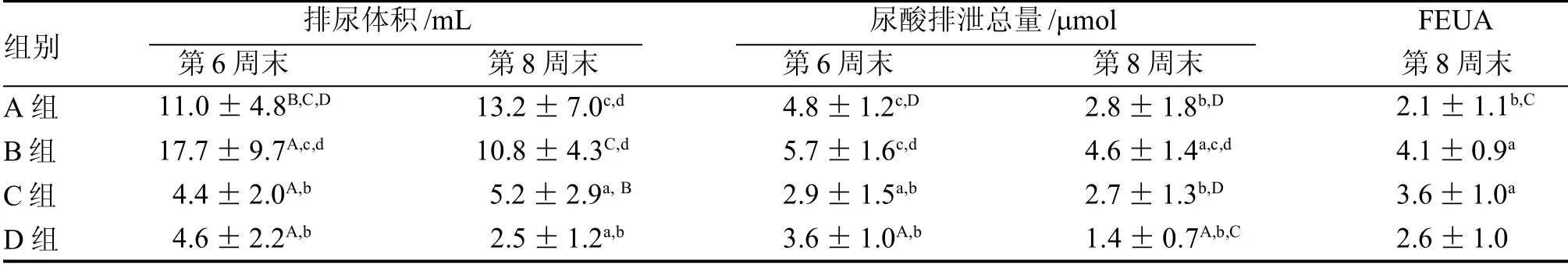
表4 各组大鼠排尿体积、尿酸排泄总量及尿酸排泄分数的比较
第8 周末, 各模型组HOMA-IR 指数值均下降,其中C 组与A 组的差异有统计学意义(P<0.05)。

表5 各组大鼠FPG、FINS、HOMA-IR 的比较
各模型组之间比较, 第6 周末, C 组的FPG 水平高于D 组(P<0.05); 第8 周末, B 组的FPG 水平低于D组(P<0.05); D组的FPG水平高于B组(P<0.01)。
第6周末,B组的FINS水平高于C组(P<0.05);第8 周末,B 组的FINS 水平高于C 组、D 组(均为P<0.01)。
第8周末,D 组的HOMA-IR指数值高于B组、C 组(均为P<0.05)。
2.4 大鼠肾脏、胰腺及小肠组织的病理变化
各组大鼠肾脏组织病理检测均可见肾小管扩张(≤20%), 肾小球形态规则, 未见异常病理改变; 胰腺组织病理检测均可见腺泡萎缩, 分泌减少(>40%);小肠组织病理检测均可见肠绒毛萎缩(>40%); 显示A 组及各模型组的肾脏、胰腺、小肠组织的病理检测结果无明显差异(图1)。
3 讨论
本实验基于临床HUA常与MS的组分聚集出现即HUA常伴有IR的临床特征[9],提出模拟人类HUA乃至MS 发病的常见饮食习惯,以高脂高果糖膳食喂饲联合酵母膏灌胃诱导IR-HUA 大鼠模型,期望为制备IR-HUA 动物模型创建新的方法,并为研究IR在HUA发病机制中的作用,以及HUA治疗药物的研究开发提供新的HUA 动物模型。
为探索有效、稳定、优化的IR-HUA 模型的制备方法,本文开展了IR-HUA 模型、HUA 模型、IR 模型的制备及其比较研究, 上述三种动物模型的评价方法参考杨传经等文献[10,11]报道制订: ①IR-HUA模型: SUA、HOMA-IR 水平大于A 组均数+2 倍标准差,则可判定IR-HUA模型造模成功, IR-HUA模型大鼠在SUA 升高的同时存在HOMA-IR 指数、Lee’s 指数均升高等IR 表现; ②HUA模型血清SUA水平大于A组均数+2倍标准差者为HUA合格动物模型; ③IR 模型血清FPG、HOMA-IR水平大于A组均数+2 倍标准差者, 则可判定合格IR 动物模型。
结果显示,造模6周时各组大鼠模型特征不明显。实验第8 周末,各模型组动物的表现如下:①B 组的SUA、UUA 均升高, 尿酸排泄总量增加,FEUA 升高,显示HUA 模型初步显现,提示给予大鼠酵母膏每日16 g/kg灌胃21 d可制备HUA模型,但需增加酵母膏灌胃的剂量,以期增加SUA 升高的幅度。②C 组的UUA 和FEUA 升高,INS 下降、HOMA-IR 值下降、排尿体积减少; FPG、SUA升高,但差异无统计学意义; Lee’s 指数值、UUA 排泄总量均无明显变化; 提示给予大鼠喂饲高脂高糖饲料、饮用10%果糖水5周后再予酵母膏每日16 g/kg灌胃21 d, 制备的IR-HUA 模型FPG、SUA 升高幅度不足, IR 表现不明显, 模型欠理想。③D 组的FPG、UUA 水平升高,Lee’s 指数、FINS、排尿体积及UUA 排泄总量下降;而SUA、FEUA 略升高、HOMA-IR值略下降,但均无统计学意义; 提示给予大鼠喂饲自配高脂高糖饲料、饮用10%果糖水造模8 周制备的IR 模型, 虽FPG 升高、但HOMA-IR值亦略下降,该IR 模型尚欠理想,可能造模时间较短之故。实验结果显示,SUA 升高多伴随着UUA、FEUA 的升高,提示SUA 的升高,导致肾脏尿酸排泄增加,UUA 浓度上升。

图1 各组大鼠肾脏、小肠、胰腺组织病理学观察 (HE ×200)
本实验D 组的SCr、UCr 同步升高, 提示SCr浓度升高, 可致UCr 排泄增加,UCr 浓度升高。实验结果表明, 高脂高糖饮食可致大鼠排尿体积减少,尿酸排泄下降; 并可致大鼠胰岛素分泌减少,导致血糖升高。实验结束后,各组大鼠肾脏、胰腺、小肠组织的病理检测结果未见明显差异,提示本实验各造模条件未造成大鼠组织的病理性损害。
综上所述,本实验结果表明,雄性SD 大鼠酵母膏每日16 g/kg灌胃21 d可制备HUA模型。可能因造模时间过短,单纯给予高脂高糖饮食8 周诱导大鼠IR 模型,大鼠未出现明显的IR 特征。因此,以高脂高果糖膳食喂饲联合酵母膏灌胃诱导大鼠IR-HUA 模型,亦有待进一步完善造模方法,是否高脂高果糖饲料口感不佳、以及灌胃酵母膏可影响大鼠食欲,导致摄食减少及体质量减轻明显,可能亦是建模不理想的原因。

