结合梯度边缘信息改进的全局阈值法与GVF Snake模型的宫颈细胞图像分割
孟楚楚,赵立宏
(南华大学电气工程学院,湖南 衡阳421001)
0 引 言
图像分割就是把图像分成若干个特定且具有独特性质的区域并提取出感兴趣的目标,这是图像处理到图像分析的首要步骤[1]。临床细胞形态的自动化分析采用图像处理技术,能快速准确地从图像中分割出细胞[2]。图像分割的质量直接影响了后续纹理提取、图像识别等方面的性能。因此准确且高效地提取图像中的目标物体是图像分割的重点[3]。
GVF(gradient vector flow) Snake 模型[4]是图像分割常用的方法,与传统 Snake模型[5]相比,GVF Snake模型具有更大的捕获距离,也能有效跟踪凹陷的边界。Zamani等人[6]使用细胞核边界凸包作为初始轮廓,并从边缘图中消除细胞核边缘来检测细胞质,大大提高了GVF Snake的效率。Plissiti等人[7]利用数学形态学处理自动获取细胞核的初始轮廓,使用GVF Snake对细胞核轮廓进行跟踪,最后使用模糊C均值聚类去除虚假检测,将GVF Snake应用于精确的细胞核边界,提高了聚类算法的性能。准确地放置初始轮廓,对GVF Snake模型准确提取细胞质和细胞核边缘有重要意义。
本文着重通过对梯度边缘信息改进的全局阈值法获取细胞核的初始轮廓,结合GVF Snake模型,对宫颈细胞核进行分割,旨在取得GVF Snake较好的分割效果。
1 预处理
通过细胞液基薄层细胞检测系统得到的宫颈细胞图像,除了染色剂的种类和浓度的影响,在采集过程中还存在不少噪声。为了更精确地分割出细胞图像,研究对采集到的细胞图像进行预处理[8]。对此可探讨分述如下。
1.1 灰度化
为了减小染色剂对细胞图像的影响,本文先将RGB颜色空间转换到CIELab颜色空间,然后提取出CIELab颜色空间的L∗维度,并做归一化处理。相比于RGB颜色空间,CIELab颜色空间的L∗维度更接近实际彩色图像的亮度信息,能增强灰度图像的对比度[9]。
图1(b)、(c)对比了传统 RGB灰度化和CIELab的L∗维度提取的灰度图像,CIELab的L∗维度提取的灰度图像具有更高的对比度,更有利于从背景中区分出细胞体。

图1 RGB灰度化与CIELab L∗维度的灰度化比较Fig.1 Grayscale comparison between RGB and CIELab L∗dimensions
1.2 去噪
采集细胞图像时容易受到噪声的干扰,主要有脉冲噪声和高斯噪声。为尽可能减少去噪过程中对边缘图像的模糊,本文采用非局部均值滤波(Non-Local Means,NLM)的方法对细胞图像进行去噪。不同于均值滤波,NLM能够在整幅图像内搜索对比块,并计算出一个自适应的权值,通过对比块的自适应加权线性组合,获得比局部滤波更高的去噪质量[10]。
图2(b)、(c)给出了中值滤波与非局部均值滤波效果的对比。由图2(b)、(c)可见,在尽可能不模糊细胞边缘的条件下,NLM的效果明显优于中值滤波,在去除噪声的同时也尽可能地保留了边缘信息,利于图像的后续处理。
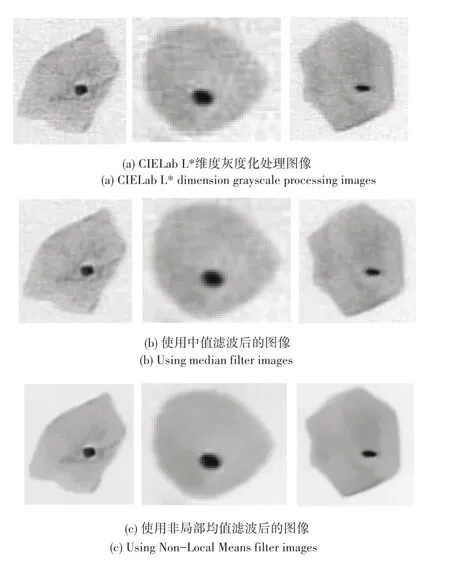
图2 中值滤波与非局部均值滤波比较Fig.2 Using median filter compared with Non-Local Means filter
2 粗分割
2.1 细胞质粗分割
Otsu法基于灰度直方图,获得一个较大方差以接近正确分割图像的阈值。令一幅图像的直方图成分为:
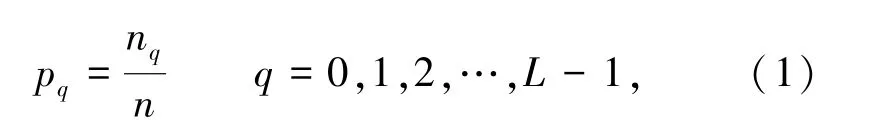
其中,n是图像中像素的总数;nq是具有灰度级的像素数量;L是图像中可能的灰度级的总数。
现假设一个阈值k,C1是灰度级为[0,1,2,…,k]的一组像素,C2是灰度级为[k+1,…,L-1]的一组像素。Otsu方法选择阈值k,使得其最大类间方差为:

其中,P1(k) 是集合C1发生的概率;P2(k) 是集合C2发生的概率;m1(k) 和m2(k) 分别是集合C1和C2中像素的平均灰度。整个图像的平均灰度为:

到灰度级k的平均灰度为:

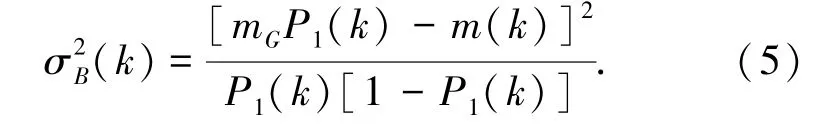
图3(b)给出了Otsu分割细胞质的结果,图3(c)为细胞质轮廓,分割出的轮廓与真实的细胞质轮廓已经非常接近。可分性测度EM是用来衡量输入图像阈值有效性的参数,其范围为[0,1]。EM值越高,则将灰度分为2类的可分性就越高。图3中,3种不同形态宫颈细胞图片的灰度可分性测度EM分别为:0.795 7/0.693 0/0.864 4。

图3 细胞图像粗分割Fig.3 Cell image coarse segmentation
2.2 细胞核粗分割
在分割宫颈细胞的细胞核时,使用Otsu法无法得到期望的分割结果。而利用全局信息对整幅图像求解最优分割阈值的全局阈值法[11],在物体比背景小很多时,物体对灰度直方图的贡献可以忽略不计[12]。因此本文采用梯度边缘信息改进的全局阈值处理来改善上述情况。方法如下:
(1) 假设输入图像为f(x,y),计算出梯度绝对值的边缘图像。
(2)指定一个阈值T,使用这个阈值T对步骤(1)的图像进行阈值处理,产生一幅二值图像gT(x,y), 并在步骤(3)中作为一幅标记图像。
(3)将标记图像与原始图像f(x,y) 相乘,如图4(b)所示,从f(x,y)中选取对应于强边缘像素的像素。
(4) 使用f(x,y) 中对应于gT(x,y) 中1值像素位置的像素来计算新的直方图;使用步骤(4)的直方图,通过Otsu法来全局分割f(x,y)。
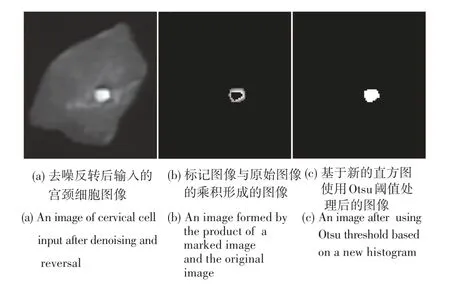
图4 细胞核粗分割Fig.4 Nuclear coarse segmentation
由图4可以看出,使用梯度的绝对值得到边缘信息,能够有效地从大背景下分割出目标物体,分割效果如图5所示。

图5 研究得到的分割效果Fig.5 Segmentation effect
图6为去噪翻转后的宫颈细胞图像的直方图,图7为图4(b)图像中非零像素的直方图。图5中,3种不同形态宫颈细胞图片的灰度可分性测度EM分别为:0.675 7/0.963 6/0.646 4。

图6 去噪反转后的宫颈细胞图像的直方图Fig.6 Histogram of the cervical cell image after denoising and reversal

图7 图4(b)图像中非零像素的直方图Fig.7 Histogram of non-zero pixels in Fig.4(b)
3 GVF Snake模型
由Kass等提出的Snake模型是由一组控制点r(s)=(x(s),y(s))s∈[0,1]组成, 这些点以直线相连接构成轮廓线[13]。Snake模型定义能量函数为:

其中,轮廓的内部能量函数为:

其中,α和β分别为张力和光滑性的权重参数。
轮廓的外部能量函数用于引导轮廓线演化,数学表述为:

其中,Gσ表示以标准差σ对图像进行高斯平滑滤波。
Snake最小化能量函数满足欧拉方程:

其中,▽为梯度算子。
由于Snake模型无法捕获凹陷边界,祝世平等人[14]提出GVF Snake模型,不再从能量最小化来计算GVF Snake模型,而将其看作一个力的平衡过程。GVF Snake将传统Snake的图像力用扩散方程处理,得到整个图像的梯度向量场(gradient vector flow field)作为图像力。 定义梯度向量场为:(x,y)=(u(x,y),v(x,y)),GVF Snake模型最小化能量函数的数学公式可表示为:
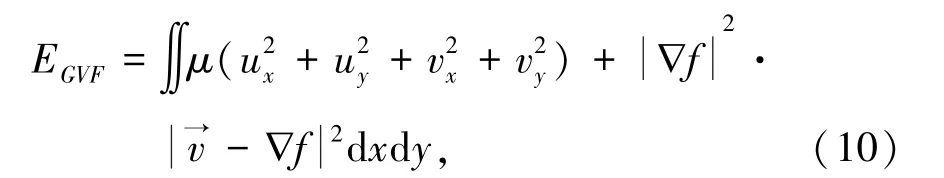
可以通过求解欧拉方程:

来获得最优解,其中μ是平衡前后2项权重的系数,f是被处理的灰度图像的边缘图。ESnake中的边缘图像f可以由多种方法计算得到。本文使用LoG边缘检测算子(Laplacian of Gaussian)得到边缘图像f。 首先用 Gaussian滤波器对图像滤波并计算Laplacian算子[15],产生一幅双边图像;由于双边图像的零点交叉处灰度值会发生跳变,研究可以通过检测二阶差分的零交叉点来捕获宫颈细胞的细胞核轮廓边缘[16]。
4 实验结果
本文使用宫颈细胞液基薄层细胞制片图像,对其细胞质和细胞核分别进行分割提取。分割提取细胞质时,先使用Otsu法粗分割出细胞质轮廓,再应用GVF Snake模型提取细胞质边缘,分割提取效果如图8(b)所示;对于细胞核的分割提取,本文在粗分割步骤采用不同于细胞质的Otsu法。在大背景下通过梯度的边缘信息改进全局阈值的方法提取出细胞核,有效地克服了Otsu法不能分割细胞核以及全局阈值法中灰度直方图对被分割物体与背景的相对大小的依赖等问题,使用GVF Snake模型分割提取后的效果如图8(c)所示。
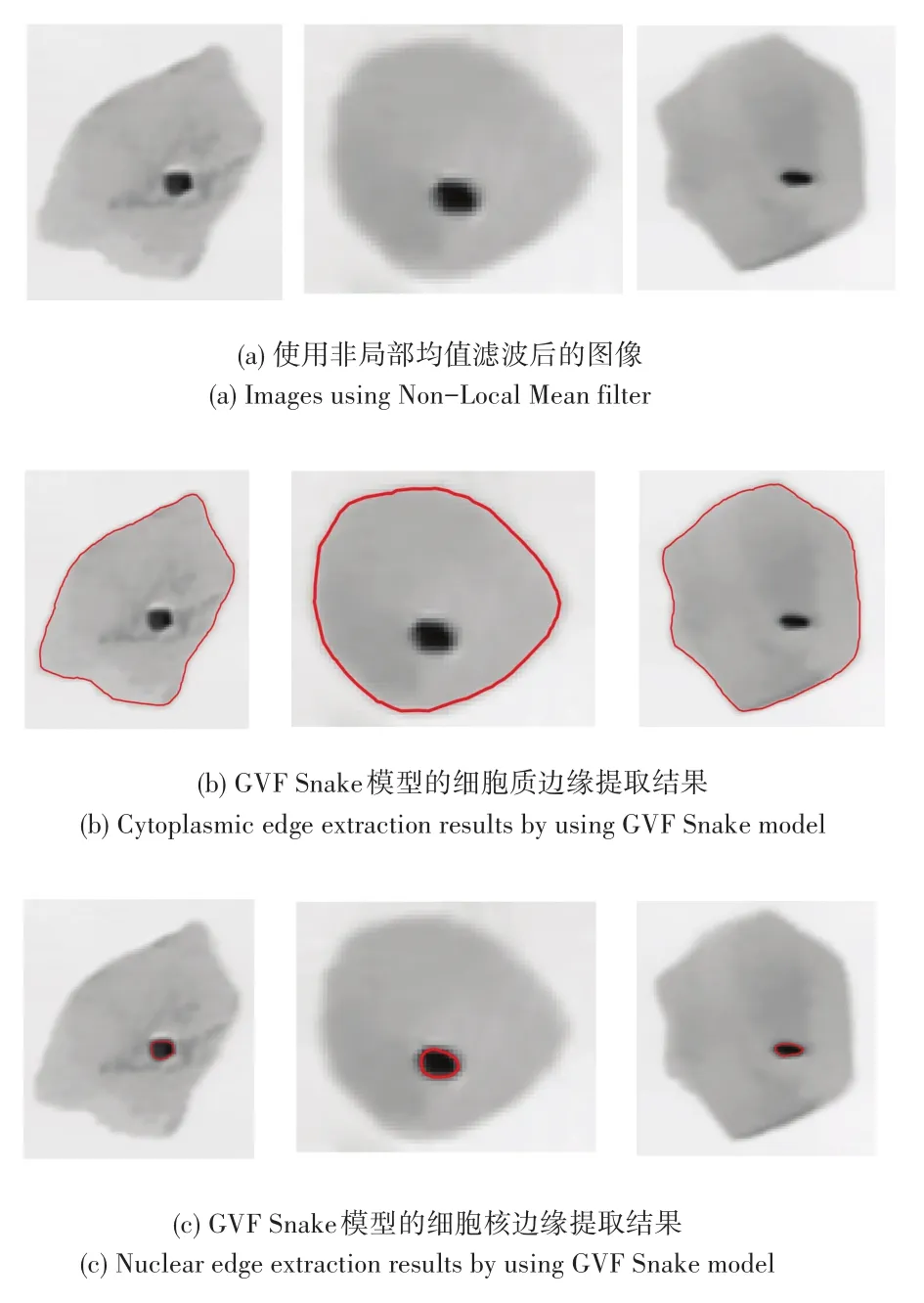
图8 细胞质和细胞核边缘的分割提取Fig.8 Segmentation of cytoplasm and nucleus edge
5 结论
对于细胞图像的分割一直是图像分割的研究热点。近年来,在医学影像中GVF Snake模型也被广泛地使用。但其利用梯度矢量场作为外力来引导初始轮廓演化得到目标轮廓,有时容易受到干扰,无法正确地收敛到细胞核与细胞质的边界。本文利用梯度边缘信息改进的全局阈值法粗分割细胞核得到初始轮廓,实现了GVF Snake模型对细胞核轮廓的精确提取,改善了Otsu法不能分割细胞核以及全局阈值法依赖直方图的不足,提高了GVF Snake模型的效率。
6 结束语
本文通过使用梯度边缘信息改进的全局阈值法代替Otsu法,精确获得宫颈细胞核的初始轮廓,以提高GVF Snake模型的准确度和效率。本文研究中的单个宫颈细胞图像来源于医院液基薄层细胞制片图像,目前尚未对重叠细胞的分割展开研究,这也是下一步研究工作的重点内容。

