Stanford A型主动脉夹层行孙氏手术患者围术期红细胞输注影响因素评估
主动脉夹层是心血管外科的危急重症,尤其是Stanford A型主动脉夹层,其发病急,死亡率高,单纯依靠药物治疗时患者死亡率可高达58%[1]。基于中国主动脉夹层的流行病学特征,国内近期的专家共识提出,Stanford A型主动脉夹层一经发现均应积极行手术治疗[2]。经过多年的推广应用,孙氏手术治疗复杂Stanford A型主动脉夹层的疗效已经得到广泛认可。心脏手术的顺利进行离不开血液资源的支持,因此主动脉夹层患者围术期的血液资源准备十分重要。临床观察发现,Stanford A型主动脉夹层患者围术期输血量较大。输血治疗不仅会增加感染性疾病传播的风险,还会增加心脏外科患者术后并发症的发生率,对患者的预后造成严重影响[3]。本研究选取在兰州大学第一医院行孙氏手术治疗的85例Stanford A型主动脉夹层患者,分析其围术期红细胞输血的影响因素,以期为此类患者临床输血提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2013年1月至2018年5月兰州大学第一医院收治的85例行孙氏手术治疗的Stanford A型主动脉夹层患者的病历资料。根据围术期输血情况,将患者分为常规输血组(红细胞输注量≤8 U)和超量输血组(红细胞输注>8 U)。其中,常规输血组47例,包括男性37例,女性10例,平均年龄为(49.38±1.18)岁;超量输血组38例,包括男性29例,女性9例,平均年龄为(47.87±1.73)岁。
收集患者术前、术中和术后相关资料,包括性别、年龄、身高、体质量、体质量指数(BMI)、高血压病史、糖尿病病史和吸烟史,以及术前红细胞比容(HCT)、血红蛋白(Hb)、血小板计数(PLT)、血清肌酐(Cr)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、术前心脏射血分数(EF)、体外循环(CPB)总转机时间、选择性脑灌注停循环时间、术后呼吸机使用时间、术后肺部并发症和生存与否等指标。术中常规使用血液回收装置,血液经离心处理后回输。
1.2 输血指标及术中血液保护措施
输血指标包括:(1)术中CPB时Hb<70 g/L,或血液稀释后HCT<30%;(2)术后Hb<80 g/L,或危重、高龄(>65岁)、有体征者的Hb<100 g/L。需要说明的是,术中CPB时Hb<70 g/L,但预估超滤停机输入机器余血后Hb>80 g/L(年龄>65岁的危重者Hb>100 g/L)时,可不输红细胞。
血液保护措施包括:(1)在保证手术和CPB顺利进行的前提下,尽量缩短CPB管路长度,减少血细胞破坏;(2)CPB建立后,使用乳酸钠林格晶体液和代血浆(人工胶体)等将患者Hb稀释到80 g/L;(3)使用血液回收装置(Cell Saver)收集术中出血,经处理后回输;(4)尽量缩短手术时间、CPB时间以及深低温停循环时间,术中充分止血;(5)CPB停机前使用超滤技术,提高血红蛋白浓度;(6)CPB停机后引出机器余血,回输。
1.3 手术方法
取右侧锁骨下横切口,解剖分离腋动脉,置入动脉插管。正中入胸,吊心包;右心耳荷包,插入单房管,建立体外循环。充分游离升主动脉、主动脉弓、无名动脉、左颈总动脉和左锁骨下动脉,并分别套带。阻断升主动脉,经主动脉切口,经左右冠状动脉口灌注心肌保护液,逐步降温。根据患者病情,处理主动脉瓣及升主动脉病变,待鼻温降至27 ℃后分别阻断无名动脉、左颈总动脉和左锁骨下动脉,行选择性低温、低流量脑灌注。取合适带支架人工血管置入降主动脉,取合适四分叉人工血管行人工血管远端与带支架人工血管近端的端端吻合。另外,接主动脉插管至四分叉人工血管灌注管,恢复下半身血供,做分叉人工血管与左颈总动脉、左锁骨下动脉吻合,逐步复温,行升主动脉或升主动脉人工血管远端与四分叉人工血管近端的端端吻合。充分排气,开放循环,恢复流量,待心脏复跳后做分叉血管与无名动脉端端吻合。用自体主动脉外膜包绕人工血管,充分止血后放置引流,关胸返回重症监护室(ICU)。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。正态分布的计量资料采用均数±标准差表示,组间比较采用t检验;非正态分布的计量资料以中位数(四分位数)表示,组间比较采用秩和检验;计数资料以例数和百分比表示,组间比较采用卡方检验或Fisher精确概率法。同时对计数资料行单因素分析,计量资料行显著性检验,将预测值差异有统计学意义的变量纳入多因素logistic回归分析。拟合优度采用Hosmer-Lemeshow检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床指标的比较
常规输血组与超量输血组患者的性别,年龄,身高,体质量,BMI,术前HCT、Hb、Cr、AST、ALT、EF,糖尿病、吸烟比例,选择性脑灌注停循环时间等的差异均无统计学意义,而高血压比例和体外循环总转机时间的差异有统计学意义(P均<0.05),见表1。
2.2 红细胞输血对患者术后的影响
常规输血组与超量输血组在术后呼吸机使用时间(P=0.001)、术后肺部并发症(P=0.009)和术后生存率(P=0.028)方面的差异均有统计学意义。见表1。结果提示,超量输注红细胞组术后呼吸机使用时间长,术后肺部并发症高,术后生存率明显下降。

表1 两组患者一般临床资料比较
2.3 多因素logistic回归分析结果
将单因素分析中有统计学意义的指标纳入回归模型进一步分析,可以发现Stanford A型主动脉夹层行孙氏手术治疗的患者围术期超量输注红细胞的相关因素为高血压(P=0.041)和体外循环总转机时间(P<0.001)。其中,高血压是超量输注红细胞的保护因素,而较长体外循环总转机时间则是超量输注红细胞的危险因素。见表2。
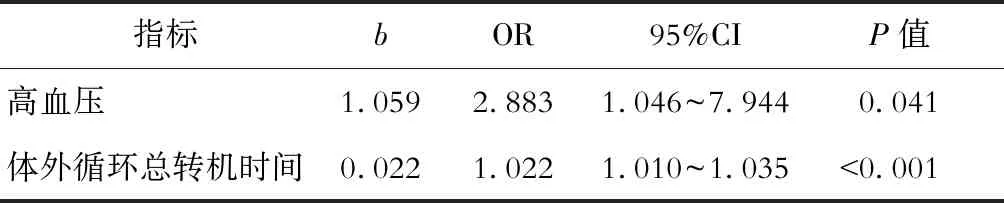
表2 患者围术期超量红细胞输注危险因素的多因素logistics回归分析结果
3 讨论
Stanford A型主动脉夹层是心血管外科的危急重症,及时手术救治能够大大降低此类患者的死亡率。孙氏手术作为治疗Stanford A型主动脉夹层特别是复杂型Stanford A型主动脉夹层的方法,其疗效已获得广泛认可[1]。但此类心脏手术创伤大,手术范围广,需要长时间体外循环支持,极大增加了患者临床输血的可能。临床输血作为此类疾病治疗的一部分,输血相关安全问题不容忽视。有研究表明,心脏手术红细胞输血与患者术后近期和远期不良预后事件的发生有关[4-5]。降低输血量不但可以节约血液资源,还可以改善患者远期预后,所以科学用血已成为临床医师的共识[6]。本研究回顾性分析了85例Stanford A型主动脉夹层行孙氏手术患者围术期超量红细胞输注的危险因素,以期为此类患者节约用血提供参考。
通过分析本中心收治患者的相关特征,可以发现Stanford A型主动脉夹层行孙氏手术患者术前合并高血压疾病与超量输注红细胞相关,而且术前合并高血压疾病是此类患者超量红细胞输注的保护因素(OR=2.883,95%CI:1.046~7.944,P=0.041);另外,对同期并发高血压的情况进行分析,发现高血压组患者的红细胞平均输注量低于非高血压组,差异有统计学意义(P=0.035)。这与主动脉夹层的流行病学特征有一定联系,即高血压是主动脉夹层的重要诱因。近年国内一项多地区观察研究发现,主动脉夹层患者中45%~100%有高血压病史[7]。本研究中高血压患者占比达58.82%。另外,高血压主要由人体血压调节功能异常导致,肾素-血管紧张素-醛固酮系统和交感神经系统的异常活动与高血压密切相关。一篇有关红细胞分布宽度与高血压相关性的研究指出,肾素-血管紧张素-醛固酮系统及交感神经异常激活可能会导致高血压患者的红细胞分布宽度异常[8]。相关研究表明,高血压患者体内血管紧张素Ⅱ的升高能够增加促红细胞生成素的生成,而血管紧张素Ⅱ还能够通过血管紧张素Ⅱ1型受体(AT1受体)直接刺激造血祖细胞[9]。也有研究证实,肾上腺素能系统激活同样可以影响红细胞的生成[10]。一项相关动物实验发现,经过化学方法去除交感神经的大鼠在外源性补充去甲肾上腺素后,红细胞的生成能力恢复[11]。因此,高血压患者体内红细胞水平是升高的,一定程度上会降低此类患者围术期超量红细胞输注的风险。
与既往各临床研究的结论一致[12-13],本研究发现体外循环时间是影响临床红细胞输注的重要因素。体外循环时间越长,超量红细胞输注的可能性越大。近年一项有关体外循环的研究对体外循环造成红细胞破坏的机制做了详细介绍,该研究指出体外循环下红细胞机械性损伤、人工材料的生物相容性、低温、负压、气血接触和炎性反应均是红细胞损伤破坏的影响因素[14]。也有研究指出,体外循环下剪切力增加可造成红细胞破坏[15]。肝素化后的血液在通过机械泵、人工肺、微栓滤器、超滤器和人工管路等组成的体外循环系统时,血液持续暴露于非生理性的湍流流场和高剪切力区域,红细胞会由于碾压、撞击、剪切和压差等原因发生损伤[16]。另外,随着体外循环时间延长,体外循环导致机体凝血功能异常,加重术后出血,在某种程度上也导致了术中红细胞输注量增加[17]。
本研究具有一定的局限性。由于区域医疗技术发展不均衡,围术期相关医疗操作技术差异可能对研究结果造成一定影响。另外,本研究为单中心回顾性研究,样本例数偏少,统计分析结果存在一定偏倚,一些已证实与红细胞输注有关的因素未能发现统计学意义,因此本研究的统计结果仅能代表本中心结论。对于术前Hb、性别和HCT等已证实会影响红细胞输注的因素,有待收集样本做进一步研究。
综上所述,高血压疾病可以降低Stanford A型主动脉夹层行孙氏手术患者围术期超量红细胞输注的风险,体外循环总转机时间延长可增加此类患者的输血风险。临床工作中,应综合考虑上述影响因素,提高技术水平,有效降低体外循环总转机时间,降低红细胞输注风险;并且应严格把握用血指征,减少不必要的红细胞输注和输血导致的术后相关并发症,降低患者死亡率。同时,合理用血,减轻患者治疗经济负担,减轻临床用血压力,对影响红细胞输注的相关因素做进一步研究分析,将会为临床合理用血提供理论支撑,从而更好地服务临床工作。

