血管内超声指导残端模糊的冠状动脉慢性完全闭塞病变介入治疗
冠状动脉慢性完全闭塞(CTO)病变是指远端血流心肌梗死溶栓试验(TIMI)0级且闭塞时间超过3个月的冠状动脉阻塞性病变,当存在同侧桥侧支或同侧侧支血管时,即使闭塞远端血管TIMI血流>0级,也应视为完全闭塞病变[1]。导丝无法通过CTO病变到达远段血管真腔是导致经皮冠状动脉介入术(PCI)失败的最常见原因[2]。残端模糊的CTO病变是一种特殊的CTO病变类型,由于介入治疗时无法准确地识别该类CTO病变入口残端且穿刺导丝较易滑入分支血管内,手术更具挑战性。
有多种技术手段指导处理残端模糊的CTO病变,如冠状动脉CT血管成像(CTA)[3-5]、经侧支血管逆向开通CTO病变技术[6-8]和血管内超声(IVUS)[9-13]。使用IVUS指导处理残端模糊的CTO病变的优势在于其能提供准确的术中即时影像。将IVUS探头送入起始于CTO病变处的分支血管,在回撤IVUS探头过程中,可发现CTO的残端位置[9-10]。将IVUS探头固定于残端处,可准确指导导丝从残端真腔进入CTO病变体部。目前,还没有文献比较IVUS指导与常规造影穿刺方法处理残端模糊的CTO病变的手术异同,本文回顾性分析了上述两种方法处理残端模糊的CTO病变特点、PCI手术疗效及手术特点。
1 对象与方法
1.1 研究对象
对2016年1月至2017年12月湘潭市中心医院心内科通过冠状动脉造影确诊的残端模糊的CTO病变患者进行回顾性研究。根据是否使用IVUS指导导丝穿刺CTO病变近端纤维帽,将患者分为IVUS组(n=48)和造影组(n=36)。该研究经湘潭市中心医院医学伦理委员会批准。
CTO-PCI手术适应证:(1)冠状动脉造影结果显示冠状动脉血管完全闭塞,TIMI 0级,闭塞时间>3个月。(2)患者存在心绞痛症状或经核素扫描、运动试验、动态心电图等证实存在心肌缺血的客观证据;(3)患者能耐受手术(至少能平卧2 h);(4)靶血管直径≥2.5 mm;(5)患者及家属拒绝行外科冠状动脉旁路移植术,同意行PCI。其中冠状动脉血管闭塞时间需符合以下1条或1条以上标准:(1)冠状动脉造影或冠状动脉CTA证实冠状动脉完全闭塞时间>3个月;(2)3个月前有明确心肌梗死病史,术前造影证实心肌梗死相关血管仍处于闭塞状态;(3)若无以上客观证据,患者需有3个月以上的心肌缺血的症状。
CTO-PCI手术绝对禁忌证:(1)双联抗血小板治疗无法耐受或有禁忌证;(2)既往有放射性皮肤损伤史;(3)估算肾小球滤过率(eGFR)<30 mL/(min·1.73 m2),且没有接受长期血液透析治疗。CTO-PCI手术相对禁忌证:(1)不能耐受长期双联抗血小板治疗;(2)既往有大剂量放射线暴露史,有发生放射性皮肤损伤的高危因素;(3)既往有肝素诱发的血小板减少症。
1.2 临床资料收集
收集患者性别、年龄、既往史、eGFR、左室射血分数(LVEF)等资料。
1.3 手术步骤
1.3.1 IVUS组手术步骤 CTO病变所在血管均使用7F指引导管,以便能容纳IVUS导管、导丝及微导管等器材;逆向供血血管使用6F指引导管。手术步骤见图1。具体步骤为:(1)工作导丝送入CTO病变残端附近的分支血管后,将40 MHz IVUS探头(OptiCrossTMBoston Scientific,美国)送入该分支血管,在回撤过程中寻找CTO病变残端。IVUS图像确定残端后,将IVUS探头固定于残端处。(2)根据IVUS图像显示的残端组织构成特征,选择软硬合适的导丝和微导管,将指导导丝从残端中心位置穿刺CTO病变残端。若选择Crusade双腔微导管,则将对侧指引导管撤出,选择6F指引导管进入同侧冠状动脉,以“乒乓”技术完成手术。(3)IVUS证实导丝穿刺进入CTO残端后,手术策略如图2所示,可依次采用正向导丝更替技术、逆向技术、正向平行导丝/LAST技术尝试开通CTO病变。(4)对侧造影确认导丝进入CTO病变远段真腔后,IVUS指导支架直径及长度的选择。支架置入后再次送入IVUS导管观察支架膨胀、贴壁情况,以及是否存在血肿或夹层等。
1.3.2 造影组手术步骤 CTO病变所在血管均使用7F指引导管;逆向供血血管使用6F指引导管。导丝的穿刺点通过双侧冠状动脉造影来判断。造影组的手术策略同IVUS组。在导丝进入CTO病变远段真腔后,根据造影结果选择支架,并判断是否存在手术并发症。
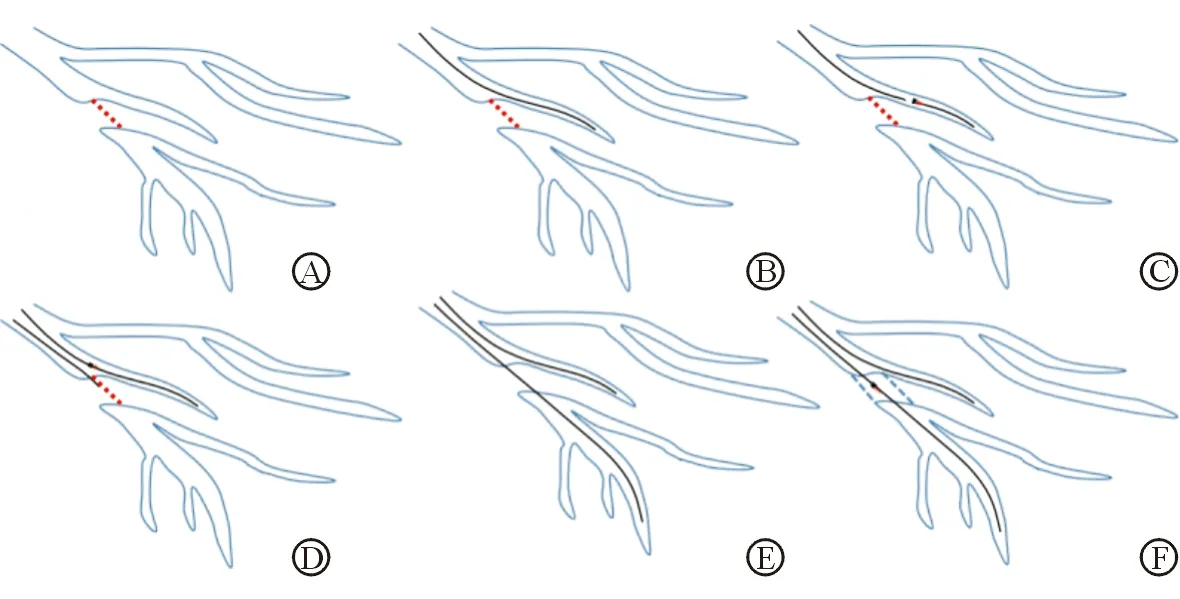
注: A为前降支中段残端模糊的CTO病变,红色虚线表示闭塞段;B为软导丝进入起始于CTO病变的对角支内;C为40 MHz IVUS探头沿软导丝进入对角支内,在回撤过程中发现CTO病变残端;D为IVUS探头固定在CTO病变残端部位,指导导丝穿刺进入残端;E为导丝成功穿通CTO病变;F为IVUS探头进入CTO病变部位,确认导丝位于真腔内并评估管腔病变特征,指导支架置入
图1 IVUS指导处理前降支中段残端模糊的CTO病变
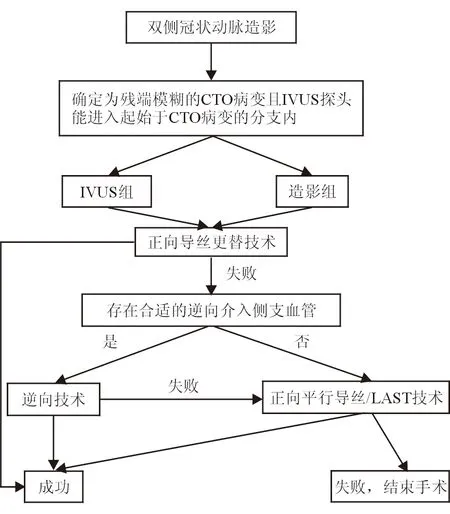
图2 CTO病变手术路径流程图
1.4 术后随访
记录患者住院期间行PCI后主要不良心血管事件(包括靶病变血管重建、非致命性心肌梗死、心源性死亡、严重心力衰竭、恶性心律失常等)的发生情况。
1.5 统计学分析
应用SPSS 16.0 软件对数据进行统计学分析。计量资料以均数±标准差表示,符合正态分布的计量资料组间比较采用t检验,不符合正态分布的采用Mann-WhitneyU检验;计数资料以例数和百分比表示,组间比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床基本资料比较
IVUS组与造影组年龄,性别,高血压、高脂血症、糖尿病、吸烟、LVEF<40%的比例及eGFR值的差异无统计学意义。见表1。
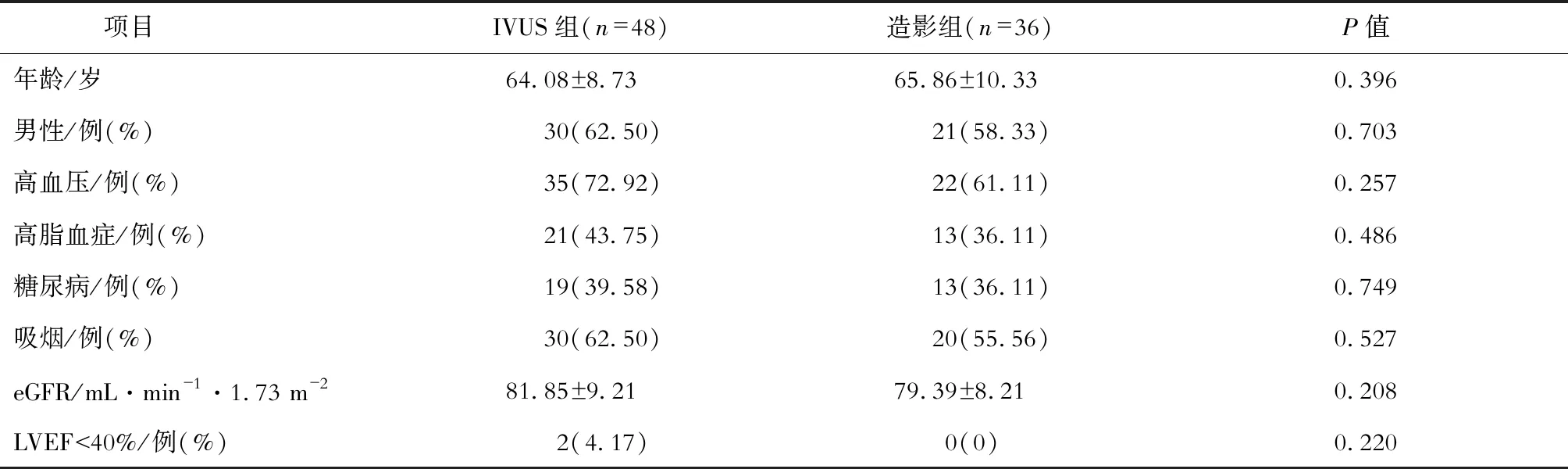
表1 两组临床基本资料比较
2.2 手术疗效比较
84例患者CTO病变手术成功69例(82.14%),导丝直接正向成功通过CTO病变42例(50.00%),导丝非直接正向成功通过CTO病变27例(32.14%),失败15例(17.86%)。IVUS组患者均经IVUS证实导丝从CTO残端中心部位穿刺进入CTO病变体部。IVUS组的手术总成功率和导丝直接正向通过CTO病变成功率均明显高于造影组(P均<0.05),两组导丝非直接正向通过CTO病变成功率的差异无统计学意义。见表2。所有患者住院期间均未发生靶病变血管重建、非致命性心肌梗死、心源性死亡、严重心力衰竭、恶性心律失常等主要不良心血管事件。

表2 两组手术结果比较
2.3 CTO病变特点及手术特点
IVUS组与造影组导丝直接正向通过CTO病变患者的CTO病变部位、CTO病变病理学特征、闭塞段远端有严重弥漫性病变的患者比例及J-CTO评分的差异均无统计学意义。导丝直接正向通过CTO病变的患者中,IVUS组使用的导丝数量明显少于造影组(P<0.05)。IVUS组与造影组导丝通过CTO病变段的时间、手术时间及手术造影剂用量的差异均无统计学意义。见表3。
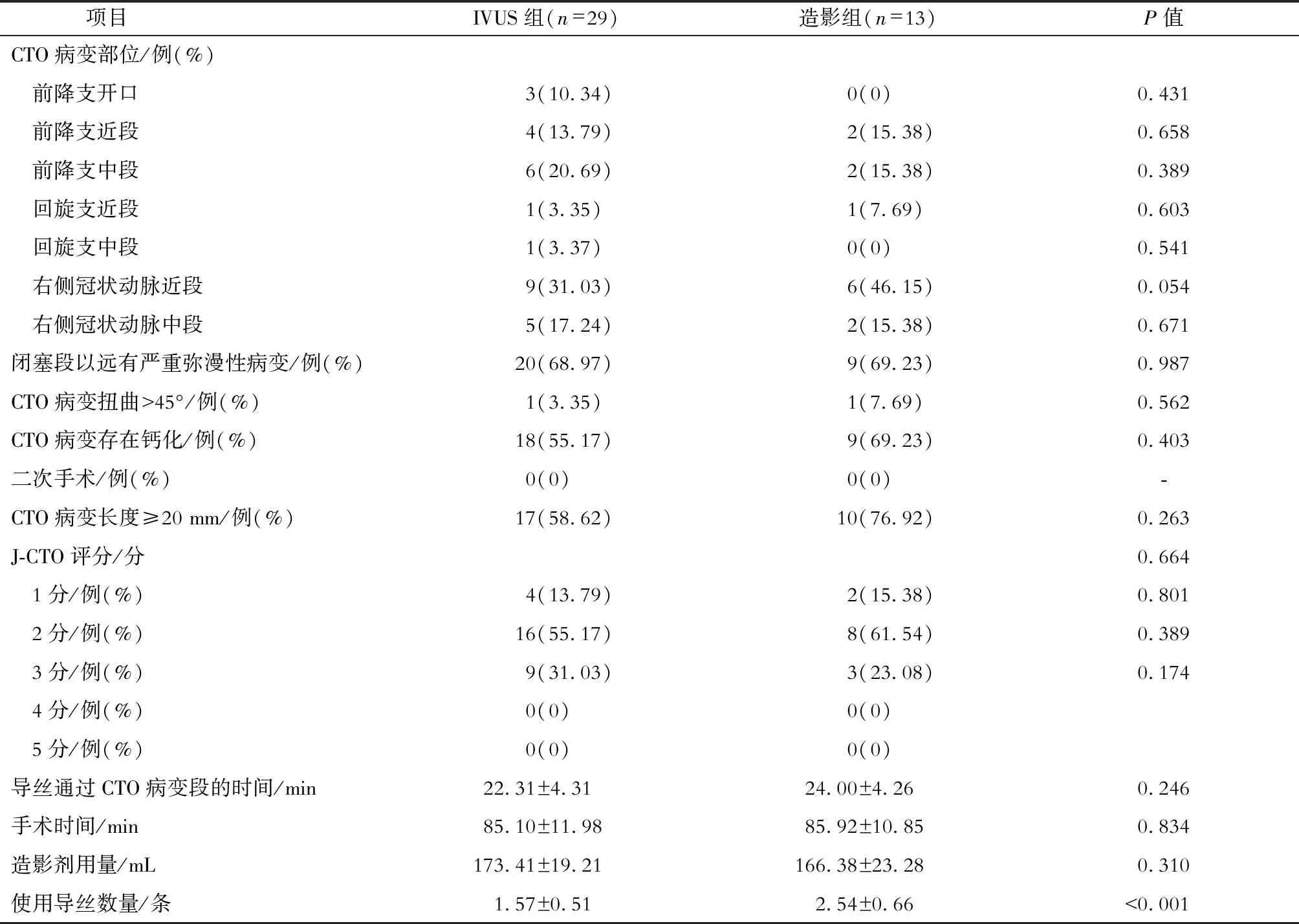
表3 两组导丝直接正向通过CTO病变患者的CTO病变特点及手术特点比较
3 讨论
残端模糊的CTO病变是一种特殊的钝型CTO病变类型,当冠状动脉斑块急性破裂后,血小板首先在斑块破裂处聚集并阻塞血管,之后血栓会逐渐向病变血管近段延伸,最后终止于分支血管分叉开口处,形成残端模糊的CTO病变[2]。双侧冠状动脉造影常无法准确定位CTO病变入口残端,穿刺导丝缺乏着力点,容易滑入分支血管或进入假腔,因此CTO-PCI治疗更具挑战性[10]。IVUS可以准确定位残端模糊的CTO病变的残端位置。组织的性质不同,对超声的吸收和反射也不同,因此IVUS可以用不同灰阶表示接受到的超声信号的强度,由此了解管腔的解剖形态,直接显示管壁的病变性质。
2004年,Ito 等[12]首次报道了使用IVUS图像寻找残端并指导导丝开通残端模糊的CTO病变。2007年,Furuichi等[13]报道了在PCI处理残端模糊的CTO病变时,IVUS能够协助找到病变残端入口的准确位置,评估导丝在CTO病变近端纤维帽的穿刺情况,避免导丝穿刺到血管外膜。Park等[10]纳入平均年龄为(61.0±8.9)岁的31位患者(其中女性7例),采用IVUS探查32处残端模糊的CTO病变的残端位置。结果显示,26处(81%)CTO病变的PCI在IVUS指导下成功完成,所有患者围手术期均未出现靶病变血管重建、非致命性心肌梗死、心源性死亡、严重心力衰竭、恶性心律失常等主要不良心血管事件。
Ryan等[14]纳入平均年龄为(59.8±11.5)岁的22例残端模糊的CTO病变患者(其中男性占90.9%),使用IVUS指导PCI,手术成功率为77%。22例患者中,前降支CTO病变最多,占36.4%,其次为回旋支和右冠状动脉,均占31.8%。患者总体J-CTO评分为(3.09±0.75)分[手术成功组(3.06±0.68)分对手术失败组(3.17±0.98)分,P=0.35];总体造影剂用量为(378.7±114.7)mL[手术成功组(389.9±130.5)mL对手术失败组(349.2±52.2)mL,P=0.30]。所有患者围手术期均未出现主要不良心血管事件。在本研究中,IVUS组导丝直接正向通过CTO病变的成功率高于造影组,且导丝使用数量少于造影组,考虑主要是因为IVUS较双侧冠状动脉造影能更加准确地定位CTO病变残端的位置,减少导丝进入假腔的可能性,提高了手术成功率,IVUS还能提供残端位置的斑块组成情况,指导导丝及微导管的选择,从而减少了导丝的使用数量。
目前,冠状动脉CTA[3-5]以及经侧支血管逆行开通CTO病变技术也可用于处理残端模糊的CTO病变[6-8]。作为非创伤性冠状动脉检查方法,冠状动脉CTA能显示CTO闭塞段血管走形、近端残端位置、钙化位置,为术者展示血管的三维形态,利于制定合适的手术策略。但是,CT影像不能在PCI术中提供实时血管影像信息。逆向技术,即控制性正向-逆向内膜下寻径技术(CART技术)、反向CART技术及改良的反向CART技术等,则需要允许逆行导丝、微导管及球囊通行的逆向侧支血管[15-16]。相对于这两种方法,IVUS可以在PCI中提供实时血管信息,指导导丝穿刺的部位及方向,提高导丝直接正向通过CTO病变的成功率,且不需要特殊的逆向手术器材及逆向侧支血管的存在。关于何种方法最适用于残端模糊的CTO病变,目前还没有定论。在实际操作中,适当联合上述3种方法来处理复杂的CTO病变可以提高手术成功率。
本研究的局限性有以下几点:(1)作为一项单中心回顾性观察研究,不可避免地存在选择性偏倚,相关结论有待多中心随机对照研究进一步证实;(2)术者是CTO-PCI、IVUS读图经验丰富的介入医师,但其手术操作水平并不一定代表所有介入医师的水平;(3)缺乏患者出院后的远期随访结果。
——导丝概述及导丝通过病变技巧

