猪繁殖呼吸综合征病毒的NSP7蛋白密码子优化和表达及其免疫学活性鉴定①
严俊杰 杨绮玲 林艺君 石路怀 王 宏 唐 勇
(暨南大学,广州510632)
蓝耳病毒是危害养猪业发展的重要的单链RNA病毒,它的RNA长约15 Kb,包含10个开放阅读框,分别是ORF1a、ORF1b、ORF2a、ORF2b、ORF3、ORF4、ORF5、ORF5a、ORF6、ORF7[1]。其中ORF1编码2个大的多聚体蛋白,这两个蛋白可以裂解为14个非结构蛋白[2]。而ORF2a、ORF2b、ORF3~7和ORF5a 则编码8个结构蛋白分别为糖蛋白GP2、包膜蛋白E蛋白、GP3、GP4、GP5、M、N和ORF5a蛋白[3]。其中GP5和M蛋白可以形成二聚体,而GP2、GP3、GP4可以形成三聚体并协助病毒进入宿主细胞[4]。根据核苷酸序列分析可把蓝耳病毒分为两种基因型,欧洲型和北美型,他们的基因相似性只有63%[5]。此外即使是同一基因型的病毒,他们的基因依然存在一定的差异,所以存在众多抗原性不同的蓝耳病毒。
蓝耳病毒可使猪患上猪繁殖呼吸综合征(Porcine reproductive respiratory syndrome virus,PRRSV),让妊娠母猪出现流产、早产、死胎,幼龄仔猪出现咳嗽、呼吸困难等症状[6],所以猪繁殖呼吸综合征使世界养猪业蒙受巨大的损失。因此,建立一种稳定性好、准确性高的检测蓝耳病毒的方法十分有必要。目前比较普遍的检测方法主要是分子生物学检测和血清学检测,由于分子生物学检测需要仪器和相关技术人员,不能做到现场大规模检测。而血清水平上有多种检测方法例如ELISA,胶体金试纸条等,这些方法简单快捷,不需要相关技术人员,并且可以现场大规模检测。
NSP7是PRRSV病毒的一种非结构蛋白,与NSP6和NSP8相邻。NSP7能被NSP4蛋白酶从内部裂解成NSP7α和NSP7β两部分[7]。 Brown等[8]研究结果表明在非结构蛋白中非结构蛋白NSP1、NSP2、NSP7的免疫活性最高,猪在感染蓝耳病毒后大约14 d就可以产生高水平的针对NSP7的抗体,与N蛋白抗体水平相似。另外据相关文献报道,蓝耳病毒各株NSP7蛋白同源性较高,针对NSP7的抗体在猪体内可以持续202天[9]。由于PRRSV非结构蛋白NSP7相对保守,不同毒株之间差异较小,所以它可以在检测抗体时保持较高的特异性[7]。因此可以用NSP7作为靶蛋白检测血清中是否有相关抗体,以此来判断是否有蓝耳病毒感染。
本文应用生物信息学对NSP7基因进行分析;然后对重组蛋白基因进行密码子优化以期提高重组蛋白的表达量和可溶性表达;随后对重组蛋白进行SDS-PAGE分析优化,镍柱纯化,最后用间接ELISA法和Western blot鉴定纯化的重组蛋白是否具有免疫学活性。
1 材料与方法
1.1材料 所用菌株BL21-PET32a 为本实验室保存;PET32a-NSP7在苏州泓迅生物科技有限公司合成;蛋白质marker购自赛默飞生物技术有限公司;组氨酸标签鼠抗购自广州佳研生物科技有限公司;IPTG 购自生工生物有限公司;其他试剂均为国产化学分析纯;
1.2方法
1.2.1NSP7蛋白同源性比较和抗原表位预测 DNAMAN软件对28株蓝耳病毒NSP7蛋白进行同源性分析,在线网站http://www.iedb.org/分析重组NSP7蛋白的抗原表位。
1.2.2重组蛋白密码子优化 在线网站http://biotech.ou.edu/分析重组NSP7可溶性表达概率,利用NGCodon优化软件对NSP7基因进行CAI-密码子适应指数,GC含量和mRNA二级结构进行分析和优化。
1.2.3BL21-PET32a-NSP7表达鉴定及表达条件优化 分别将50 μl过夜培养物菌液BL21-PET32a-NSP7 接种到5 ml含抗生素的LB培养基,通过测量OD值将细菌培养到对数生长期后根据以下要求进行实验以确定最佳表达条件(皆以BL21-PET32a为对照):①37℃ 1.0 mmol/L IPTG诱导6 h,确定表达产物存在形式。②1.0 mmol/L IPTG诱导6 h,温度设定25℃、28℃、31℃、34℃,37℃ 5个水平,确定培养温度。③34℃诱导7 h,IPTG浓度设定0.2、0.4、0.6、0.8、1.0 mmol/L 5 个水平,确定IPTG作用浓度。④用上述实验确定的最佳IPTG作用浓度、培养温度,时间设定4、5、6、7、8 h 5个水平,确定培养时间。
1.2.4重组蛋白的纯化 BL21-pET32a-NSP7重组菌于0.8 mmol/L IPTG,34℃大量诱导表达7 h后,离心收集菌体并溶于PBS,使用超声破碎仪将菌液破碎40 min(pulse-on time 3 s,pulse-off time 4 s),随后离心收集上清。将上清进行过滤除杂后通进镍柱中,用一步纯化法纯化(先用30 mmol/L咪唑除杂后直接用250 mmol/L咪唑纯化)并进行凝胶电泳和考马斯亮蓝染色。
1.2.5纯化蛋白的免疫学活性鉴定 Western blot鉴定:BL21-PET32a-NSP7和BL21-PET32a 菌株在37℃ 0.8 mmol/L IPTG浓度下诱导7 h后超声破碎取上清,变性处理,进行SDS-PAGE然后电转移至PVDF膜上,随后用5%脱脂奶粉封闭3 h,加入TP株三免血清(1∶2 500稀释),4℃孵育过夜,洗膜,加入HRP-羊抗鼠IgG(1∶2 500稀释),37℃孵育1 h,洗膜,曝光。
间接ELISA鉴定:将纯化的NSP7蛋白100 ng/孔包板,以PRRSV CH-1α株三免小鼠血清作为一抗。8周龄SPF小鼠(未注射过其他药物)阴性血清作为阴性对照,PBS作为空白对照,进行间接ELISA检测,验证重组蛋白的免疫学活性。
2 结果
2.1NSP7蛋白同源性比较及抗原表位预测 DNAMAN软件分析显示,28株蓝耳病毒同源性高达99.25%,预示着NSP7是一个相对保守的蛋白,抗原表位预测显示NSP7蛋白上具有多个B细胞表位(表1),可以刺激机体产生众多抗体,综合以上条件NSP7蛋白可以作为一个理想的检测蓝耳病毒靶蛋白。于是挑选保守性高的TP株NSP7基因进行密码子优化并合成,合成的NSP7基因与PET32a相连后转入BL21。
2.2重组蛋白密码子优化 在线网站http://biotech.ou.edu/分析重组NSP7可溶性表达概率为0,由于蛋白稳定性、mRNA稳定性和翻译效率对蛋白产量和可溶性起主要作用所以在不改变NSP7氨基酸序列的前提下,综合考虑NSP7基因的(G+C)%含量、CAI-密码子适应指数、mRNA二级结构等因素,对目的基因进行优化以期增加重组蛋白的表达量和让重组蛋白可溶性表达。由于较低的GC含量有利于提高重组蛋白的表达量和利于提高可溶性表达的概率,于是利用NGTMCodon优化软件分析蓝耳病毒NSP7未优化前的基因GC含量为52%(图1B),优化后GC含量为51%(图1A)。如果基因的同义密码子与表达宿主的密码子偏好性相匹配的话可以在一定程度上提高重组蛋白的表达量,所以利用NGTMCodon优化软件分析优化蓝耳病毒NSP7基因,由图可见未优化的NSP7基因CAI(Codon Adaption Index)只有0.58(图1D),优化后的基因CAI(Codon Adaption Index)为0.81(图1C)。mRNA二级结构是另一影响翻译过程的因素,如表2所示:NSP7基因未优化前小发卡、中发卡、大发卡分别为5个、3个、2个,经过软件优化后小发卡只有2个而中发卡和大发卡皆为0。
表1 表位预测
Tab.1 Predicted peptides
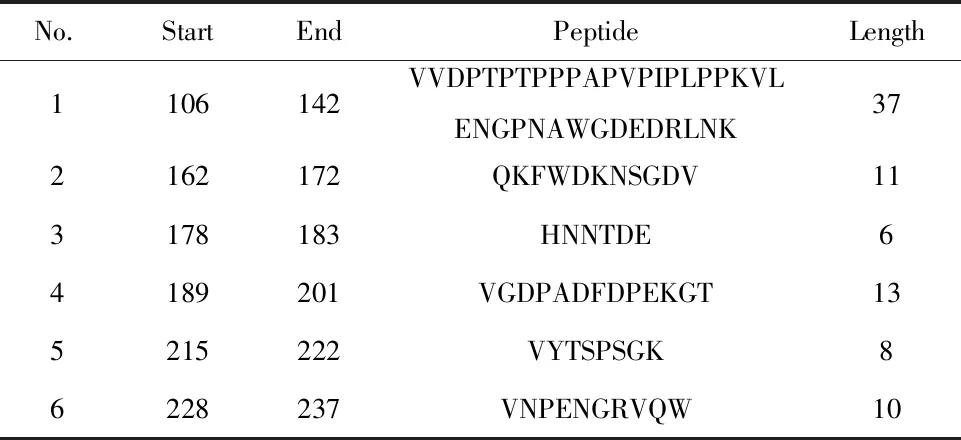
No.StartEndPeptideLength1106142VVDPTPTPPPAPVPIPLPPKVLENGPNAWGDEDRLNK372162172QKFWDKNSGDV113178183HNNTDE64189201VGDPADFDPEKGT135215222VYTSPSGK86228237VNPENGRVQW10
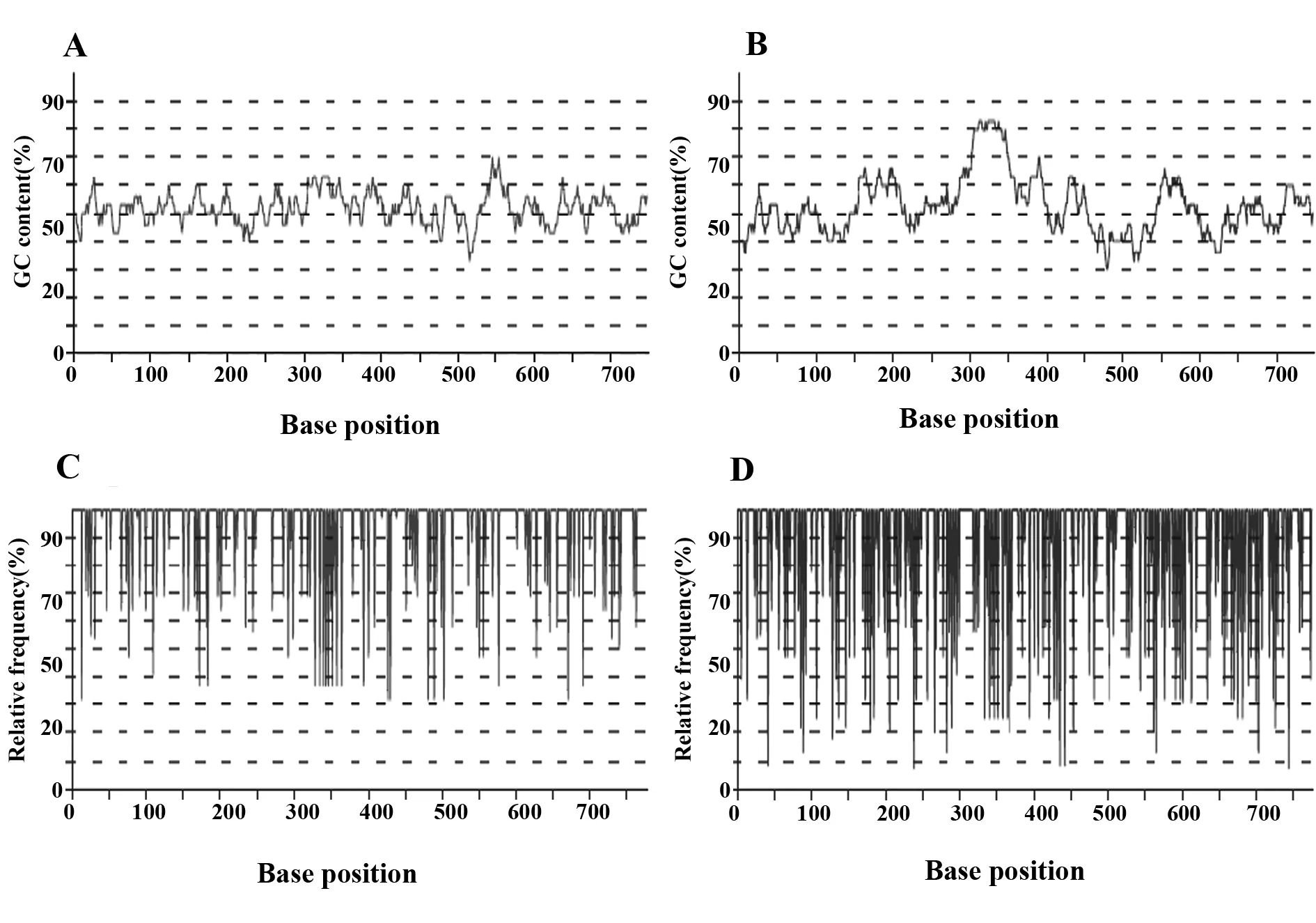
图1 密码子偏好性分析(A,B)及密码子GC含量分析(C,D)Fig.1 Codon bias analysis(A,B)and GC content analysis(C,D)Note: A.Plot of GC content of optimized gene;B.Plot of GC content of wild-type gene;C.Plot of codons usage of optimized gene;D.Plot of codons usage of wild-type gene.
2.3BL21-PET32a-NSP7探究表达产物存在形式及表达条件优化 ①探究表达产物存在形式:SDS-PAGE 检测实验结果显示(图2A),BL21-PET32a-NSP7在37℃、1.0 mmol /L IPTG 浓度作用下诱导7 h目的蛋白(49 KD)为可溶性表达;②最佳诱导温度的确定:BL21-PET32a-NSP7 于IPTG 浓度为1.0 mmol/L、不同温度下表达7 h,所得实验结果如(图2B) 所示;通过灰度分析得出温度在34℃时目的蛋白NSP7 表达量最高;③最佳 IPTG 诱导浓度的确定:BL21-PET32a-NSP7于34℃不同IPTG 浓度下诱导表达7 h,所得实验结果如(图2C)所示,通过灰度分析得出IPTG 诱导浓度为0.8 mmol /L 目的蛋白NSP7表达量最高;④最佳诱导时间的确定:BL21-PET32a-NSP7于34℃ IPTG 诱导浓度为0.8 mmol/L 条件下,通过改变诱导时间所得实验结果如(图2D)所示,通过灰度分析得出诱导表达7 h目的蛋白NSP7 表达量最高。
2.5重组蛋白的纯化 BL21-PET32a-NSP7菌株于最佳表达条件下大量表达,经过超声破碎后离心取上清,上清经镍柱纯化后进行SDS-PAGE,结果显示在49 kD处条带较浓(图2E)。
2.6NSP7免疫学活性的鉴定 Western blot鉴定:BL21-PET32a-NSP7与BL21-PET32a菌株破碎产物以抗组氨酸标签抗体作为一抗进行Western blot,结果显示BL21-PET32a-NSP7成功表达了我们需要的蛋白(图2F)。ELISA鉴定:将制备的PRRSV CH-1α株多克隆抗血清以不同比例稀释后作为一抗进行间接ELISA 检测。结果如表3 所示,抗血清可以与纯化后的NSP7进行特异结合,证实了NSP7蛋白具有较好的免疫学活性;按照酶标仪检测的OD450值P/N>2.1 的评判标准,NSP7能够区分蓝耳病毒的最大稀释浓度为1∶6 400。
表2 发卡结构分析
Tab.2 Hairpins analysis

HairpinsOptimizedWild-typeSmall Hairpins25Medium Hairpins03Large Hairpins02

图2 NSP7表达形式鉴定及表达条件优化Fig.2 Expression forms and optimisation of NSP7 expression conditionNote: A.The Soluble validation of NSP7.Lane M.Marker;Lanes 1-2.The thallus of nsp7;Lanes 3,5.Negative control;Lanes 4,6.The induced supernatant of nsp7;B.The effects of temperature gradient on the expression of nsp7.Lane M.Marker;Lane 1.Negative control;Lanes 2-6.NSP7 induced with different temperature(25℃, 28℃, 31℃, 34℃, 37℃);C.The effects of IPTG concentrations on the expression of nsp7.Lane M.Marker;Lanes 1-5.NSP7 induced with different IPTG concentrations(0.2,0.4,0.6, 0.8, 1.0 mmol/L);6.Negative control;D.The effects of induction time on the expression of nsp7.Lane M.Marker;Lanes 1-5.NSP7 induced with different times(4,5,6,7,8 h);6.Negative control;E.The purification of NSP7;Lane M.Marker;Lane 1.The induced supernatant of NSP7;Lane 2.Negative control;Lane 3.The purification of NSP7;F.Detection of purified protein by PRRSV(TP) anti-serum.Lane 1.The anti-PRRSV(TP) serum;Lane 2.Negative serum.
表3 免疫学活性检测
Tab.3 Immunological activity detection

Serum dilution factorNegative serumPositive serum P/N4000.2611.0143.898000.1920.8364.351 6000.1690.6533.863 2000.1450.4543.136 4000.1330.3112.3412 8000.1400.2331.6625 6000.1130.1651.46Negative Control0.0980.1011.03Standard deviation0.0500.3301.27
3 讨论
PRRSV已经成为全球猪产业最重要的病毒病原体之一,对养猪业造成了巨大的经济损失[6]。PRRSV不但可使母猪繁殖失败,它还可以感染雄猪的生殖器官[10,11],使雄猪的性欲丧失和改变其精子质量,包括降低精子能动性和增加形态异常的频率[12],有文献报道感染PRRSV的雄猪可以在其精液中最短连续4 d最长连续92 d检测出PRRSV[13],由此看来PRRSV可以通过雄性的精液作为媒介而进行传递[14],由于人工授精在全球的猪产业被广泛应用,因此有效的检测精液中是否含有PRRSV是一个亟待解决的问题。PRRS的发病率逐年上升,对养猪业的危害越来越大,有效的检测和预防该病能在最大程度上降低该病给养殖业带来的巨大的经济损失。目前市面上主流的检测PRRSV的试剂盒是IDEXX HerdChekPRRSELISA试剂盒,它选用免疫原性强且突变率低的N蛋白为靶蛋白,虽然检测准确率在90%以上但是存在假阳性[15],因此需要寻找另外一种蛋白作为靶标以检测PRRSV。而NSP7具备作为一种合适的靶标蛋白以检测PRRSV的条件。NSP7是协助PRRSV RNA复制的重要蛋白[16]。宿主感染PRRSV后可以产生强烈的针对NSP7的免疫反应,并产生高滴度的特异性抗体,这种抗体最早可在感染后14 d检出并可维持202 d[8]。有相关文献报道,以NSP7作为靶标蛋白构建的ELISA试剂盒具有很高的敏感性和特异性,而且可以纠正98%由IDEXX ELISA试剂盒检测的假阳性样本[8]。
重组蛋白的表达形式一般有两种,一种是具有一定空间结构和生物学活性的可溶性形式,另一种是无生物学活性的包涵体[17]。GC含量直接影响着DNA序列的结合稳定性,退火温度,mRNA热力学稳定性和mRNA二级结构。如果基因的GC含量较低的话有利于提高重组蛋白的表达量和提高重组蛋白的可溶性表达概率。不同物种在翻译的时候具有密码子偏好性,也就是不同物种对同义密码子的使用频率不同。若要提高蛋白的表达水平,可对基因的同义密码子进行优化使其与表达宿主的密码子偏好性相匹配。匹配程度常用密码子适应指数 (Codon Adaption Index)来表示,通常情况下,CAI≥0.80被认为是预测重组蛋白高效表达的标准。mRNA二级结构是另一重要的影响翻译过程的因素,复杂稳定的二级结构会影响翻译过程的顺利进行,其中影响翻译的mRNA二级结构主要为发卡结构(Hairpin)[10]。
本文应用生物信息学对NSP7基因进行分析显示NSP7基因具有较高的保守性但是可溶性表达概率为0,然后对重组蛋白基因进行密码子优化以期提高重组蛋白的表达量和使其可溶性表达,随后对重组蛋白进行SDS-PAGE分析,镍柱纯化,Western blot和ELISA鉴定。Western blot和间接ELISA法鉴定纯化的重组蛋白具有免疫学活性,为PRRSV血清学鉴定奠定了基础。

