未破裂颅内动脉瘤患者外周血清microRNA-126、microRNA-125b的表达及其意义①
黄 攀 徐 敏 何晓英
(德阳市人民医院,德阳618000)
未破裂颅内动脉瘤(Intracranial aneurysms,ICA)是指发生于颅内动脉管壁上的异常膨出。由于其发生破裂后具有极高的死亡率、致残率,给社会和家庭带来沉重的负担。因此,深入研究ICA的病理生理机制,对于有效预防ICA具有重要意义。研究显示血管生成、细胞外基质的合成与降解平衡是颅内动脉瘤发生与否的决定性因素,而血管内皮生长因子(Vascular endothelial growth factor,VEGF)、金属基质蛋白酶-9(Matrix metalloproteinases,MMP-9)又是影响上述过程的关键调控因子[1,2]。
microRNA是一类长约17~22个核苷酸的非编码小分子物质,由于其表达稳定,可在外周血中被稳定检测,近年来已成为多种疾病的生物学标记物[3,4]。本研究前期通过生物学信息分析发现microRNA-126、microRNA-125b是VEGF、MMP-9的上游基因之一,且也有基础研究发现microRNA-126、microRNA-125b的确可以通过调控VEGF及MMP-9进而参与疾病的发生。然而,关于microRNA-126、microRNA-125b在未破裂颅内动脉瘤患者外周血中的表达情况及二者与ICA的临床特点、VEGF、MMP-9的关系尚不明确。因此,本研究通过对比检测未破裂颅内动脉瘤与正常患者外周血清中microRNA-126、microRNA-125b、VEGF、MMP-9的表达水平,并采用统计学分析方法初步探讨ICA诊断与治疗的潜在新靶点。
1 材料与方法
1.1材料
1.1.1研究对象 选取2015年9月至 2017年12月在我院门诊体检或住院的颅内未破裂动脉瘤患者120例作为动脉瘤组,另外选取同期健康者63例作为对照组。其中,动脉瘤组中男64例,女56例,年龄34~78岁,平均(41.56±5.87)岁;对照组63例,男33例,女30例,年龄30~76岁,平均(42.13±5.91)岁。两组资料比较差异无统计学意义(P>0.05),具有可比性,见表1。动脉瘤组患者均符合未破裂颅内动脉瘤相关指南的诊断标准,并经相关科室两名医生确认。两组间性别、年龄差异无统计学意义(P>0.05)。所有标本均在患者知情同意下获得,并获得医院伦理委员会批准许可。
1.1.2纳入标准 ①经DSA、CTA或MRA检查确诊为未破裂颅内动脉瘤的患者;②首次确诊为颅内动脉瘤;③未进行手术及药物干预者;④无瘤体破裂者。
1.1.3排除标准 ①入院前已行动脉瘤夹闭或血管内治疗;②临床资料不完整者;③严重心、肝、肾功能不全者;④存在造影剂过敏者;⑤妊娠或者哺乳期妇女者;⑥精神异常不能配合试验者。
1.2方法
1.2.1血清标本的收集 清晨抽取患者空腹外周静脉血样本5 ml,放置于室温下任其自然凝固10~20 min,然后将凝固的血液样本3 000 r/min离心30 min,离心后仔细分离收集上层血清并储存在-80℃超低温冰箱,用于血清总RNA的提取及RT-PCR、ELISA。
1.2.2主要试剂 Trizol Reagent、M-MLV 逆转录酶试剂盒、10 mmol/L dNTP MIX(InvitrogenTM公司,美国);SYBR®Premix Ex TaqTM(TaKaRa公司,美国);VEGF试剂盒(由上海拜力生物科技有限公司代理 ,中国);MMP-9试剂盒(武汉博美生物工程有限公司,中国);microRNA-126、microRNA-125b 和U6引物均有武汉金开瑞生物工程有限公司合成。U6内参序列(Forward:5′-CTCGCTTCGGCAGC-ACAT-3′;Reverse:5′-AACGCTTCACGAATTTGCGT-3′)。microRNA-126序列(Forward:5′-TCGTACCGTGAGTAATAATGCG-3′;Reverse:5′-CTCAACTGGTGTCGTGGAGTC-3′)。microRNA-125b序列(For-ward:5′-CTTCCCTGAGACCCTAACTTGTG-3′;Rever-se:5′-CTCAACTGGTGTCGTGGAGTC-3′)。
1.2.3总RNA提取及RT-PCR 按照RNA提取的相关步骤进行动脉瘤组与对照组患者外周血清中总RNA的提取,按照RT-PCR技术进行microRNA表达的检测,每个样本均独立重复实验3次。其中RNA反转录反应按照如下条件进行:65℃进行预变性5 min,37℃进行逆转录50 min,75℃进行酶灭活15 min。以2.5 μl cDNA 配制 Real-time PCR体系,按如下条件进行 PCR 反应:95℃进行预变性1 min,变性 95℃ 15 s,退火延伸 58℃ 20 s,扩增40个循环。以U6基因作为校正基数,ΔCt=目的基因Ct值-U6基因Ct值,本研究采用2-ΔCt法计算 microRNA-126及microRNA-125b的相对表达量。
1.2.4ELISA检测VEGF和MMP-9 按照相关试剂盒操作说明书对两组患者外周血清中VEGF及MMP-9的表达水平进行检测。

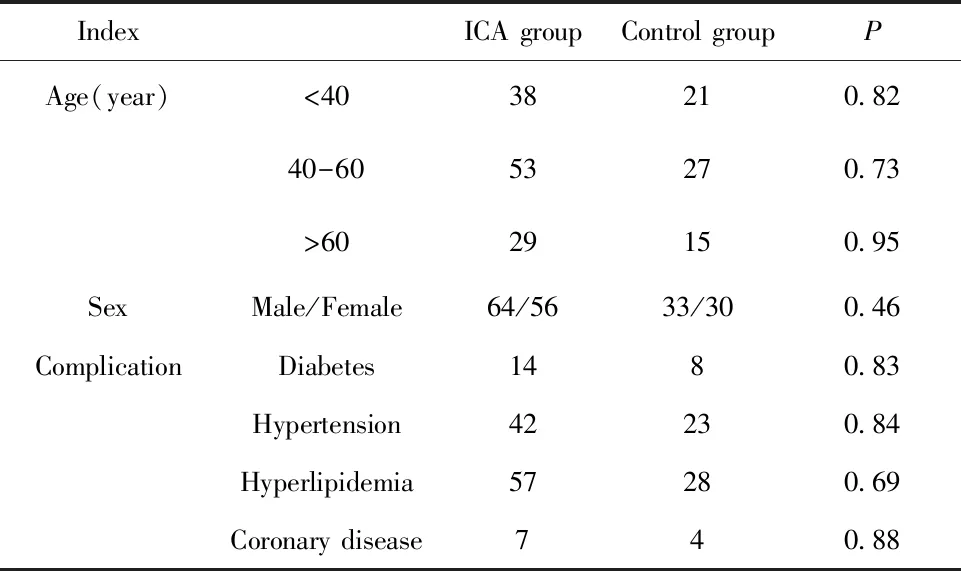
IndexICA groupControl groupPAge(year)<4038210.8240-6053270.73>6029150.95SexMale/Female64/5633/300.46ComplicationDiabetes1480.83Hypertension42230.84Hyperlipidemia57280.69Coronary disease740.88

2 结果
2.1两组患者外周血清中microRNA-126、microRNA-125b表达水平比较 ICA组microNRA-126的表达水平高于对照组,而ICA组microRNA-125b表达水平低于对照组,差异具有显著统计学意义(P<0.001)。见图1。
2.2两组患者外周血清中VEGF、MMP-9表达水平比较 ICA组VEGF、MMP-9的表达水平高于对照组,差异具有显著统计学意义(P<0.001)。见表2。
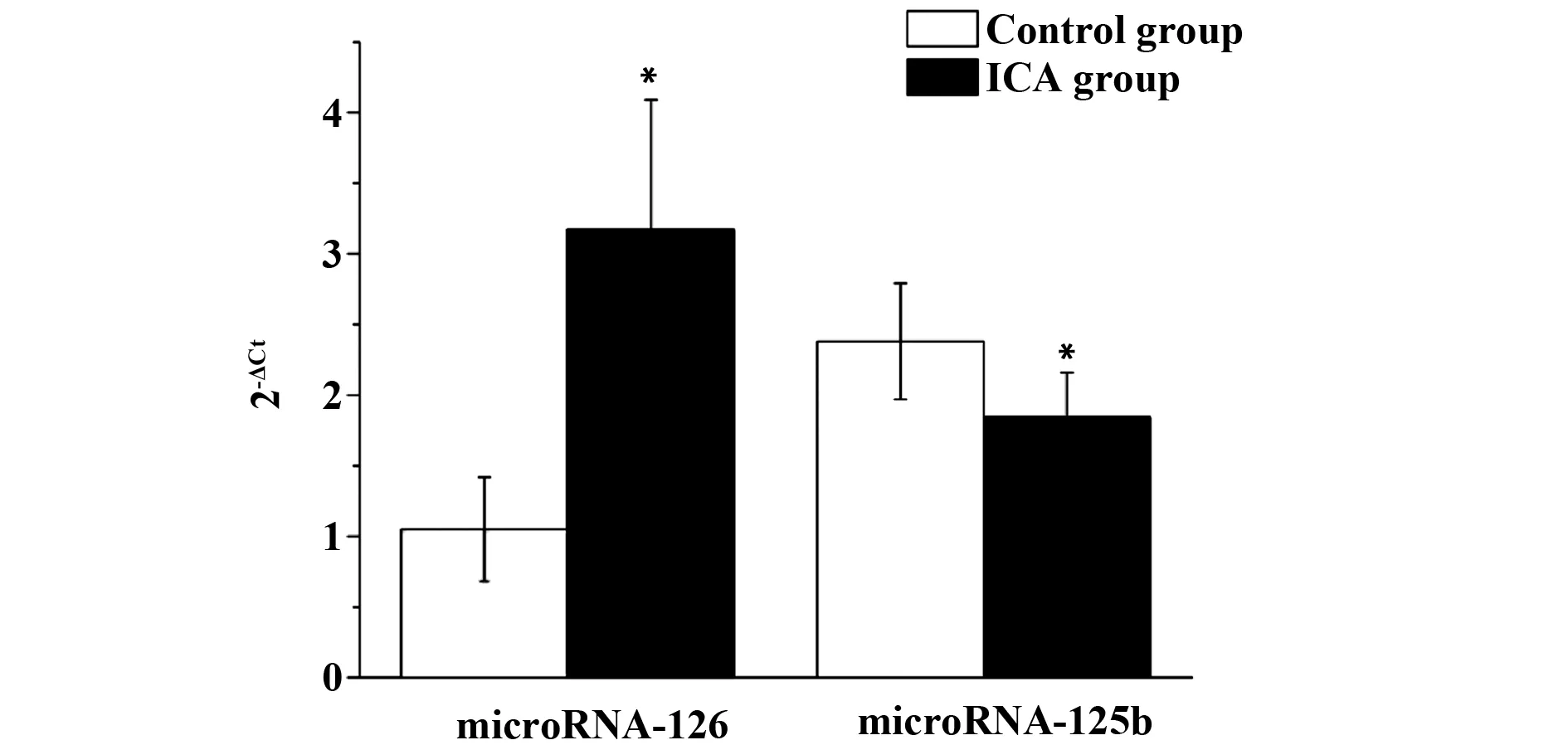
图1 两组患者microRNA-126、microRNA-125b表达水平比较Fig.1 Comparison of levels of serum microRNA-126,microRNA-125b in two Note: *.P<0.01.
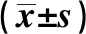
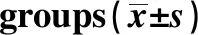

GroupsnVEGF(pg/ml)MMP-9(ng/ml)Control group6398.56±33.2515.72±3.08ICA group120125.37±41.8680.08±17.52t4.4428.88P<0.01<0.01
表3 microRNA-126、microRNA-125b的表达水平与颅内动脉瘤患者临床特点的关系
Tab.3 Clinical correlation of microRNA-126,microRNA-125b expression in ICA
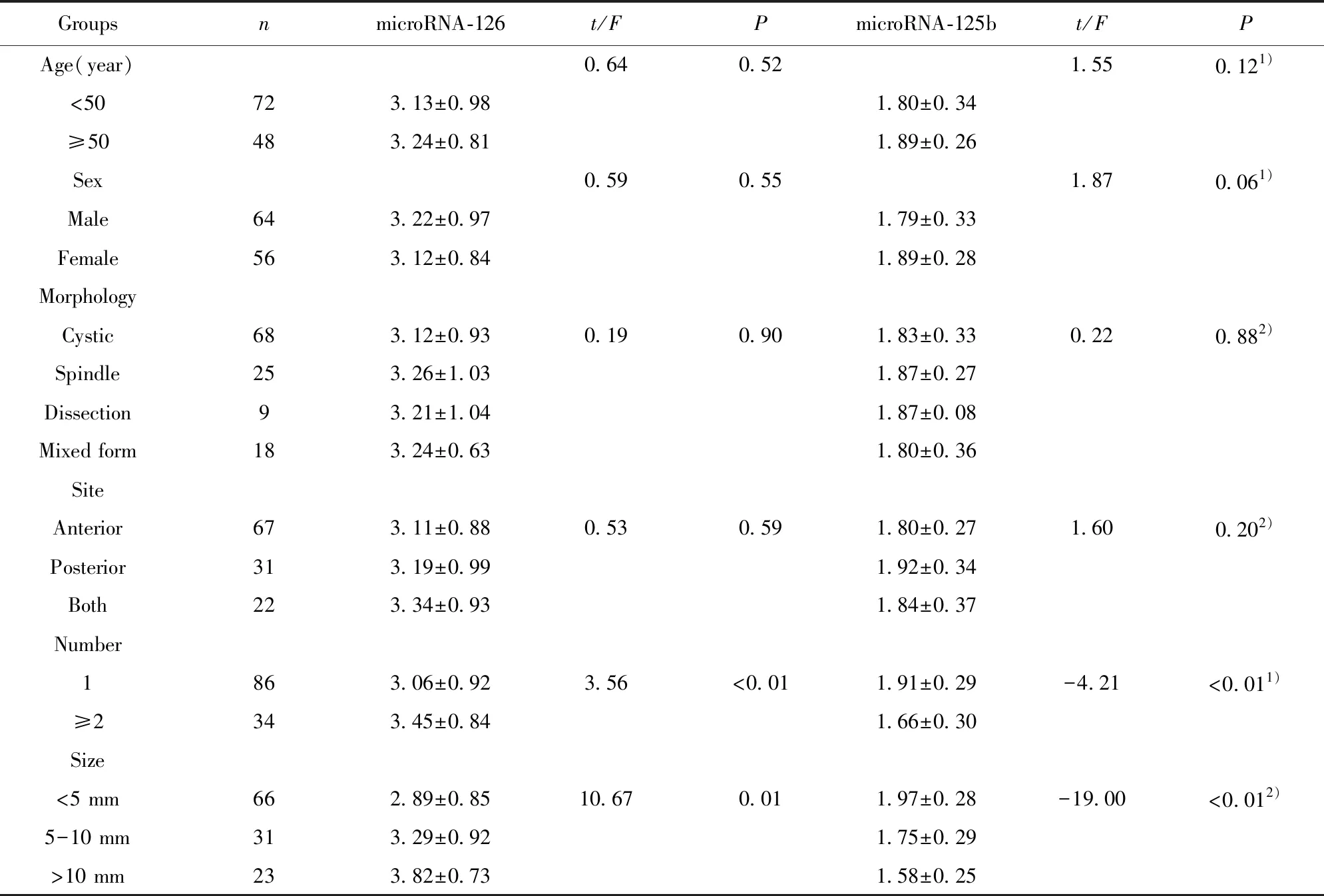
GroupsnmicroRNA-126t/FPmicroRNA-125bt/FPAge(year)0.640.521.550.121)<50723.13±0.981.80±0.34≥50483.24±0.811.89±0.26Sex0.590.551.870.061)Male643.22±0.971.79±0.33Female563.12±0.841.89±0.28MorphologyCystic683.12±0.930.190.901.83±0.330.220.882)Spindle253.26±1.031.87±0.27Dissection93.21±1.041.87±0.08Mixed form183.24±0.631.80±0.36SiteAnterior673.11±0.880.530.591.80±0.271.600.202)Posterior313.19±0.991.92±0.34Both223.34±0.931.84±0.37Number1863.06±0.923.56<0.011.91±0.29-4.21<0.011)≥2343.45±0.841.66±0.30Size<5 mm662.89±0.8510.670.011.97±0.28-19.00<0.012)5-10 mm313.29±0.921.75±0.29>10 mm233.82±0.731.58±0.25
Note:1)indicates the use ofttest;2)indicates the use of One-way ANOVA.
表4 microRNA-126、microRNA-125b与VEGF、MMP-9相关性
Tab.4 Expression correlation of microRNA-126,micro-RNA-125b and VEGF,MMP-9 in ICA
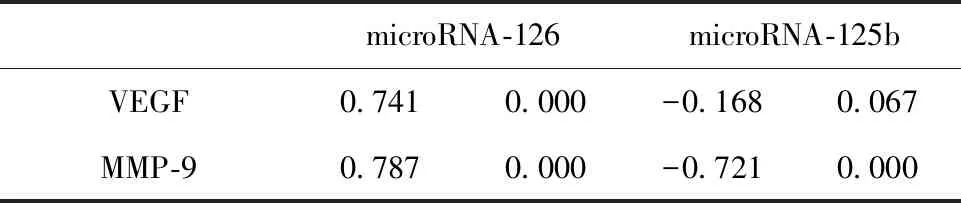
microRNA-126microRNA-125bVEGF0.7410.000-0.1680.067MMP-90.7870.000-0.7210.000
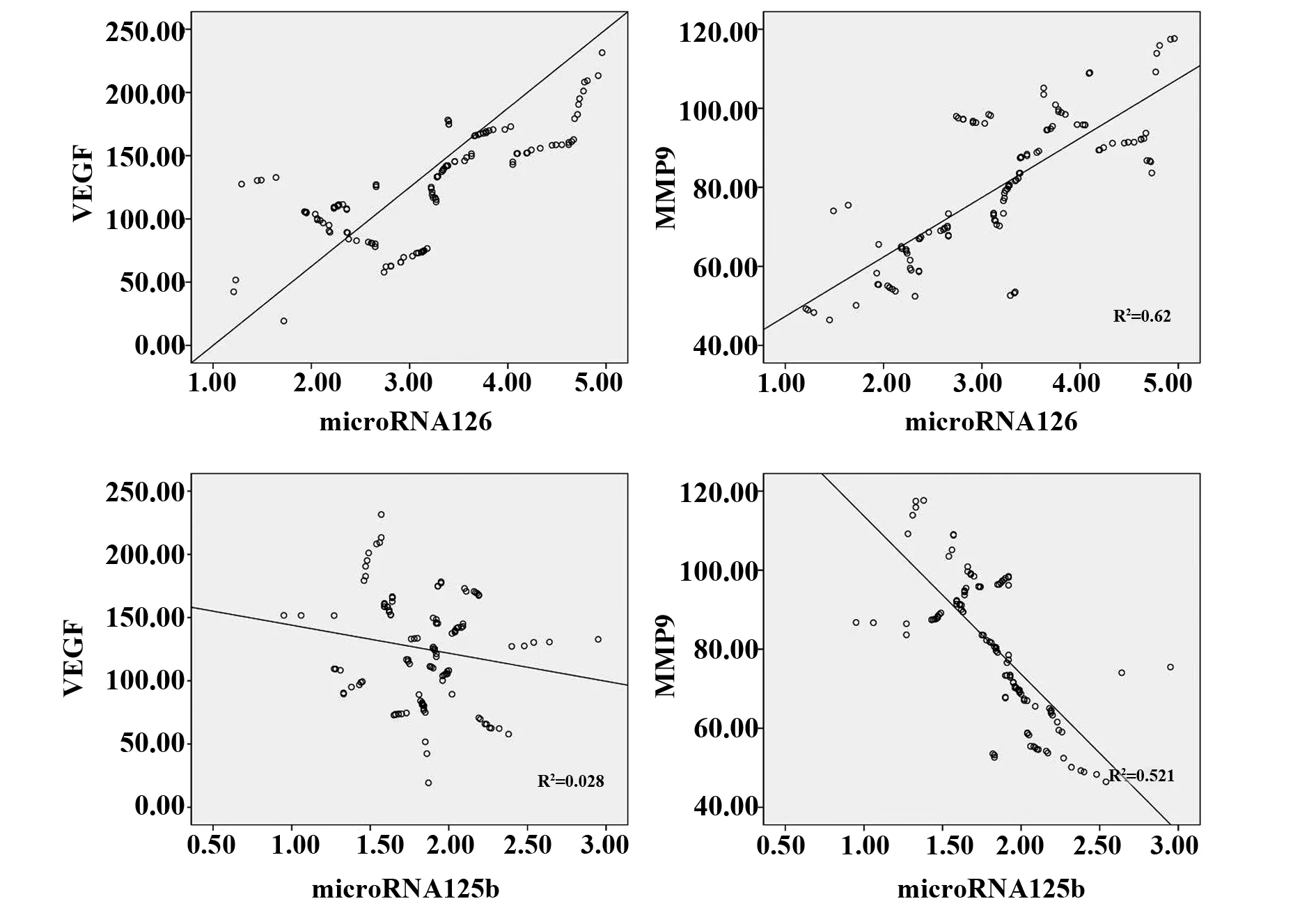
图2 microRNA-126、microRNA-125b与VEGF、MMP-9相关性分析Fig.2 Expression correlation of microRNA-126,microRNA-125b and VEGF,MMP-9 in ICA
2.3microRNA-126、microRNA-125b与颅内动脉瘤患者临床特征的关系 颅内动脉瘤患者外周血清中microRNA-126、microRNA-125b的表达水平与年龄、性别、瘤体形态、瘤体部位无明显关系(P>0.05),而与瘤体数目、瘤体积大小相关(P<0.05)。见表3。
2.4microRNA-126、microRNA-125b的表达水平与VEGF、MMP-9表达水平的相关性分析 相关性分析表明microRNA-126与VEGF、MMP均具有正相关性(P<0.01);而microRNA-125b仅与MMP-9呈负相关(P<0.01),与VEGF无相关关系(P>0.05)。见表4、图2。
3 讨论
据统计,75%的蛛网膜下腔出血是由ICA破裂引起的,由于ICA在破裂之前常无明显症状、体征,该病可谓是严重威胁生命的“隐形杀手”[5],因此,对于ICA做到早期发现、早期预防尤为重要。由于ICA的影像学检查存在有创、耗时等缺点且在短时间内无法改善,使得生化检测技术逐渐受到人们的关注[6,7]。microRNA是一类长度约17~22个核苷酸的非编码小分子物质,其通过碱基互补配对的原则与靶基因mRNA结合进而抑制相关蛋白的转录后翻译从而发挥调控生长发育、疾病发生发展的过程[8],由于其表达稳定,近年来已成为多种疾病的生物学标记物[9]。研究发现,ICA也存在着microRNA的差异表达谱[10],有研究者通过对ICA病理取材标本进行基因芯片检测发现ICA中存在差异表达的microRNA多达32种,且通过生物学信息分析发现这些microRNA可以通过调节内皮细胞凋亡、平滑细胞增殖迁移、炎症免疫细胞的增殖迁移等途径参与ICA的发病[11-13]。本研究通过RT-PCR技术证实ICA患者外周血清microRNA-126的表达水平明显高于无ICA人群,而microRNA-125b的表达水平明显低于无ICA人群,且二者的表达水平与瘤体积大小、数目多少密切相关,提示microRNA-126、microRNA-125b与ICA的发病密切相关。
关于ICA的发病机制,目前多数学者认为是由于颅内动脉管壁局部的先天性缺陷和腔内压力增高引起,传统的危险因素包括高血压、脑动脉硬化、血管炎等多种因素[14],而新近研究发现,VEGF、MMP-9也参与了颅内动脉瘤的发生。颅内动脉正常结构的维持依赖于细胞外基质(ECM)的合成与降解保持平衡,此平衡的破坏是导致ICA发生的主要原因[15]。MMP-9作为最主要的细胞外基质溶解酶之一,其过表达必然会引起ECM的降解加速,导致血管外膜中纤维连接薄弱,在血流剪切力的作用下加速ICA的形成[16]。Xiao等[17]研究发现,ICA病理组织中MMP-9的表达水平明显升高,且主要是在血管中膜及外膜上高表达。此外研究显示,ICA病理组织中VEGF的阳性表达率增高,VEGF是一种强促血管生成因子,不仅可以促进MMP-9的激活及转录[18],还能促进尿激酶型纤溶酶(UPA)的表达上调进而间接发挥促ECM降解作用。本研究通过ELISA技术发现ICA患者外周血清中VEGF、MMP-9的表达水平明显高于对照组,再次证实VEGF、MMP-9参与ICA的致病,与多数研究结论相似。
体外研究显示,VEGF是microRNA-126的下游靶基因,microRNA-126可以通过多条信号通路调控VEGF的生成进而发挥调控血管生成的作用,因此microRNA-126被认为是血管生成的关键调控因子。为进一步探讨microRNA-126在ICA致病中的分子机制,本研究通过microRNA-126与VEGF、MMP-9相关性分析发现:microRNA-126与VEGF、MMP-9呈正相关,推测在ICA中过表达的microRNA-126可以通过促进VEGF及MMP-9的分泌进而参与ICA的致病。此外,本研究还发现microRNA-125b与MMP-9呈负相关性,推测microRNA-125b可能通过负性调节MMP-9的表达影响ICA的发生。目前关于microRNA-125b与MMP-9的调控机制尚无明确报道,仅在基础试验研究中发现microRNA-125b具有调控MMP-9的作用,但其表达的高低与具体的调控机制存在争议。然而受条件限制,本研究仅采用相关性分析的方法初步探讨其可能的机制,并未进行体外试验对上述推测进行验证,因此,需待后续试验进一步探究。
综上所述,microRNA-126、microRNA-125b在ICA患者外周血清中存在差异表达谱,且二者的表达水平与ICA的临床特点、VEGF、MMP-9具有密切关联,但其具体机制尚不清楚,需进一步深入研究。

