甘草甜素通过抑制炎症反应和氧化应激改善大鼠蛛网膜下腔出血后血脑屏障损伤①
肖 刚 罗 超 彭 形 蒋光元 滕志鹏
(重庆市中医院神经外科,重庆400021)
自发性蛛网膜下腔出血(Subarachnoid hemorr-hage,SAH)属于严重的神经外科急症,死亡率为30%~70%,存活患者部分伴有残疾,严重影响患者生活质量[1]。临床以及动物研究均显示蛛网膜下腔出血会造成血脑屏障破坏、脑水肿、血管内皮收缩以及紧密连接分解等导致血脑屏障通透性增加[2]。对于其机制,目前尚未有明确定论。已有研究显示蛛网膜下腔出血后会启动炎症反应,参与其发病进展;而抑制氧化应激反应可减少大脑皮层细胞凋亡,防止血脑屏障的破坏[3]。本研究通过建立蛛网膜下腔出血大鼠模型,并给予甘草甜素处理,以探究其对血脑屏障的改善以及与炎症反应、氧化应激反应的关系,为蛛网膜下腔出血临床治疗提供一定的参考。
1 材料与方法
1.1材料
1.1.1实验动物 SPF清洁级SD成年雄性大鼠均购自河南省实验动物中心,许可证号为:SYXK(豫)2016-0002,体重200~260 g,严格按照大鼠饲养规则进行喂养,温度为25℃,湿度为50%,光照时间为8:00~20:00,饮用蒸馏水,饲养期间保持饲养房间整洁、通风,定时对鼠笼进行清理。
1.1.2仪器与试剂 甘草甜素(江苏奥赛康药业有限公司;批号:20150619);尼莫地平(亚宝药业集团股份有限公司;批号:20150822);IL-1β、IL-6、TNF-α、MDA、3-NT、8-OHDG ELISA试剂盒购自美国Santa Cruz公司,ZO-1、occludin、claudin-5、Bax、Bcl-2兔抗鼠一抗购自美国R&D公司;HRP标记的羊抗兔IgG二抗、β-actin购自美国Abnova公司,RNA提取试剂盒、反转录试剂盒购自日本TaKaRa公司;BCA测定试剂盒购自上海碧云天生物科技有限公司;苏木素染色剂购自珠海贝索生物技术有限公司;荧光定量PCR仪购自美国BioRed公司;光学显微镜购自上海光学仪器厂;Hitachi透射电子显微镜购自日立高新技术公司;凝胶成像仪购自美国GE公司。
1.2方法
1.2.1大鼠SAH模型制备 所有大鼠在模型制备前禁食12 h,腹腔注射10% 3.5 ml/kg水合氯醛麻醉,在腹侧正中部位制作纵行切口,将颈动脉鞘部位进行解剖,同时分离颈总、外、内动脉后,与颈外动脉远端进行结扎,并将颈总、内动脉用血管夹临时夹闭,用显微剪刀于颈外动脉残端做一小口,于小口处将尼龙线送入,同时解除临时血管夹,在此期间采用多普勒监测脑血流变化,当显示脑血流突然降低,且颅内压明显升高时将尼龙线撤回,并结扎颈外动脉。模型制备结束24 h后,随机选取6只大鼠再次进行麻醉获取脑组织,对出血量进行评定,并参考文献[4]中大鼠SAH评分8~12分时为模型制备成功。
1.2.2实验分组 将大鼠随机分为假手术、模型组、甘草甜素低、中、高剂量组、阳性组(尼莫地平组),每组30只大鼠。假手术组大鼠仅将尼龙线送入颈内动脉并不刺破血管,假手术组、模型组大鼠均于模型制备结束后次日给药,经侧脑室注射DMSO溶液;甘草甜素低、中、高剂量组、阳性组经侧脑室注射25 mg/kg、50 mg/kg、100 mg/kg甘草甜素以及40 mg/kg尼莫地平注射液,所有大鼠均给药一周,每日一次。
1.2.3各组大鼠神经行为学评分 给药全部结束后,对大鼠神经功能进行评定[5],主要从以下几个方面进行评定:自主性活性情况、肢体活动度、肢体伸展情况、爬坡、体侧本体感觉以及触须反应,满分为18分,评分越低说明神经功能缺失越明显。
1.2.4脑组织含水量测定 给药结束后,每组随机选取18只大鼠,给药结束后24、48、72 h腹腔注射10%水合氯醛麻醉,将大鼠处死取脑,将脑组织置于电子天平中称重,此时测得重量为湿重,随后将脑组织放置于80℃恒温箱中,待脑组织体重不再变化后,记录所测重量为干重。
1.2.5血脑屏障通透性检测 给药结束后,每组随机选取6只大鼠,采用伊文氏蓝渗出量评估法检测通透性,经股静脉注射2% 4 ml/kg 伊文氏蓝,心脏灌注后断头取脑,置于4倍体积的甲酰胺中,37℃反应72 h,于酶标仪中620 nm处测定吸光值,绘制标准曲线计算脑组织中伊文氏蓝含量。
1.2.6大鼠基底动脉HE染色 给药结束后,每组随机选取6只大鼠,处理后获得脑组织,一部分置于-80℃冰箱中保存。从脑组织中将脑干、基底动脉分离后进行石蜡包埋,置于二甲苯中20 min进行固定,随后在体积分数100%、95%、85%、75%的乙醇中均脱水5 min,蒸馏水冲洗后,加入苏木素染液染色15 min,置于1%盐酸5 s后,蒸馏水冲洗,随后滴加伊红染液进行复染5 min,分别在体积分数75%、85%、95%、100%中均脱水2 min,滴加二甲苯进行透明处理,最后用中性树脂进行封片,置于显微镜下进行观察。
1.2.7透射电镜观察脑组织超微结构变化情况 取出冻存脑组织,用无菌剪刀剪碎后置于2.5%戊二醛浸泡,添加2%四氧化锇进行固定,随后在不同梯度乙醇中各脱水5 min,用树脂包埋后,采用醋酸铀与枸杞酸铅双重染色后,置于电镜下观察脑组织超微结构如脑微血管内皮细胞连接情况以及吞饮小泡数量变化。
1.2.8酶联免疫法检测脑组织中 IL-1β、IL-6、TNF-α、MDA、3-NT、8-OHDG表达 脑组织中 IL-1β、IL-6、TNF-α、MDA、3-NT、8-OHDG水平采用酶联免疫法进行检测,具体参照试剂盒说明书进行操作。
1.2.9反转录PCR(Reverse transcription-PCR,RT-PCR)检测脑组织中COX-2、iNOS、ICAM-1、VCAM-1 mRNA表达 参照RNA提取试剂盒进行脑组织总RNA提取,参照逆转录试剂盒将RNA反转录为cDNA,RT-PCR引物序列如表1。反应体系:10×cDNA模板1 μl,上下游引物各0.5 μl,H2O 8 μl,2×SYBR Mix 10 μl。按照反应程序95℃ 3 min,95℃ 10 s、60℃ 30 s,72℃ 2 min,40个循环,72℃延伸10 min。以β-actin作为内参基因在CFX manager 软件上按照2-ΔΔCt算法进行基因相对定量分析。
1.2.10脑组织中丙二醛(Malonaldehyde,MDA)、超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的测定 采用比色法检测GSH-Px水平,氮蓝四唑光还原法检测SOD水平,硫代巴比妥酸法检测MDA水平。
1.2.11蛋白免疫印迹法(Western blot,WB)检测ZO-1、occludin、claudin-5、Bax、Bcl-2蛋白表达 取出保存的脑组织剪碎后加入蛋白裂解液在冰上放置30 min,离心后收集上清液,提取组织总蛋白,BCA法测定蛋白浓度,配制12%分离胶、5%浓缩胶,蛋白上样量为20 μg,电压设定在80 V,样品指示剂到达分离胶后,电压升高至120 V,电泳结束后,蛋白凝胶移至PVDF膜,冰上行转膜反应,电压为100 V,转膜1 h,用TBST溶液清洗后加入5%脱脂牛奶室温下封闭1 h,TBST溶液清洗后,加入一抗,4℃过夜,TBST清洗后加入二抗,室温下放置2 h,TBST清洗后ECL显色,置于凝胶成像仪中观察各组蛋白变化情况。

2 结果
2.1各组大鼠神经行为学评分结果 与假手术组相比,模型组大鼠神经行为学评分降低,差异有统计学意义(P<0.05)。与模型组相比,甘草甜素组、阳性组大鼠神经行为学评分升高,且具有剂量依赖性,差异有统计学意义(P<0.05),见表2。
2.2大鼠脑含水量以及血脑屏障通透性检测结果 与假手术组相比,模型组大鼠脑含水量于给药后24、48、72 h升高,EB含量升高,差异有统计学意义(P<0.05);与模型组相比,甘草甜素组、阳性组大鼠脑含水量、EB含量下降,具有剂量依赖性,差异有统计学意义(P<0.05),见表3。
表1 RT-PCR引物序列
Tab.1 RT-PCR primer sequence

GenesF(5′-3′)R(5′-3′)COX-2AGAAAGAAATGGCTGCAGAGCTAGGTTTCCAGTATTGAGiNOSCCTTGTTCAGCTACGCCTTCAAGGCCAAATACCGCATACCICAM-1TTCACACTGAATGCCAGCCCGTCTGCTGAGACCCCTCTTGVCAM-1ATTTTCTGGAGCAAGAAATTATGTCAGAACAACGGAATCCβ-actinAAGTCCCTCACCCTCCCAAAAGAAGCAATGCTGTCACCTTCCC
2.3HE观察大鼠基底动脉段组织学形态变化 假手术组基底动脉管腔较大,管腔呈圆形或椭圆形,管壁薄,未出现皱纹,而模型组基底动脉管腔变狭窄,管壁、内膜变厚,管壁内膜出现褶皱、结构紊乱,血管内外膜出现炎性细胞浸润,而经处理后基底动脉有所缓解,随着甘草甜素处理剂量的增加,基底动脉逐渐恢复正常,见图1。
表2 神经行为学评分结果
Tab.2 Neurobehavioral score
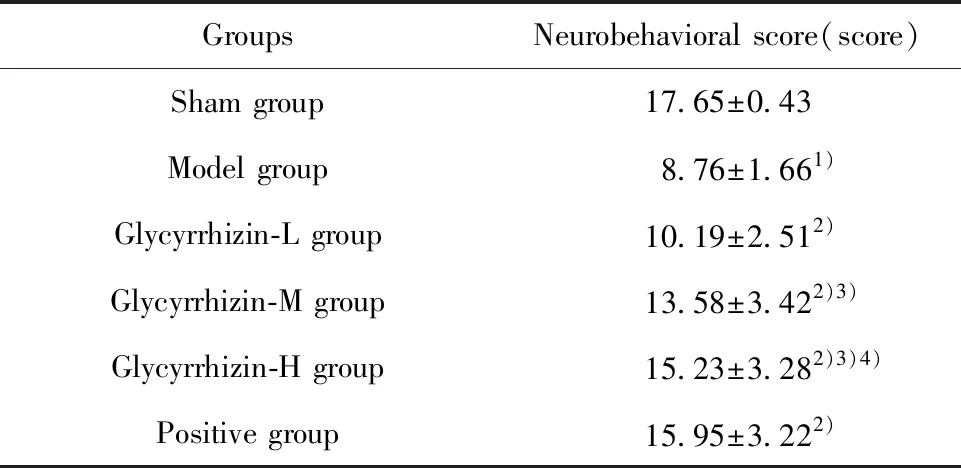
GroupsNeurobehavioral score(score)Sham group17.65±0.43Model group8.76±1.661)Glycyrrhizin-L group10.19±2.512)Glycyrrhizin-M group13.58±3.422)3)Glycyrrhizin-H group15.23±3.282)3)4)Positive group15.95±3.222)
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
2.4透射电镜观察微血管内皮细胞连接情况 电镜结果显示,正常脑组织血管内皮细胞中,吞饮小泡数量较少,其连接紧密,位于相邻细胞膜间。模型组内皮细胞壁受损,内皮细胞紧密连接开放,而经处理后内皮细胞紧密开放程度有所降低,随着甘草甜素处理剂量的增加,开放程度下降至正常。见图2。
2.5大脑皮层细胞凋亡情况 Tunel染色显示,与假手术组相比,模型组大脑皮层细胞出现大量凋亡,差异有统计学意义(P<0.05);与模型组相比,甘草甜素组、阳性组大脑皮层细胞凋亡率逐渐降低,差异有统计学意义(P<0.05),见图3、表4。
2.6IL-1β、IL-6、 TNF-α、3-NT、8-OHDG水平测定情况 与假手术组相比,模型组 IL-1β、IL-6、TNF-α、3-NT、8-OHDG水平均升高,差异有统计学意义(P<0.05);与模型组相比,甘草甜素组和阳性组IL-1β、IL-6、TNF-α、3-NT、8-OHDG水平均降低,具有剂量依赖性,差异有统计学意义(P<0.05)。见表5。
表3 脑含水量以及血脑屏障通透性测定结果
Tab.3 Determination of brain water content and blood brain barrier permeability
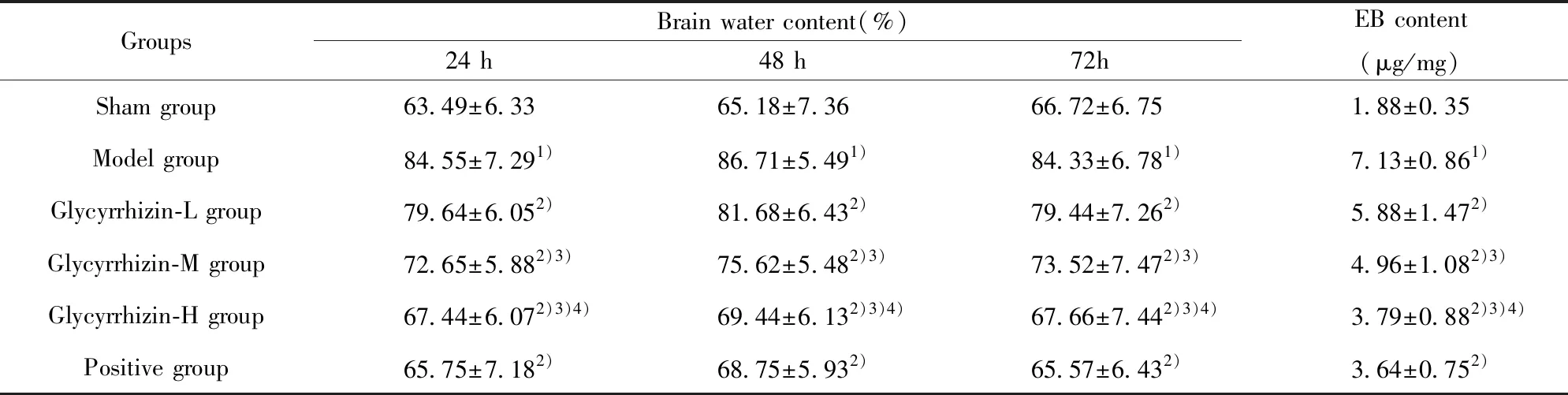
GroupsBrain water content(%)24 h48 h72hEB content(μg/mg)Sham group63.49±6.3365.18±7.3666.72±6.751.88±0.35Model group84.55±7.291)86.71±5.491)84.33±6.781)7.13±0.861)Glycyrrhizin-L group79.64±6.052)81.68±6.432)79.44±7.262)5.88±1.472)Glycyrrhizin-M group72.65±5.882)3)75.62±5.482)3)73.52±7.472)3)4.96±1.082)3)Glycyrrhizin-H group67.44±6.072)3)4)69.44±6.132)3)4)67.66±7.442)3)4)3.79±0.882)3)4)Positive group65.75±7.182)68.75±5.932)65.57±6.432)3.64±0.752)
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
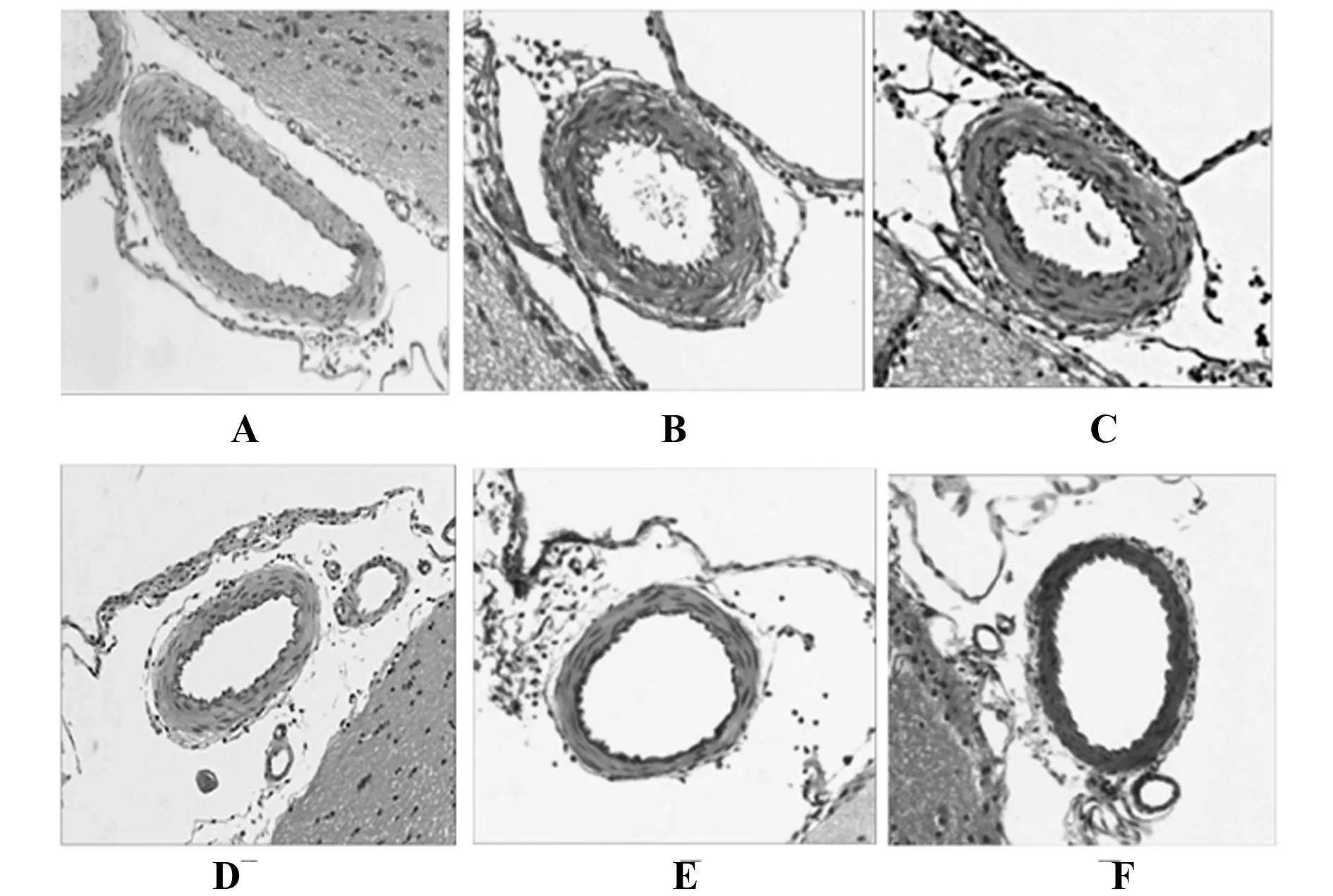
图1 大鼠脑动脉段组织学形态(×200)Fig.1 Histologic morphology of cerebral artery segment of rat(×200)Note: A.Sham group;B.Model group;C.Glycyrrhizin-L group;D.Glycyrrhizin-M group;E.Glycyrrhizin-H group;F.Positive group.
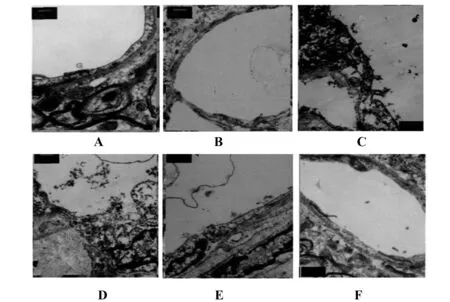
图2 脑组织微血管内皮细胞连接情况(×10 000)Fig.2 Connection of microvascular endothelial cells in brain tissue(×10 000)Note: A.Sham group;B.Model group;C.Glycyrrhizin-L group;D.Glycyrrhizin-M group;E.Glycyrrhizin-H group;F.Positive group.
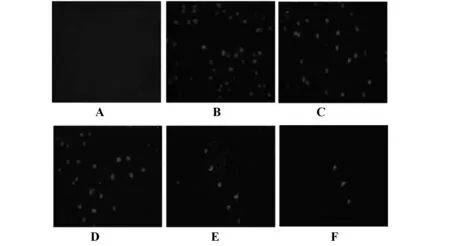
图3 大脑皮层细胞凋亡情况 Fig.3 Apoptosis of cerebral cortex cellsNote: A.Sham group;B.Model group;C.Glycyrrhizin-L group;D.Glycyrrhizin-M group;E.Glycyrrhizin-H group;F.Positive group.
表4 细胞凋亡率比较
Tab.4 Comparison of cell apoptosis rate
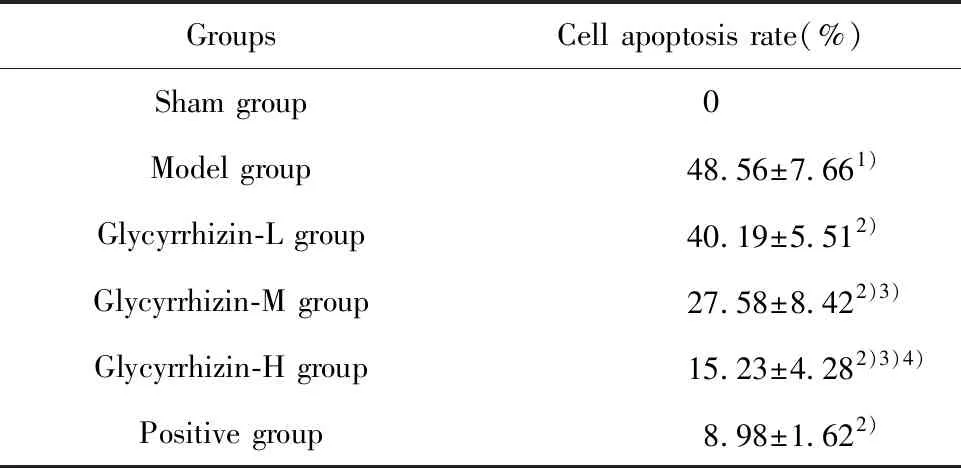
GroupsCell apoptosis rate(%)Sham group0Model group48.56±7.661)Glycyrrhizin-L group40.19±5.512)Glycyrrhizin-M group27.58±8.422)3)Glycyrrhizin-H group15.23±4.282)3)4)Positive group8.98±1.622)
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
2.7脑组织中MDA、 SOD、GSH-Px水平测定结果 与假手术组相比,模型组MDA水平升高,SOD、GSH-Px水平降低,差异有统计学意义(P<0.05);与模型组相比,甘草甜素组和阳性组MDA水平降低,SOD、GSH-Px水平升高,具有剂量依赖性,差异有统计学意义(P<0.05)。见表6。
2.8RT-PCR检测脑组织中COX-2、iNOS、ICAM-1、VCAM-1 mRNA表达 与假手术组相比,模型组 COX-2、iNOS、ICAM-1、VCAM-1 mRNA表达升高,与模型组相比,甘草甜素组和阳性组 COX-2、iNOS、ICAM-1、VCAM-1 mRNA表达降低,具有剂量依赖性,差异有统计学意义(P<0.05),见表7。
2.9WB 检测ZO-1、occludin、claudin-5、Bax、Bcl-2蛋白表达 与假手术组相比,模型组 ZO-1、occludin、claudin-5、Bcl-2蛋白表达降低,Bax蛋白表达升高;与模型组相比,甘草甜素组和阳性组 ZO-1、occludin、claudin-5、Bcl-2蛋白表达升高,Bax蛋白表达降低,具有剂量依赖性,差异有统计学意义(P<0.05),见表8,图4。
表6 脑组织中MDA、 SOD、GSH-Px测定结果
Tab.6 Levels of MDA,SOD and GSH-Px in brain tissue

GroupsMDA(nmol/g)SOD(U/mg)GSH-Px(U/mg)Sham group37.44±3.790.59±0.040.96±0.06Model group75.13±5.681)0.22±0.021)0.55±0.081)Glycyrrhizin-L group66.19±5.222)0.30±0.032)0.61±0.072)Glycyrrhizin-M group55.34±4.862)3)0.38±0.042)3)0.72±0.062)3)Glycyrrhizin-H group43.17±4.132)3)4)0.47±0.052)3)4)0.81±0.052)3)4)Positive group38.46±3.880.52±0.080.88±0.06
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
表5 脑组织中IL-1β,IL-6,TNF-α,3-NT、8-OHDG检测结果
Tab.5 Levels of IL-1β,IL-6,TNF-α,3-NT and 8-OHDG in brain tissue
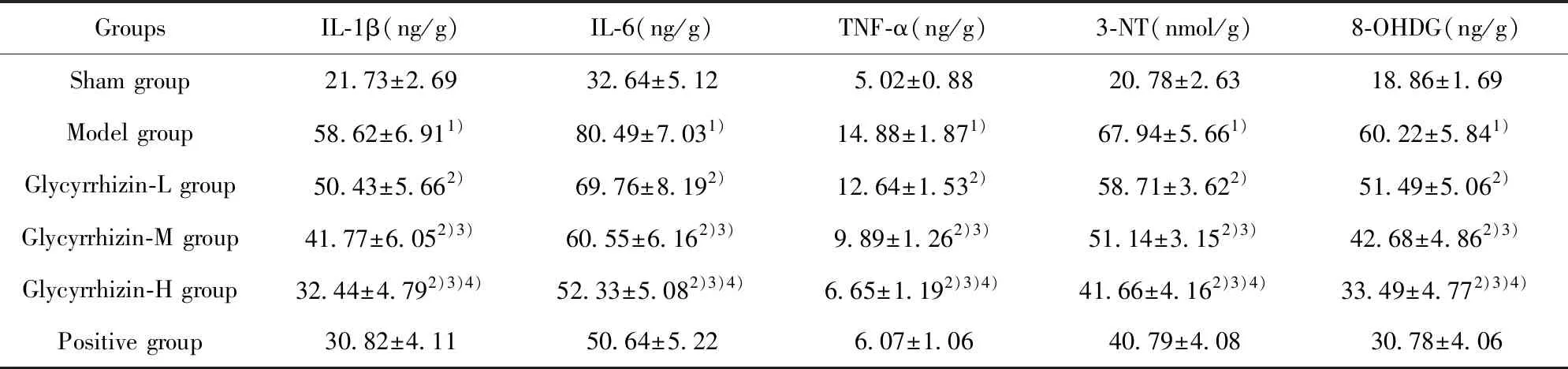
Groups IL-1β(ng/g)IL-6(ng/g) TNF-α(ng/g)3-NT(nmol/g)8-OHDG(ng/g)Sham group21.73±2.6932.64±5.125.02±0.8820.78±2.6318.86±1.69Model group58.62±6.911)80.49±7.031)14.88±1.871)67.94±5.661)60.22±5.841)Glycyrrhizin-L group50.43±5.662)69.76±8.192)12.64±1.532)58.71±3.622)51.49±5.062)Glycyrrhizin-M group41.77±6.052)3)60.55±6.162)3)9.89±1.262)3)51.14±3.152)3)42.68±4.862)3)Glycyrrhizin-H group32.44±4.792)3)4)52.33±5.082)3)4)6.65±1.192)3)4)41.66±4.162)3)4)33.49±4.772)3)4)Positive group30.82±4.1150.64±5.226.07±1.0640.79±4.0830.78±4.06
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
表7 脑组织中COX-2、iNOS、ICAM-1、VCAM-1 mRNA表达
Tab.7 Expression of COX-2,iNOS,ICAM-1 and VCAM-1 mRNA in brain tissue
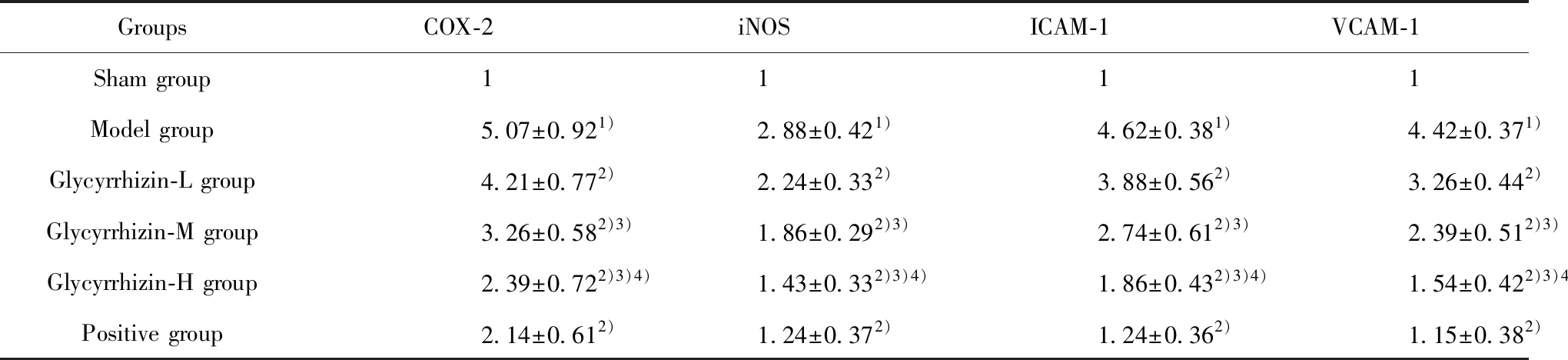
GroupsCOX-2iNOSICAM-1VCAM-1Sham group1111Model group5.07±0.921)2.88±0.421)4.62±0.381)4.42±0.371)Glycyrrhizin-L group4.21±0.772)2.24±0.332)3.88±0.562)3.26±0.442)Glycyrrhizin-M group3.26±0.582)3)1.86±0.292)3)2.74±0.612)3)2.39±0.512)3)Glycyrrhizin-H group2.39±0.722)3)4)1.43±0.332)3)4)1.86±0.432)3)4)1.54±0.422)3)4)Positive group2.14±0.612)1.24±0.372)1.24±0.362)1.15±0.382)
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
表8 ZO-1、occludin、claudin-5、Bax、Bcl-2蛋白表达
Tab.8 Protein expression of ZO-1,occludin,claudin-5,Bax and Bcl-2
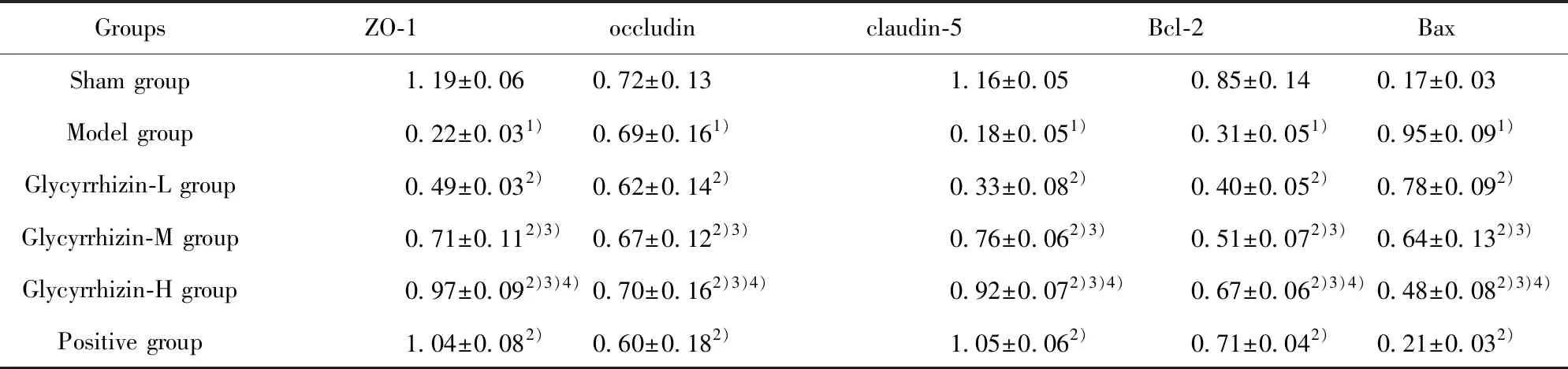
GroupsZO-1occludinclaudin-5Bcl-2BaxSham group1.19±0.060.72±0.131.16±0.050.85±0.140.17±0.03Model group0.22±0.031)0.69±0.161)0.18±0.051)0.31±0.051)0.95±0.091)Glycyrrhizin-L group0.49±0.032)0.62±0.142)0.33±0.082)0.40±0.052)0.78±0.092)Glycyrrhizin-M group0.71±0.112)3)0.67±0.122)3)0.76±0.062)3)0.51±0.072)3)0.64±0.132)3)Glycyrrhizin-H group0.97±0.092)3)4)0.70±0.162)3)4)0.92±0.072)3)4)0.67±0.062)3)4)0.48±0.082)3)4)Positive group1.04±0.082)0.60±0.182)1.05±0.062)0.71±0.042)0.21±0.032)
Note:Compared with the sham group,1)P<0.05;compared with the model group,2)P<0.05;compared with the Glycyrrhizin-L group,3)P<0.05;compared with the Glycyrrhizin-M group,4)P<0.05.
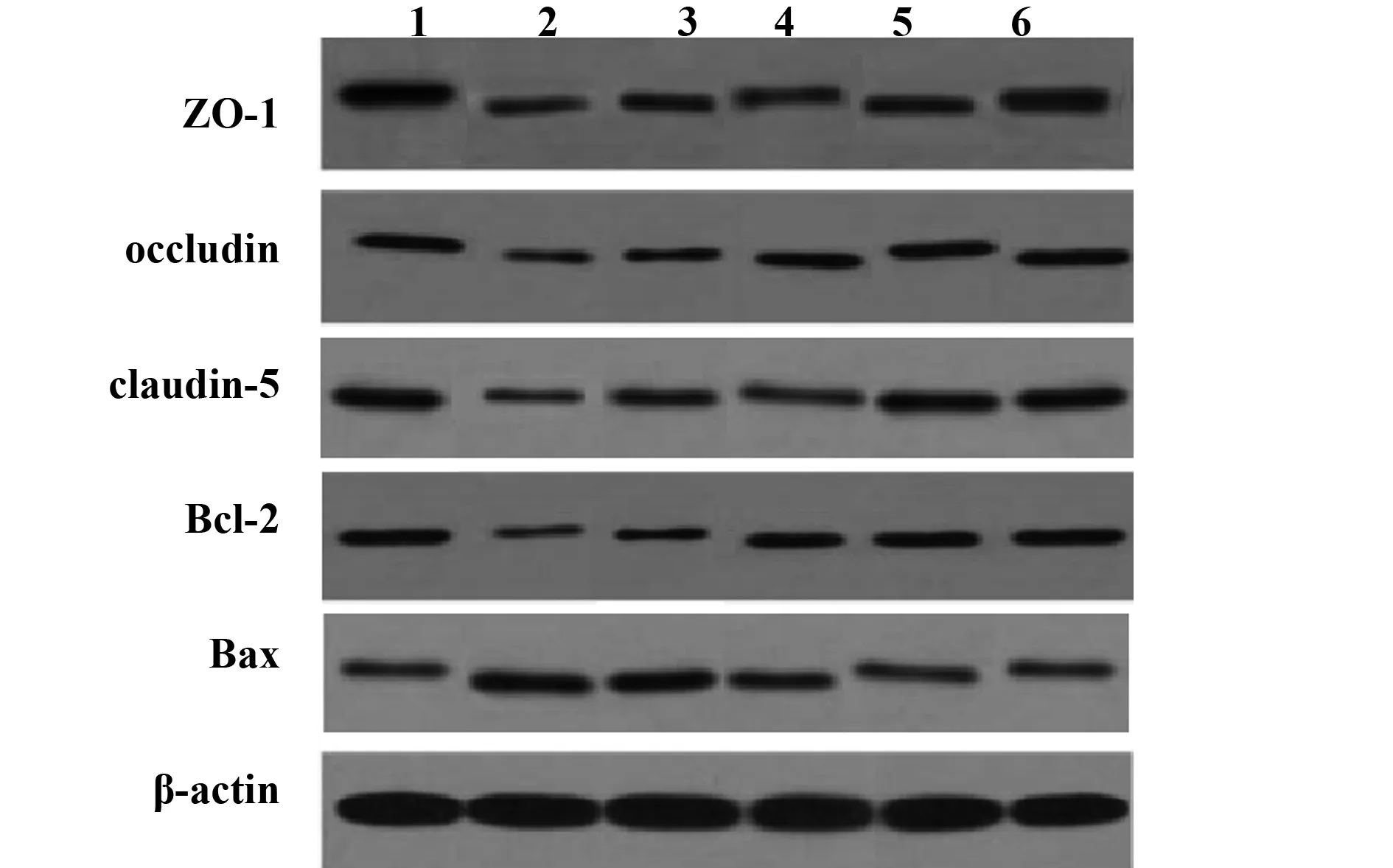
图4 ZO-1、occludin、claudin-5、Bax、Bcl-2蛋白表达Fig.4 Protein expression of ZO-1,occludin,claudin-5,Bax and Bcl-2Note: 1.Sham group;2.Model group;3.Glycyrrhizin-L group;4.Glycyrrhizin-M group;5.Glycyrrhizin-H group;6.Positive group.
3 讨论
甘草甜素又称甘草酸,是从甘草根茎中提取的三萜类化合物,具有抗病毒、抗炎、抗变态反应、免疫调控等作用。以往甘草甜素在抗肿瘤方面研究较多,近期有研究显示其在脑损伤保护方面发挥重要作用[6]。动物研究显示在大鼠脑缺血前给予甘草甜素可显著降低大鼠脑组织含水量以及氧化应激指标水平[7]。Luo等[8]研究显示,大鼠脑缺血后给予甘草甜素能够抑制中性粒细胞浸润和炎性细胞因子的活化浸润,进而发挥脑保护作用。Zhang等[9]研究显示甘草甜素能够抑制TLR-4介导的炎症反应,进而抑制NF-κB炎症通路,发挥抗炎作用保护脑组织。以上研究均表明甘草甜素可保护脑组织,但目前在SAH血脑屏障中研究不多,本研究通过制备SAH大鼠并给予甘草甜素治疗,以期探究其作用机制。
改良Garcia评分在SAH后神经功能评价方面应用较多,主要从大鼠的姿势反射能力、活动能力、肢体协调能力等方面进行评价神经功能,本研究结果显示模型组大鼠神经行为学评分降低,治疗后大鼠神经行为学评分升高,表明模型组大鼠制备成功,SAH后神经功能受损,给予甘草甜素后能够降低神经功能损伤。进一步研究显示模型组大鼠脑含水量于给药后24、48、72 h升高,EB含量升高,而给予治疗后以上指标均降低,说明模型组大鼠出现脑水肿,且血脑屏障通透性增加。伊文氏蓝进入血管后与蛋白结合,一般正常状态下不能穿过血脑屏障,因此当血脑屏障通透性升高时伊文氏蓝含量升高[10]。脑水肿为SAH常见病理特征之一,也是导致患者不良预后的重要原因,脑水肿发生的主要原因为血脑屏障遭到破坏。本研究结果显示模型组血脑屏障遭到破坏,导致通透性增加,造成脑水肿,提示保护SAH后血脑屏障的完整,可减轻脑损伤,这可能为SAH的治疗方向。
血脑屏障主要由内皮细胞、星形胶质细胞、基底膜等组成,是脑内毛细血管内皮细胞彼此紧密连接,同时与周围的周细胞、星形胶质细胞等相互作用而形成的屏障系统,其中内皮细胞及其紧密连接是决定血脑屏障通透性的关键屏障,当内皮细胞紧密连接遭到破坏后就会导致血脑屏障破坏,进而引发大脑内环境不稳定,损伤中枢神经系统[11]。本研究电镜结果显示模型组内皮细胞壁受损,内皮细胞紧密连接开放,而经药物处理后内皮细胞紧密开放程度有所降低,提示SAH后出现血脑屏障损伤主要由于细胞紧密连接遭到破坏造成的,而经过药物治疗后有明显好转,说明大脑皮层细胞间紧密连接破坏是可逆的。以往临床研究证实SAH后会引发短暂脑出血,同时启动大脑细胞凋亡,造成血脑屏障破坏[12]。本研究Tunel染色结果显示模型组大脑皮层细胞出现大量凋亡,Bcl-2蛋白表达降低,Bax蛋白表达升高,而经甘草甜素处理后细胞凋亡率降低,Bax蛋白表达降低,Bcl-2蛋白表达升高,表明甘草甜素可降低细胞凋亡,进而保护脑组织。为进一步明确SAH后血脑屏障通透性升高的机制,对细胞紧密蛋白进行检测,结果显示ZO-1、occludin、claudin-5蛋白表达降低,而给予甘草甜素治疗后紧密蛋白表达明显升高,说明血脑屏障通透性增高与紧密连接蛋白表达异常有关。
炎症反应在SAH发病中占有重要作用。Shao等[13]研究发现SAH患者血清中NF-κB水平明显升高,介导的炎症反应则会推动SAH的进一步发展。动物研究显示SAH严重程度与机体中IL-6、IL-1β、TNF-α等炎症指标浓度明显相关[14]。You等[15]研究显示在SAH大鼠模型中通过抑制炎症介质以及NF-κB信号通路能够缓解SAH引发的脑损伤。本研究显示模型组 IL-1β、 IL-6、TNF-α水平升高,而经甘草甜素治疗后以上指标均降低,提示甘草甜素保护脑组织可能与抑制炎症反应有关。COX-2、iNOS为参与细胞炎性反应的重要活性酶,在脑水肿、脑缺血中的研究均显示COX-2、iNOS表达明显升高[16]。与此一致,本研究显示模型组中COX-2、iNOS表达均升高,而给予治疗后COX-2、iNOS表达降低,表明甘草甜素可抑制炎症反应活性酶,避免炎症因子水平的升高而导致的神经损伤。
氧化应激反应在SAH脑损伤中也扮演着重要角色。有关研究显示SAH大鼠在给予还原剂后能够抑制MDA、活性氧等产生,且能够增加GSH-Px浓度,提示可通过抗氧化途径来治疗SAH[17]。本研究结果显示模型组3-NT、8-OHDG、MDA水平升高,SOD、GSH-Px水平降低,而经甘草甜素治疗后以上指标均得到明显改善,推测甘草甜素对脑损伤的保护可能是通过抗氧化来实现,这与以往的研究结论相符合[18,19]。3-NT、8-OHDG、MDA为蛋白质、DNA、磷脂损伤的重要标志[20],给予甘草甜素治疗后以上指标均降低提示抗氧化是甘草甜素在SAH后发挥脑保护的潜在作用机制。SAH氧化应激反应后往往会造成血管内皮以及血管平滑肌损伤,ICAM-1、VCAM-1在脑损伤炎症反应中发挥重要作用,多项研究均显示脑缺血后ICAM-1、VCAM-1水平升高可导致白细胞、内皮细胞黏附,浸润至血管外脑实质,导致缺血后炎症反应放大[21,22]。本研究显示模型组ICAM-1、VCAM-1水平升高,给予治疗后二者水平均降低,表明抑制ICAM-1、VCAM-1表达后能够降低脑损伤。
综上所述,甘草甜素能够改善大鼠蛛网膜下腔出血后的血脑屏障通透性,缓解基底动脉血管痉挛以及内皮细胞紧密连接,同时抑制炎症反应、氧化应激反应,但其精确作用机制与信号通路仍需进一步深入探究。本研究仍存在一定的缺陷,SAH模型可能会受到其他因素的干扰,并不能精确模拟人类SAH出现的脑组织损伤,因此仍需制备更好的SAH模型,来深入研究SAH的发病机制。

