miR-155在TGF-β1诱导足细胞损伤中的表达及其与synaptopodin、CD2AP表达的相关性①
郑心彤 凌霄雁 古贤君 林 栩 黄海庭 吴好好 钟秋红 尤燕舞 唐奇燎
(右江民族医学院附属医院,百色533000)
足细胞锚定在肾小球基底膜上,维持着肾小球的结构,是肾小球滤过膜的重要组成部分。足细胞数量减少、结构及功能异常可导致蛋白尿并最终发展为肾小球硬化,参与了许多肾脏疾病发生发展的过程。微小RNA(MicroRNA,miRNA)是一种内源性小分子非编码RNA,其生物学效应的发挥,主要是通过与靶基因3′非翻译区结合,从而实现对靶蛋白的调节。生物信息学研究结果表明,人类miRNA的靶基因至少有上千个,而受miRNA调控的靶基因更是达五千多个,广泛参与了机体生理、病理调控的各个过程[1]。Dicer敲除小鼠模型中,小鼠出现大量蛋白尿和严重的肾损害,足细胞骨架蛋白发生改变,这使学者们注意到miRNA与足细胞间的关系[2]。
本研究采用转化生长因子(Transforming growth factor,TGF)-β1诱导足细胞构建细胞损伤模型,通过建立不同浓度、不同时间梯度TGF-β1干预组,检测各组足细胞损伤标志物synaptopodin、CD2AP的mRNA、蛋白表达以及足细胞中miR-155的表达变化,从而探索miR-155与足细胞损伤之间的关系。
1 材料与方法
1.1材料 肾小球足细胞株(MPC5)购于上海复旦大学细胞中心,RPMI1640 培养基(美国Gibco)、胎牛血清(中国Cellmax)、重组人TGF-β1(美国PeproTech)、synaptpotodin抗体(21064-1-AP)、CD2AP抗体(51046-1-AP)、GAPDH抗体(10494-1-AP)(美国Proteintech),磷酸酶抑制剂混合物、蛋白酶抑制剂混合物(北京康为世纪),BCA蛋白定量试剂盒(中国碧云天公司),RNAiso Plus RNA提取试剂盒(9108)、SYBR Premix Ex TaqTMII(RR820A),PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047A),(日本TaKaRa),Mir-X miRNA First Strand Synthesis Kit (638315,美国clontech),PCR引物合成(大连宝生物工程有限公司),引物序列见表1(miR-155引物序列为其专利,U6引物由clontech试剂盒提供,均不提供具体碱基序列),CCK8 试剂盒(日本同仁化学研究所)。
1.2方法
1.2.1足细胞培养 培养方法参照本课题组的前期研究,并稍作修改[3]。细胞在含10%胎牛血清的RPMI1640培养液,于37℃、5%CO2环境中传代培养。2~3 d换液 1 次。细胞融合至80%左右消化传代,14 d左右分化成熟后用于相关实验。
1.2.2TGF-β1处理及分组 细胞传代后,以0.4~1×105个细胞种于6孔板中,待各组细胞融合至60%~70%后用含1%胎牛血清的 RPMI1640 培养液同步化24 h不同浓度TGF-β1作用72 h分组:0 ng/ml组、4 ng/ml组、8 ng/ml组、12 ng/ml组。12 ng/ml TGF-β1作用不同时间分组:0 h组、24 h组、48 h组、72 h组。提取总RNA、总蛋白。
1.2.3CCK8法检测细胞增殖 将各组细胞按 1×104个/孔接种于96孔板,每孔终体积为100 μl,每组设3个复孔,同时设置空白孔。24 h待细胞贴壁以后更换原培养液,向培养板各组细胞加入相应浓度梯度含TGF-β1的培养液。在培养箱中孵育到各自时间点后,每孔加入10 μl CCK8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定450 nm处的吸光度(OD)。细胞存活率=[(实验组OD值-空白组OD值)÷(对照组OD值-空白组OD值)]×100%。
1.2.4Real-time RT-PCR检测 按照说明用 RNAiso Plus提取各实验组小鼠足细胞的总RNA。经紫外分光光度计测定OD260、OD280及RNA浓度、琼脂糖凝胶电泳检测RNA完整性。取1μg总RNA反转录合成cDNA,具体操作按照试剂盒说明书进行。使用LightCycler®96 实时荧光定量PCR仪进行检测。选取GAPDH和U6作为mRNA和miRNA的内参,检测miR-155、U6、synaptopodin、CD2AP、GAPDH的mRNA表达。以2-ΔΔCT法计算相对表达量,ΔΔCT=(CT实验组目的-CT实验组内参)-(CT对照组目的-CT对照组内参)。
1.2.5Western blot法检测 收集处理好的各实验组足细胞,提取总蛋白。以二喹啉甲酸法测定蛋白浓度,取30~50 μg蛋白加入5×SDS上样缓冲液煮沸变性后,于十二烷基硫酸钠聚丙烯酰胺凝胶电泳,300 mA恒流湿转至PVDF膜,封闭液室温封闭1 h,分别加入一抗稀释液稀释的synaptopodin(1∶500)、CD2AP(1∶500)、GAPDH(1∶2 000)抗体,4℃孵育过夜,洗涤3次,加入相应的抗兔IgG-HRP二抗,室温孵育1 h,洗涤3次,增强化学发光(ECL)显影,利用Image J软件进行半定量分析,以目的条带与同个样品GAPDH灰度值的比值表示相对光密度值。
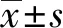
表1 实时荧光定量PCR引物序列
Tab.1 Primers of qRT-PCR

NameForward primer(5′-3′)Reverse primer(5′-3′)SynaptopodinGCTCGAATTCCGATGCAAATAAACCAGGCCACAGTGAGATGTGAAGACD2APAGGAATTCAGCCACATCCACACGATCAATTCCAGTTCGTCCTCGAPDHTGTGTCCGTCGTGGATCTGATTGCTGTTGAAGTCGCAGGAG
2 结果
2.1TGF-β1干预对体外培养的小鼠足细胞增殖活性的影响 不同剂量的TGF-β1(4、8、12 ng/ml)作用于足细胞,干预时间为24 h时对细胞增殖活性的影响不大(P>0.05),但从48 h开始细胞存活率不同程度降低,细胞增殖活性受到抑制,差别有统计学意义(P<0.05)(图1)。
2.2TGF-β1诱导足细胞损伤对miR-155表达的影响 正常对照组中miR-155的表达量较低,使用8、12 ng/ml TGF-β1干预足细胞72 h后,miR-155表达上调,差异有统计学意义(P<0.05),而4 ng/ml组与正常对照组miR-155相对表达量差异无统计学意义(P>0.05)(表2)。使用12 ng/ml TGF-β1干预足细胞48、72 h后,miR-155表达上调,差异有统计学意义(P<0.05),而24 h组与正常对照组相比差异无统计学意义(P>0.05)(表3)。
2.3TGF-β1诱导足细胞损伤对synaptopodin、CD2AP mRNA表达的影响 与正常对照组相比,8、12 ng/ml TGF-β1干预足细胞72 h后,synaptopodin、CD2AP mRNA表达均下调(P<0.05)。4 ng/ml组与正常对照组synaptopodin、CD2AP mRNA表达差异无统计学意义(P>0.05)(表4)。12 ng/ml TGF-β1干预足细胞48、72 h后, synaptopodin、CD2APmRNA表达均下调(P<0.05)。当24 h组与正常对照组synaptopodin、CD2AP mRNA表达差异无统计学意义(P>0.05)(表5)。
图1 TGF-β1干预足细胞后的细胞存活率Fig.1 Cell survival rate of TGF-β1 on podocyteNote: Compared with the 0 ng/ml group,# .P<0.01.

GroupsnmiR-1550 ng/ml31.00±0.004 ng/ml31.21±0.088 ng/ml31.71±0.101)12 ng/ml32.20±0.122)
Note:Compared with the 0 ng/ml group,1)P<0.05,2)P<0.01.
2.4TGF-β1诱导足细胞损伤后对synaptopodin、CD2AP蛋白表达的影响 与正常对照组相比,8、12 ng/ml TGF-β1干预足细胞72 h后,synaptopodin、CD2AP蛋白表达均下调(P<0.05),4 ng/ml组与正常对照组synaptopodin、CD2AP蛋白表达差异无统计学意义(P>0.05)(图2)。12 ng/ml TGF-β1干预足细胞48、72 h后,synaptopodin、CD2AP 蛋白表达均下调(P<0.05),24 h组与正常对照组synaptopodin、CD2AP 蛋白表达差异无统计学意义(P>0.05)(图3)。
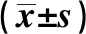
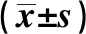

GroupsnmiR-1550 h31.00±0.0024 h31.07±0.1648 h31.29±0.051)72 h32.00±0.062)
Note:Compared with the 0 h group,1)P<0.05,2)P<0.01.
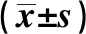
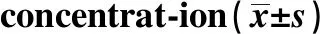
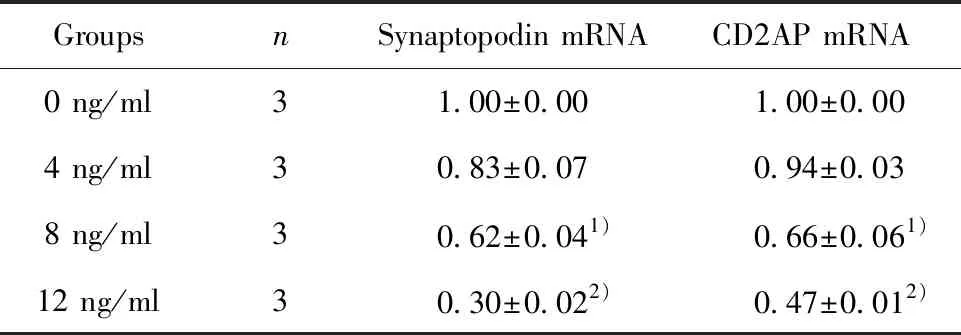
GroupsnSynaptopodin mRNACD2AP mRNA0 ng/ml31.00±0.001.00±0.004 ng/ml30.83±0.070.94±0.038 ng/ml30.62±0.041)0.66±0.061)12 ng/ml30.30±0.022)0.47±0.012)
Note:Compared with the 0 ng/ml group,1)P<0.05,2)P<0.01.
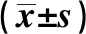


GroupsnSynaptopodin mRNACD2AP mRNA0 h31.00±0.001.00±0.0024 h30.78±0.100.78±0.1248 h30.60±0.081)0.63±0.041)72 h30.30±0.012)0.47±0.012)
Note:Compared with the 0 h group,1)P<0.05,2)P<0.01.
2.5Pearson相关分析 不同浓度、不同时间TGF-β1干预足细胞,synaptopodin蛋白与mRNA表达呈正相关,相关系数r分别为0.921、0.941,CD2AP蛋白与mRNA表达呈正相关,相关系数r分别为0.753、0.879,差异均有统计学意义(P<0.01)(图4)。不同浓度、不同时间TGF-β1干预足细胞,synaptopodin蛋白与miR-155表达呈负相关,相关系数r分别为-0.907、-0.962;CD2AP蛋白与miR-155表达呈负相关,相关系数r分别为-0.794、-0.819,差异均有统计学意义(P<0.01)(图5)。不同浓度、不同时间TGF-β1干预足细胞,synaptopodin mRNA与miR-155表达呈负相关,相关系数r分别为-0.985、-0.925,CD2AP mRNA与miR-155表达呈负相关,相关系数r分别为-0.963、-0.832,差异均有统计学意义(P<0.01)(图6)。

图2 不同浓度TGF-β1干预足细胞对synaptopodin、CD2AP 蛋白表达的影响Fig.2 Effects of TGF-β1 on synaptopodin,CD2AP protein expression in podocyte at different concentrationNote: A.Western blot;B.A summary graph for the densitometry values of the target protein.Compared with the 0 ng/ml group,*.P<0.05,#.P<0.01.
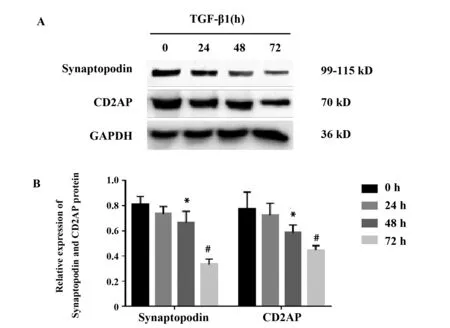
图3 TGF-β1干预足细胞不同时间对Synaptopodin、CD2AP 蛋白表达的影响Fig.3 Effects of different times of TGF-β1 on synaptopodin,CD2AP protein expression in podocyteNote: A.Western blot;B.A summary graph for the densitometry values of the target protein.Compared with the 0 h group,*.P<0.05,#.P<0.01.
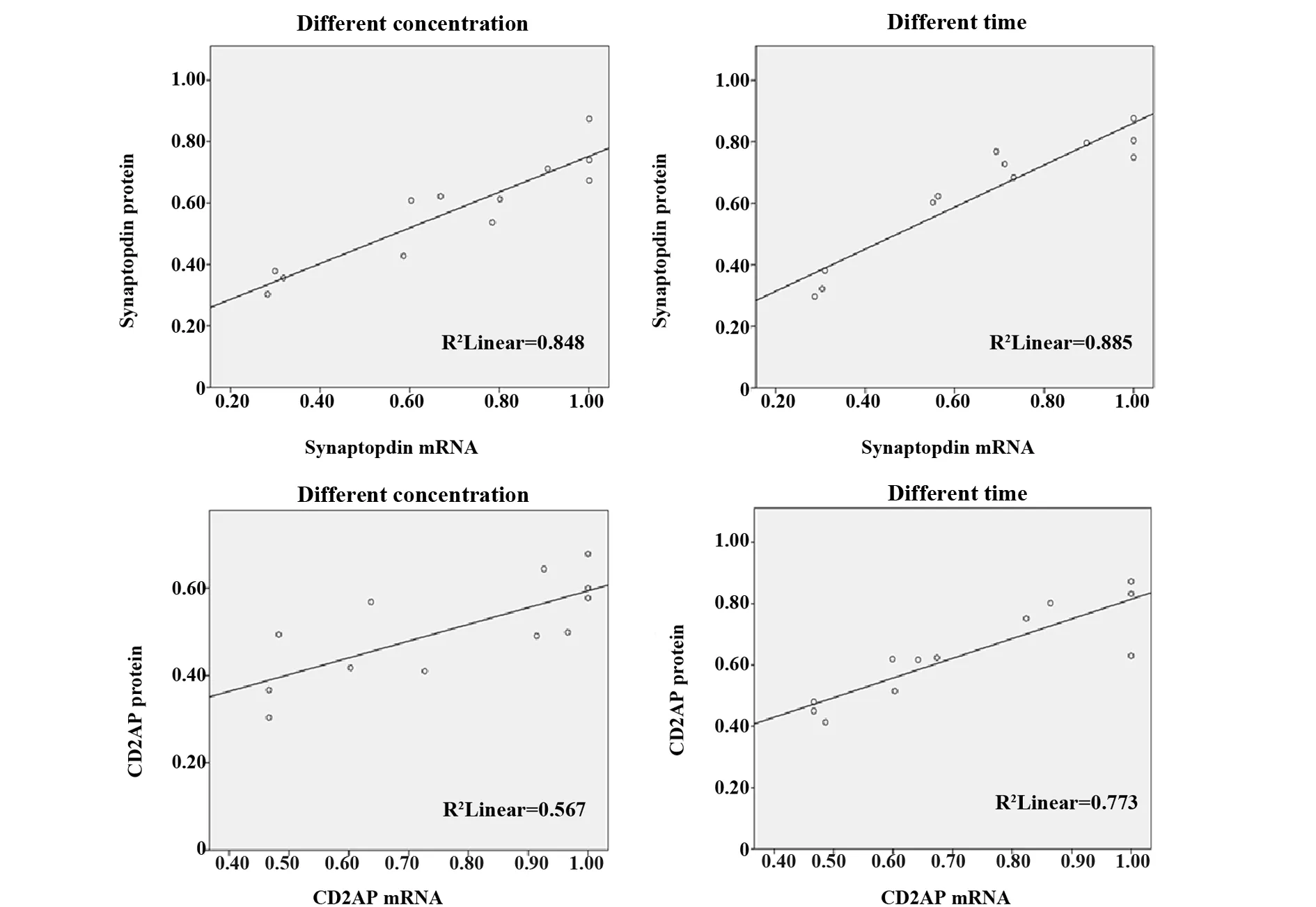
图4 Synaptopodin、CD2AP蛋白和mRNA的相关性Fig.4 Correlation between synaptopodin,CD2AP protein and mRNA
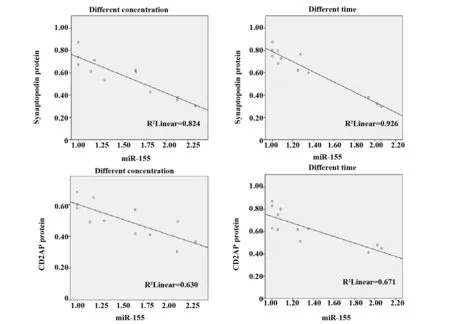
图5 Synaptopodin、CD2AP蛋白和miR-155的相关性Fig.5 Correlation between synaptopodin,CD2AP protein and miR-155
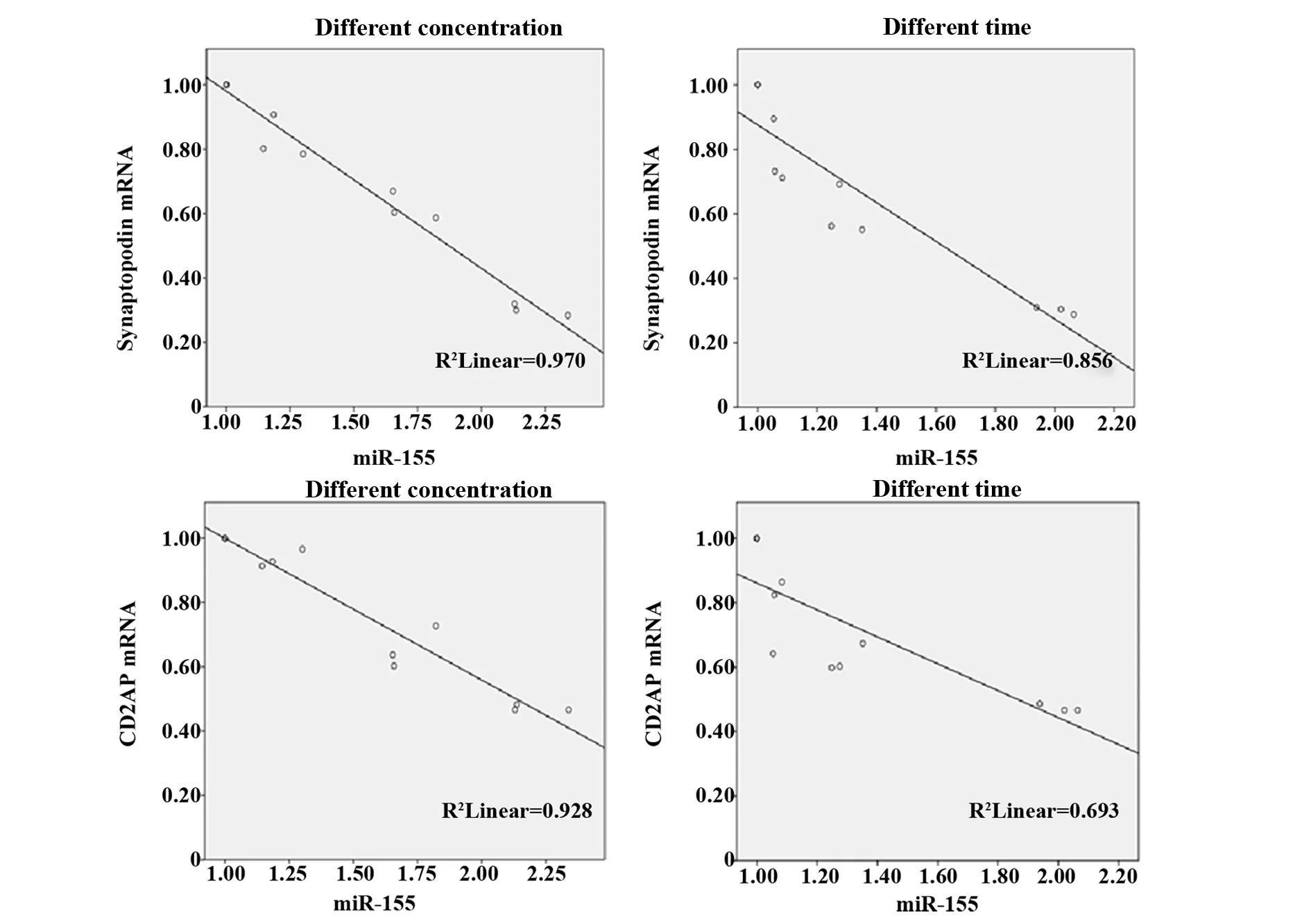
图6 Synaptopodin、CD2AP mRNA和miR-155的相关性Fig.6 Correlation between synaptopodin,CD2AP mRNA and miR-155
3 讨论
足细胞是肾小球滤过膜的重要组成部分,许多肾脏疾病均出现不同程度的足细胞损伤[4]。骨架蛋白功能和结构的改变,是足细胞损伤的中心环节。TGF-β1是足细胞损伤常见的炎症因子之一,参与了肾脏疾病肾小球硬化的过程,在体外培养的足细胞损伤模型中被广泛应用。TGF-β1损伤足细胞的过程与核因子kappa-B、磷酸肌醇3激酶-蛋白激酶B、丝裂原活化蛋白激酶等通路的激活有关[5,6]。本研究使用TGF-β1构建足细胞损伤模型,对其具体机制进一步探究。使用不同浓度、不同时间梯度的TGF-β1干预足细胞并采用CCK8法检测其增殖活性,结果显示,一定浓度的TGF-β1可抑制足细胞增殖,从而降低细胞存活率,这与我们课题组之前的研究结果一致[7]。
成熟的miRNA可通过促进降解或抑制翻译在转录后调节靶mRNA的表达水平,广泛参与了细胞增殖凋亡、人体病理生理以及疾病发展预后等过程。由于尿液中的miRNA被包裹在囊泡中表达相对稳定,这使得miRNA有望成为新的诊断标志物[8]。近年来,越来越多的研究表明miRNA与肾脏疾病发生发展的过程密切相关[9,10]。此外,在第十一届国际足细胞会议中,许多学者对足细胞中miRNA的重要作用做出总结,有学者检测到膜性肾病患者的足细胞中存在多种特异性miRNAs,糖尿病患者足细胞中miR-146a的差异表达与免疫系统失调密切相关;新月体性肾炎患者的足细胞中miRNA92a表达上调并调控足细胞中细胞周期调节因子p57最终导致细胞静止,miRNA92a靶基因之一转录激活子3也在多种肾小球疾病中表达上调[11]。众多miRNA中,miR-155和miR-146与免疫应答关系密切,也是研究最多的[12]。然而,miR-155在肾脏疾病中作用的研究较少。有研究显示,与健康对照组相比,狼疮肾炎患者的肾脏组织中miR-155的表达上调[13]。本课题组前期的研究发现,肾小球疾病患者出现了足细胞损伤及miR-155表达上调,miR-155敲除小鼠模型中足细胞标志蛋白Nephrin乙酰化,肾脏损害减轻,这表明miR-155在足细胞损伤过程中发挥重要作用,可能是肾脏疾病足细胞损伤诊断和治疗的潜在靶点[14]。然而miR-155在TGF-β1诱导的足细胞损伤中表达如何变化及其可能的分子机制仍不明确。本研究,我们采用Real-time RT-PCR检测miR-155的相对表达量,发现在TGF-β1诱导足细胞损伤模型中,miR-155的表达水平上调,并且在一定范围内呈剂量、时间依赖性,这提示我们,miR-155可能参与了TGF-β1诱导足细胞损伤的过程。
synaptopodin是分化成熟足细胞的骨架蛋白之一,和紧密连接蛋白MAGI-1一起与动蛋白微丝紧密相连,可将足细胞肌动蛋白骨架从活动性转变为收缩性,维持足细胞的功能结构,稳定肾小球滤过[15]。synaptopodin表达变化将影响足细胞的生理功能,改变肾小球滤过膜的通透性并导致蛋白尿。CD2AP衔接着T细胞和抗原呈递细胞,发现时被认为是免疫分子又被称为“免疫突触”,而后证实CD2AP在多种组织中均有表达,在肾脏中主要分布于足细胞,包埋在足细胞裂孔隔膜的脂筏中[16]。CD2AP不仅在足细胞结构和功能的维持中发挥重要作用,还维持着免疫系统稳定。当synaptopodin、CD2AP表达发生变化,意味着足细胞的结构和功能改变。然而在TGF-β1诱导的足细胞损伤模型中,synaptopodin和CD2AP表达如何变化及其与足细胞中miR-155表达变化的关系,至今未见报道。本研究结果证实,TGF-β1诱导足细胞损伤的过程中,synaptopodin和CD2AP mRNA和蛋白的表达均下调,并且在一定范围内呈剂量、时间依赖性,这与先前的理论、研究以及预测的实验结果相一致,TGF-β1成功诱导构建了足细胞损伤模型。通过Pearson相关分析我们发现,synaptopodin、CD2AP的mRNA和蛋白表达呈正相关且均与miR-155的表达呈负相关,这充分说明了miR-155的表达水平可能与足细胞的损伤程度有关。
足细胞结构完整和功能正常对维持肾脏生理功能至关重要,miR-155广泛调控基因表达,其靶基因与足细胞损伤的多条信号通路相关[17]。我们的研究发现TGF-β1诱导足细胞损伤使足细胞增殖抑制,synaptopodin、CD2AP mRNA和蛋白表达下调,miR-155表达上调,miR-155可能是参与TGF-β1诱导足细胞损伤的重要因子,对肾脏疾病发病机理的研究至关重要。然而,miR-155在足细胞损伤中的具体机制有哪些,在临床肾脏疾病的防治中如何运用,我们课题组将进行更深入地研究。

