棉花诱变种质Gh14-3-3L基因的Eco-TILLING分析
叶春秀,王志军,赵曾强,庄振刚,马盼盼,杨永林
(1.新疆农垦科学院/作物种植创新与基因资源利用兵团重点实验室,新疆 石河子 832000;2.新疆农业大学,新疆 乌鲁木齐 830000;3.石河子农业科技开发研究中心棉花研究所,新疆 石河子 832000)
【研究意义】TILLING 技术作为反向遗传学技术之一,已在部分主要作物种质创新过程中得到了广泛的应用,已成功地应用于小麦[1-3]、玉米[4-5]、花生[6-7]、水稻[8-9]、向日葵[10]、大豆[11-12]、高粱和油菜[13-16]等作物的育种及功能基因组学研究中,取得了不少研究成果,并且建立了相关的 TILLING育种技术平台。快速鉴定突变种质是TILLING技术应用过程中的一个重要步骤,传统的鉴定方法较为繁琐且费用昂贵。【前人研究进展】Eco-TIllING技术是通过 TILLING 技术去找寻自然群体中等位基因变异的技术,在生物基因多态性的检测上较为直观与直接,在拟南芥[17]、大麦[18]、小麦[19]等多种植物中得到广泛应用[20-21]。【本研究切入点】棉花作为主要的经济作物之一,TILLING 技术的应用与其它作物育种相比有所欠缺[22-23],将后基因组时代的相关技术应用到棉花育种过程中将是一个必然的发展趋势和方向,TILLING 技术在棉花育种中是否存在着相同的应用价值及应用过程中存在的关键性问题,值得深入研究。【拟解决的关键问题】本文拟在通过对前期采用TILLING技术创制的棉花种质资源进行表型性状和分子生物学水平的鉴定,验证TILLING技术在棉花种质创新方面应用的可行性,并探索应用过程中的关键步骤,为深入有效、稳定利用该技术创制棉花种质资源提供理论依据。
1 材料与方法
1.1 实验材料
本实验所用材料为前期采用化学诱变剂处理获得的后代材料,目前已经成为基本稳定的材料,共计4份材料,包括1份对照材料(用石引对照表示),3份不同剂量诱变剂处理后的后代材料(分别用石引150、石引200、石引250表示)。
1.2 CELI酶的提取
CELI酶的提取采用蛋白质提取试剂盒进行,具体方法参照相应的说明书,如下:①在1 mL蛋白提取裂解液中加入适量蛋白酶抑制剂和PMSF(苯甲基磺酰氟);②取100 mg新鲜芹菜嫩叶或茎秆组织放入研钵中,并在液氮环境中碾碎;③将碾碎后的芹菜嫩叶或茎秆组织,加入步骤1混合而成的裂解液中,在4 ℃温度条件下裂解20~30 min;④在4 ℃温度条件下,10 000 r/min,离心30 min,吸取上清液,即得CELI酶粗提液,提取物分装保存于-80 ℃超低温冰箱备用。
1.3 CELI酶的活性检测
以标准酶SURVEYOR Mutation Detection Kit Components为对照,用提取的CELI酶对扩增的Control C和Control G异质双链DNA分子进行酶切,比较提取的CELI酶粗提液与SURVEYOR酶的酶切效果,具体验证步骤:①对SURVEYOR Mutation Detection Kit Components中的Control C和Control G(with primers)在最佳退火温度下进行PCR扩增,20 μl PCR体系包括10×Taqbuffer 2 μl,2.5 mM dNTPs 2 μl,Control C/Control G(with primers)2 μl,E×Taq(5 U/μl)0.2 μl,DNA模板2 μl,ddH2O 12.8 μl。PCR扩增程序为95 ℃ 2 min;94 ℃ 50 s,55 ℃ 45 s,72 ℃ 50 s,32个循环;72 ℃ 7 min;4 ℃保存。②取4 μl PCR扩增产物进行1 %琼脂糖凝胶电泳检测,确保扩增产物单一且浓度适宜后进行异质双链的合成,分别取Control C和Control G(with primers)的PCR扩增产物各10 μl,经过表1所示的PCR扩增程序,获得碱基错配的异质双链DNA分子。③以SURVEYOR酶为对照,用本实施例提取的CELI酶粗提液对异质双链产物进行酶切,酶切温度45 ℃,酶切时间40 min,酶切体系为10 μl异质双链DNA分子 + 8 μl ddH2O + 2 μl SURVEYOR/CELI酶粗提液。④酶切结束后,加入2 μl的6×loading Buffer在2 %的琼脂糖凝胶电泳上进行酶切效果检测,比较分析本实施例提取的CELI酶粗提液与SURVEYOR Mutation Detection Kit Components中SURVEYOR酶的酶切效果。

表1 碱基错配异质双链形成PCR扩增程序
1.4 基因组DNA的制备
从每份材料中随机选取10份单株进行基因组DNA的提取,采用CTAB法进行提取,用核酸检测仪进行DNA质量和浓度的检测。
1.5 棉花纤维发育相关基因序列查找及引物设计
根据连续3年(2015-2017)的纤维测量数据发现4份材料在纤维长度上存在较明显的差异,参照棉花纤维发育相关基因文献选取了6个与纤维发育相关的基因序列进行引物设计,用于实验验证,具体序列如表2。
1.6 棉花纤维发育相关基因Eco-Tilling分析
将提取的对照和突变体材料基因组DNA进行稀释,使浓度保持一致,然后进行基因PCR扩增,扩增体系为20 μl,包括10×PCR Buffer 2 μl,2.5 mM dNTPs 2 μl,引物各1 μl,E×Taq(5 U/μl)0.2 μl,DNA模板2 μl,ddH2O 12.8 μl。PCR扩增程序为95 ℃ 2 min;94 ℃ 50 s,55 ℃ 45 s(根据各引物退火温度进行设置),72 ℃ 50 s,32个循环;72 ℃ 7 min;4 ℃保存 。

表2 纤维发育相关基因引物序列
PCR程序结束后,取5 μl产物进行琼脂糖(浓度为2 %)电泳检测,确定在对照和诱变材料上所得到的产物都为单一、特异性条带;然后分别取对照和诱变材料PCR产物,按照等体积(各10 μl)进行混合,在PCR仪上进行PCR产物的杂交,形成错配异质链,杂交程序为99 ℃ 2 min,99 ℃降至72 ℃ (-1 ℃/s),72 ℃降至25 ℃(-0.3 ℃/s),4 ℃保存。
将异质链采用提取的CELI酶进行酶切,酶切体系为:2 μl错配异质链,2 μlCELI酶,8 μl ddH2O。酶切程序为45 ℃保持30~60 min,酶切产物采用4 %的琼脂糖凝胶电泳进行分析。
1.7 棉花纤维发育相关基因测序验证
将经过酶切后能够产生酶切条带的基因PCR产物进行载体连接、转化、涂板和初步验证后,连接正确菌液送测序公司测序,对照和诱变材料相应基因各送5个重复菌液。
1.8 测序数据分析
对从测序公司获得的序列数据采用软件DNAMAN进行比对,确定诱变材料与对照相应基因序列之间的差异碱基类型及位置,与前期酶切结果进行比较。
2 结果与分析
2.1 芹菜CELI酶的提取及其活性验证
由图1可以看出,采用蛋白质提取试剂盒能够从芹菜的不同组织中获得与预期大小一致的CELI条带,并且从嫩叶中提取的酶较茎中提取的效果好,为后期的实验开展提供了借鉴。通过与购买的试剂盒内标准的CELI酶类进行酶切效果及活性实验对比,发现从芹菜中提取的CELI酶同样能够达到预期的酶切效果(图2),说明提取的CELI能够替代试剂盒中的类似酶,用于后期的试验降低了实验成本。

图1 CELI酶提取的SDS-PAGE考马斯亮蓝染色图Fig.1 SDS-PAGE ofCELI enzyme
2.2 棉花纤维发育相关基因Eco-Tilling分析结果
从酶切电泳图和测序结果分析得到,在选取设计的6个与棉花纤维发育相关的基因中,其中4对引物能够扩增得到单一、特异性的条带(图3A),4对引物中最终只有2对引物扩增基因在材料间存在着SNP差异(图3B),分析测序结果证明引物L-D-1F/1R扩增基因在材料间存在着SNP差异,比对结果显示该基因为纤维相关基因Gh14-3-3L,其中扩增产物在石引150与对照材料存在1个SNP位点差异,位于320 bp处(插入1个碱基T),测序验证得到2条条带(分别为320和453 bp);石引200与对照材料存在2个SNP位点,分别位于320和380 bp处(320 bp处插入1个碱基T,380 bp处碱基T变为G),测序验证得到3条条带(分别为320、60和393 bp);石引250与对照存在1个SNP位点,位于320 bp处(插入1个碱基T),测序验证得到2条条带(分别为320和453 bp,图4)。

图2 CELI与试剂盒Surveyor酶活性对比检测图Fig.2 The compairson chart ofCELI activity and surveyor kit
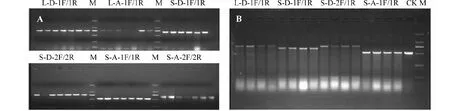
A.对照与诱变材料差异基因扩增图示;B.对照与诱变材料CELI酶酶切图示A. The figure of amplification; B. The figure of enzymatic图3 对照与诱变材料差异基因扩增及CELI酶酶切图示Fig.3 The figure of differential gene amplification andCELI enzymatic between control and mutant materials

L-1:对照材料;L-2:石引150材料;L-3:石引200材料;L-4:石引250材料L-1: Control;L-2:Shiyin150;L-3:Shiyin200;L-4:Shiyin 250图4 诱变材料与对照材料Gh14-3-3L基因核苷酸序列差异Fig.4 The nucleotide sequence compairson ofGh14-3-3Lbetween control and mutant materials
2.3 棉花纤维相关基因Gh14-3-3突变SNP位点结构分析
对Gh14-3-3进行结构分析发现,诱变获得的3份材料均在320 bp处存在1个SNP位点的改变,编码的氨基酸由半胱氨酸(C)变为亮氨酸(L),使该基因的开放阅读框发生了改变(提前终止),由编码132个氨基酸变为104个氨基酸,从而导致蛋白结构的改变(图5)。 对比对照和诱变材料Gh14-3-3L基因氨基酸与保守序列发现,开放阅读框内有1个氨基酸发生,使开放阅读框提前终止,从而改变了基因的保守序列的长短(图6)诱变材料的保守序列相对于对照材料缩短,使蛋白结构也发生了改变。
2.4 棉花纤维相关基因Gh14-3-3保守区域及结构分析
由三级结构分析可以看出,突变前后的蛋白均属于Gh14-3-3蛋白家族,突变前的蛋白结构属于该家族典型的结构,具有9个α-螺旋,而突变后的蛋白结构由于编码框长度的改变,最终变为8个α-螺旋。对照与诱变材料Gh14-3-3蛋白在亲水与疏水性方面的差异不明显,属于疏水性蛋白(图8)。

L-1:对照材料;L-2:石引150材料;L-3:石引200材料;L-4:石引250材料L-1: Control;L-2:Shiyin150;L-3:Shiyin200;L-4:Shiyin 250图5 诱变与对照材料Gh14-3-3L基因氨基酸序列差异Fig.5 The amino acid sequence compairson of Gh14-3-3L between control and mutant materials

A.诱变材料Gh14-3-3基因保守区域; B. 对照材料Gh14-3-3基因保守区域A.Mutant materials; B. Control图6 诱变与对照材料Gh14-3-3L基因保守区域分析差异Fig.6 TheGhI4-3-3Lgene conservative region comparison of mutagenic and control material

A.对照材料Gh14-3-3基因蛋白;B~C. 诱变材料Gh14-3-3基因蛋白A.Control; B-C.Mutant material图7 对照材料和诱变材料Gh14-3-3L蛋白三级结构预测Fig.7 The tertiary structure comparison of Gh14-3-3L protein between control and mutagenic material
2.5 对照与诱变材料纤维数据比较
连续3年(2015-2017)测定对照与诱变材料的纤维长度数据,发现石引200绒长数据分析与对照存在差异性,石引150和石引250绒长数据与对照没差异性,数据结果与SNP位点和测序数据存在一致性,推断可能与石引200材料SNP位点数较其它两个材料多1个有关,具体关联性待进一步验证。
3 讨 论
传统的育种手段与现代生物育种技术相比仍比较原始和落后,使育种水平的提高受到很大限制,同时,由于受到棉花品种内在和外在条件的限制,育种周期较长,制约了培育新品种的速度。因此,如何加快棉花的育种速度,是多少年来育种家一直渴望解决的问题,也是当前摆脱育种困境的关键,拟南芥TILLING[17]计划的成功实施,带动了多种作物TILLING 检测服务系统,这些专项 TILLING 计划,通过建立标准化的 TILLING技术平台,共享突变体网络数据库资源,提高了突变检测效率,降低成本,可以有效地服务于科研及企事业单位,提高TILLING 技术应用效率。随着越来越多物种基因组序列的破译,将会进一步扩大 TILLING 技术的物种检测范围及其更多的目标基因,这为TILLING 技术的广泛应用奠定了基础[5-6,8,17]。本文通过探索TILLING 技术在新疆早熟陆地棉种质创新过程中的关键问题,构建可靠的TILLING 技术体系,同时借助于这种技术筛选出一些在抗逆与品质性状方面具有利用价值的新种质,为相应的栽培品种选育及研究提供新的种质,拓展新疆棉花种质的遗传基础。
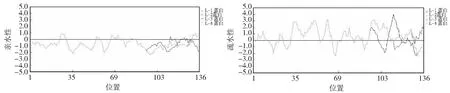
A.Gh14-3-3蛋白亲水性图示;B.Gh14-3-3蛋白疏水性图示A. The hydrophilicity of Gh14-3-3L;B. The Hydrophobicity of Gh14-3-3L图8 对照材料和诱变材料Gh14-3-3L蛋白亲疏水性Fig.8 The hydrophilicity and hydrophobicity comparison of Gh14-3-3L gene protein between control and mutant material
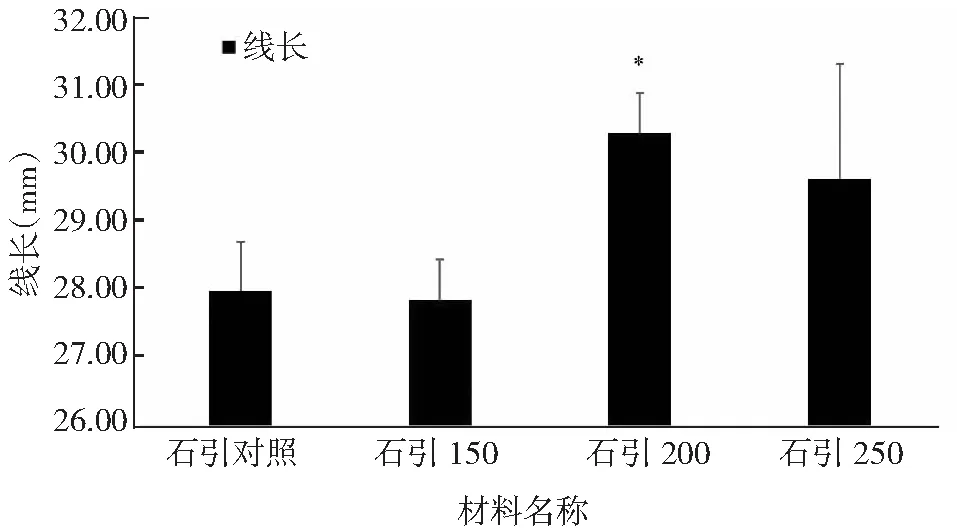
图9 对照材料和诱变材料纤维数据差异显著性分析Fig.9 The significant difference analysis of fiber data between control and mutagenic material
4 结 论
通过对前期获得诱变材料进行表型性状与分子水平的验证,发现采用获得的诱变体系和鉴定技术创制棉花种质具有可行性,所得材料在表型性状及分子水平方面都发生了变异,并且变异位点与表型性状的变异具有关联性,研究结果能够为深入研究TILLING技术在棉花及其它植物种质资源创制方面提供理论依据和技术。

