加拿大蓬挥发油通过模拟挥发和淋溶途径对豌豆保卫细胞的毒性效应及机制
王 煜,肖 杨,熊正伟,唐 雪,唐小燕,胡 莉
(1.四川师范大学生命科学学院,四川 成都 610101;2.四川师范大学细胞生物学研究室,四川 成都 610101)
【研究意义】外来入侵植物加拿大蓬(Erigeroncanadensis)[1]对周围农作物生长的抑制效应已经引起了研究者们的广泛重视[2-4]。如2003年Shaukat等[5]发现加拿大蓬不同浓度水浸提液可显著抑制番茄(LycopersiconesculentumMill.)、萝卜(RaphanussativusL.)玉米(ZeawaysL.)等6种作物种子的萌发及其根、芽的生长。高兴祥等[6]于2010年证实加拿大蓬全株水浸提物、茎叶淋溶物、根系分泌物及残体土壤分解物等均可显著抑制多种受体植物种子萌发和幼苗生长。杨莉等[7]发现多种作物的种子萌发和根、芽的生长受到加拿大蓬挥发油经挥发和淋溶途径的化感胁迫作用。这些研究主要集中于对加拿大蓬的对受体物种植株水平上不同化感胁迫效应的现象揭示,但就该现象的本质及其在细胞水平、分子水平上作用机制的研究却罕有报道。【前人研究进展】本研究室张红等[8]的前期研究发现,加拿大蓬挥发油经空气和土壤载体均可使蚕豆(VaciafabaL.)根尖细胞产生多种类型的染色体畸变,诱导微核产生,显著抑制了幼根的生长。其后的相关研究表明[9],加拿大蓬挥发油可诱导受体植物根边缘细胞死亡,从而抑制了受体植物根系的生长发育。此外,植物叶片下表皮的气孔保卫细胞也能对环境胁迫做出极为灵敏的反应[10],可以用于评价环境毒物对细胞的致死、致突变、致畸形等效应[11-13],是研究外来入侵植物产生的化感物质作用机制的良好材料。【本研究切入点】目前,加拿大蓬挥发油通过挥发、淋溶途径对周围受体植物气孔保卫细胞的毒性作用尚未见报道。【拟解决的关键问题】因此,本文拟采用受到加拿大蓬入侵危害的作物豌豆(Pisumsativum)叶片下表皮保卫细胞为受体材料,模拟挥发和淋溶两途径研究了加拿大蓬挥发油的毒性效应,并用多种抑制剂进行干扰处理,旨在明确加拿大蓬挥发油通过不同途径对豌豆保卫细胞的遗传毒害和致死效应,以期为揭示其入侵的分子机制提供相应的理论依据,并可为加拿大蓬的有效防治以及合理开发利用提供参考。
1 材料与方法
1.1 材料
加拿大蓬采自四川师范大学成龙校区内,豌豆种子为市售。
泛Caspase抑制剂Z-VAD-FMK及6种干扰剂均产自Beyotime生化试剂公司。
1.2 方法
1.2.1 材料的培养和准备 采用水蒸气蒸馏法[]提取加拿大蓬挥发油,所提取的挥发油为浅黄色透明液体,有刺鼻性气味,收集到的挥发油用无水硫酸钠干燥后得液体挥发油,使用二甲基亚砜(DMSO)为助溶剂,配制成10 %的挥发油母液,置4 ℃冰箱保存备用。
挑选颗粒饱满、无损伤的豌豆种子,蒸馏水漂洗3次,0.5 % KMnO4消毒8 min,蒸馏水洗净,25 ℃暗培养24 h,换湿纱布包裹催芽2~3 d。选取萌发状况一致的种子均匀种植于盛有营养土的花盆中(直径14 cm,高度12 cm),每隔3 d浇1次水。3~4周取平展叶片用于实验。
1.2.2 胁迫处理 挑选高度一致、叶片大小均匀、长势良好、无损伤的豌豆苗,从豌豆苗顶端取完全伸展开的叶片,用镊子在叶片上撕取长1~1.5 cm,宽0.5~1.0 cm的表皮条放入加有5 mL MES缓冲液[12]的EP管中。① 模拟挥发途径的化感胁迫处理:将表皮条平铺于滤纸条(8 cm × 0.9 cm)上,放入加有1 mL MES缓冲液的10 mL EP管内,使滤纸条浸于MES缓冲液中,分别在EP管盖上均匀涂抹挥发油母液1、2、4、8、16 μl,以仅MES缓冲液处理为CK,25 ℃光照培养箱中处理0.5 h,重复3次;② 模拟淋溶途径的化感胁迫处理:分别取挥发油母液1、2、4、8、16 μl(记为梯度1、2、3、4、5),DMSO补至16 μl后加入EP管中,25 ℃光照0.5 h,以仅MES缓冲液(CK1)和MES缓冲液加16 μl DMSO处理(CK2)为对照,重复3次。
1.2.3 缓解处理 在1.2.2的EP管中分别加入下列干扰剂:抗氧化剂AsA(0.5 mmol/L)100、200、400 μl,活性氧(Reactive oxygen species,ROS)清除剂CAT(500 U/mL)20、40、80 μl,Ca2+螯合剂EGTA(0.5 mmol/L)40、80、160 μl,Ca2+通道抑制剂LaCl3(0.5 mmol/L)20、40、80 μl,硝酸还原酶(Nitrate reductase,NR)抑制剂NaN3(0.5 mmol/L)20、40、80 μl,一氧化氮合酶(Nitric oxide synthetase,NOS)抑制剂L-NAME(0.5 mmol/L)15、30、45 μl,泛Caspase抑制剂Z-VAD-FMK(0.1 μmol/L)10、20、40 μl,预处理10 min后分别按① 和② 加入8 μl挥发油母液,以只加MES缓冲液(CK1)和MES缓冲液附加8 μl挥发油母液(CK2)为对照,重复3次。
1.2.4 细胞核形态和细胞活性检测 核形态检测:表皮条经MES缓冲液清洗后,卡诺氏液固定2 h,1 mol/L盐酸60 ℃解离8 min,蒸馏水洗3次,Schiff试剂避光染色1 h,LEICA DM300显微镜下观察拍照。每处理至少观察1000个细胞,计算核异常率。
细胞活性检测:采用马丹炜等[15]的方法稍有改进。表皮条经MES缓冲液洗3次后铺于载玻片上,AO/EB避光染色3 min,LEICA DM300荧光显微镜(徕卡显微系统公司)观察拍照。具亮红色荧光为死细胞,绿色荧光为活细胞。每处理至少观察1000个细胞,计算死亡率。
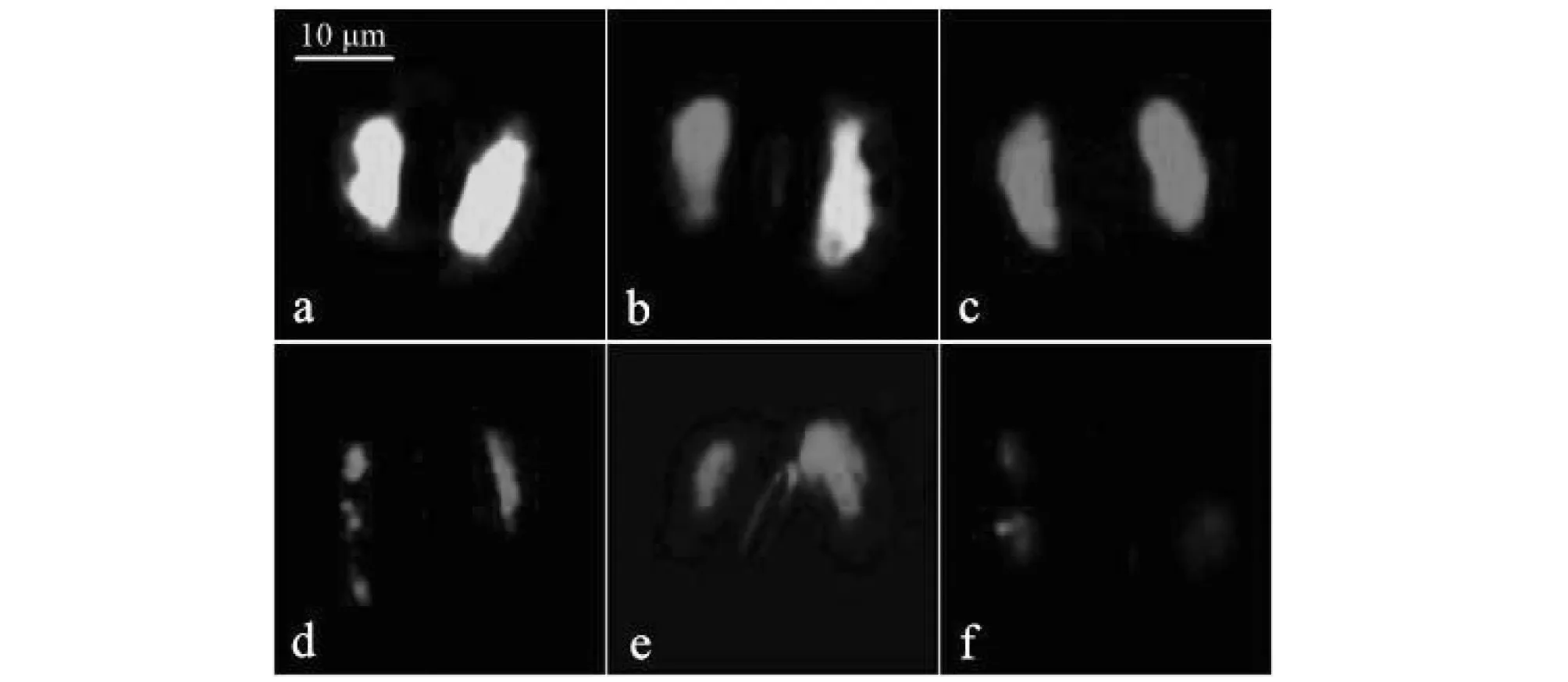
a:正常活细胞;b:单保卫细胞失活;c:双保卫细胞失活;d:核断裂和畸形;e:核固缩、迁移和畸形;f:核断裂和消失a: Normal living cells; b: Single guard cell inactivation; c: Double guard cell inactivation; d: Nuclear fracture and deformity; e: Nuclear condensation, migration and deformity; f: Nuclear breakage and disappearance图1 加拿大蓬挥发油处理后豌豆保卫细胞活性变化Fig.1 Viability changes in the guard cells ofPisum sativumexposed to volatile oil fromErigeron canadensis
1.3 数据统计与分析
数据录入和作图采用Microsoft Excel 2010,SPSS 20.00统计分析软件对数据进行单因素方差分析、Duncan法比较均值,独立样本T检验结合隶属函数法[16]比较两条途径下挥发油毒性效应的强度。隶属函数计算公式为:
物流设施主要就是指为了能够更好的开展物流工作而设置的系统以及组织等,其主要包括了物流信息管理系统、配送系统以及自动化立体仓库等诸多基础设施,在物流行业中占据着十分重要的地位。物流设备主要就是指为了能够满足物流生产作业而形成的必要操作工具,主要包括了搬运车、货架、升降机以及集装辅助件等诸多设备。
式中,U(Xi)为某处理下某指标的隶属函数值;Xi为某处理水平的某指标测定值;Xmin和Xmax分别为所有参试系中该指标的最小值和最大值。先求出不同挥发油剂量处理下的各指标隶属函数值后,求得每一指标的隶属函数均值,最后得出不同途径中各指标隶属函数的总平均值。
2 结果与分析
2.1 加拿大蓬挥发油通过不同途径对豌豆保卫细胞活性的影响
经AO/EB染色后,在荧光显微镜下,对照组豌豆保卫细胞大都能观察到亮绿色存活状态的细胞核(图1a),也有较少的保卫细胞细胞核出现死细胞的亮红色荧光。无论挥发途径还是淋溶途径,处理组中均有较多红色荧光的死亡细胞核(图1b-f),其数量具有随挥发油处理剂量增加而上升的趋势。同时也发现细胞核形态的大量畸变,如核畸形(图1d-e)、核固缩和核迁移(图1e)、核断裂(图1d,f),甚至核降解消失(图1f)等。其中细胞核固缩、断裂、降解和消失等现象是植物细胞程序性死亡(Programmed Cell Death,PCD)的特征之一。这表明加拿大蓬挥发油经不同途径对豌豆保卫细胞均具有明显的细胞毒性,可诱导豌豆保卫细胞发生核形态的大量畸变,诱发细胞死亡,推测这种细胞死亡方式属于程序性细胞死亡。
与对照组相比,加拿大蓬挥发油经不同途径处理保卫细胞后,其死亡率均显著增加(P<0.05,表1),并随着挥发油处理剂量的增加而显著升高(Pearson挥发=0.924,Pearson淋溶=0.882,P<0.01)。当挥发油剂量为16 μl时,经挥发途径处理后保卫细胞死亡率高达81.556 %,约为对照组的6倍;经淋溶途径处理的细胞死亡率高于挥发途径,达83.518 %。由此可见,加拿大蓬挥发油经挥发和淋溶途径均可对豌豆保卫细胞产生明显的细胞毒性,诱导保卫细胞死亡,并且具有剂量依赖效应。
当处理剂量相同时,加拿大蓬挥发油通过淋溶途径处理组的死亡率均显著高于挥发途径处理组(P<0.05,表1)。同时,淋溶途径处理下细胞死亡率的隶属函数均值为0.600,高于挥发途径的0.472。由此可见,在该模拟实验条件下,加拿大蓬挥发油经淋溶途径处理对豌豆保卫细胞的胁迫致死效应大于挥发途径。
2.2 加拿大蓬挥发油通过不同途径对豌豆保卫细胞细胞核形态的影响
在光学显微镜下观察Schiff试剂染色后的豌豆保卫细胞,发现对照组中正常细胞核为着色较深的半月形,形态规则,左右对称,位于保卫细胞中央(图2a)。挥发油通过不同途径处理后,豌豆保卫细胞的核形态常出现各种畸变,如核迁移(图2b,d)、核固缩(图2c,d,f)、核畸形(图2b)、核降解消失(图2d,e)等,且核畸变的发生率具有随着挥发油处理剂量增加而升高的趋势。
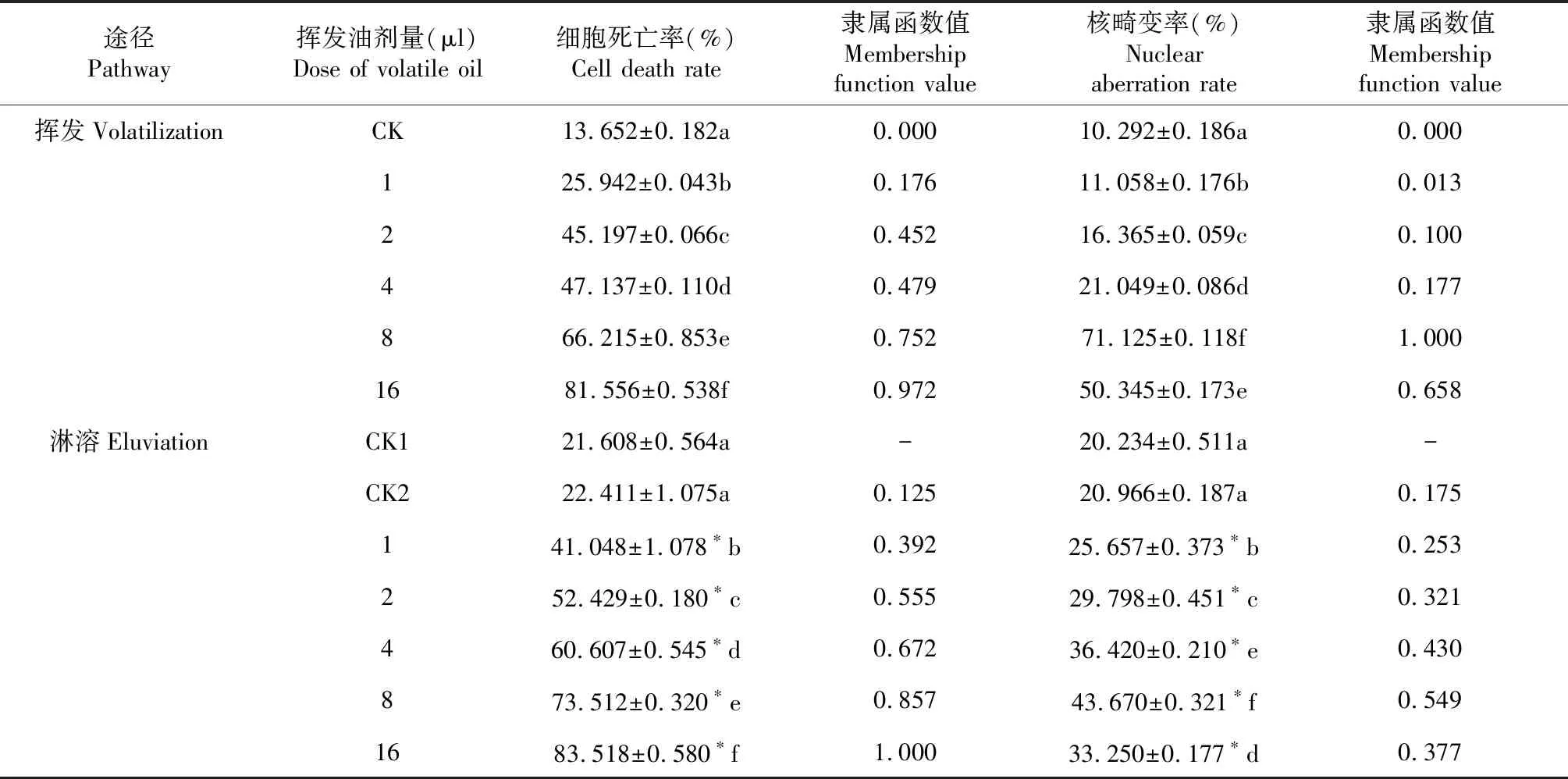
表1 加拿大蓬挥发油对豌豆保卫细胞活性和核形态的影响
注:小写字母表示同一途径不同剂量间的统计学差异;*表示挥发油剂量相同时,淋溶途径与挥发途径处理有显著差异,P<0.05,下同。
Note: Lowercase letters indicate statistical differences between different doses of the same pathway; * indicates significant difference between the eluviation and volatilization treatment when the volatile oil dose is the same,P<0.05, the same as below.
表1数据显示,加拿大蓬挥发油经2种途径处理均可导致豌豆保卫细胞核畸变率显著升高(P<0.05),并随着处理剂量增加呈先升高再降低的趋势,细胞核畸变率均在挥发油剂量为8 μl时达到最大,随后显著下降(P<0.05)。在低剂量时,淋溶途径细胞核畸变率显著高于挥发途径,当处理剂量分别为8和16 μl时反之(P<0.05)。由此可见,经不同途径加拿大蓬挥发油处理的豌豆保卫细胞,无论处理剂量的多少,均可被诱导产生多种核畸变现象。
在剂量较低时(1、2、4 μl),淋溶途径处理下挥发油诱导的蚕豆保卫细胞核畸变率显著大于挥发途径(P<0.05);剂量较高时(8、16 μl)反之。综合分析显示,淋溶途径处理下核畸变率的隶属函数均值为0.351,高于挥发途径下的0.325。这表明加拿大蓬挥发油对于保卫细胞的遗传毒性效应也具有淋溶途径强于挥发途径的特征。
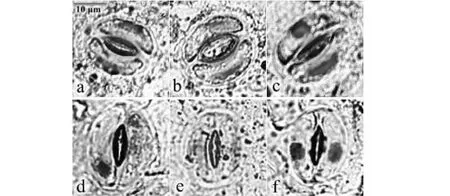
a:CK;b:核迁移和畸形;c:核固缩和畸形;d:核迁移、固缩、降解;e:核降解消失;f:核固缩a: CK; b: Nuclear migration and aberration; c: Karyopyknosis and aberration; d: Nuclear migration, karyopyknosis and degradation; e: Nuclear degradation disappeared; f: Nuclear consolidation图2 加拿大蓬挥发油作用下豌豆保卫细胞核形态的变化Fig.2 Changes in the nucleus morphology of guard cells inPisum sativumexposed to volatile oil fromErigeron canadensis
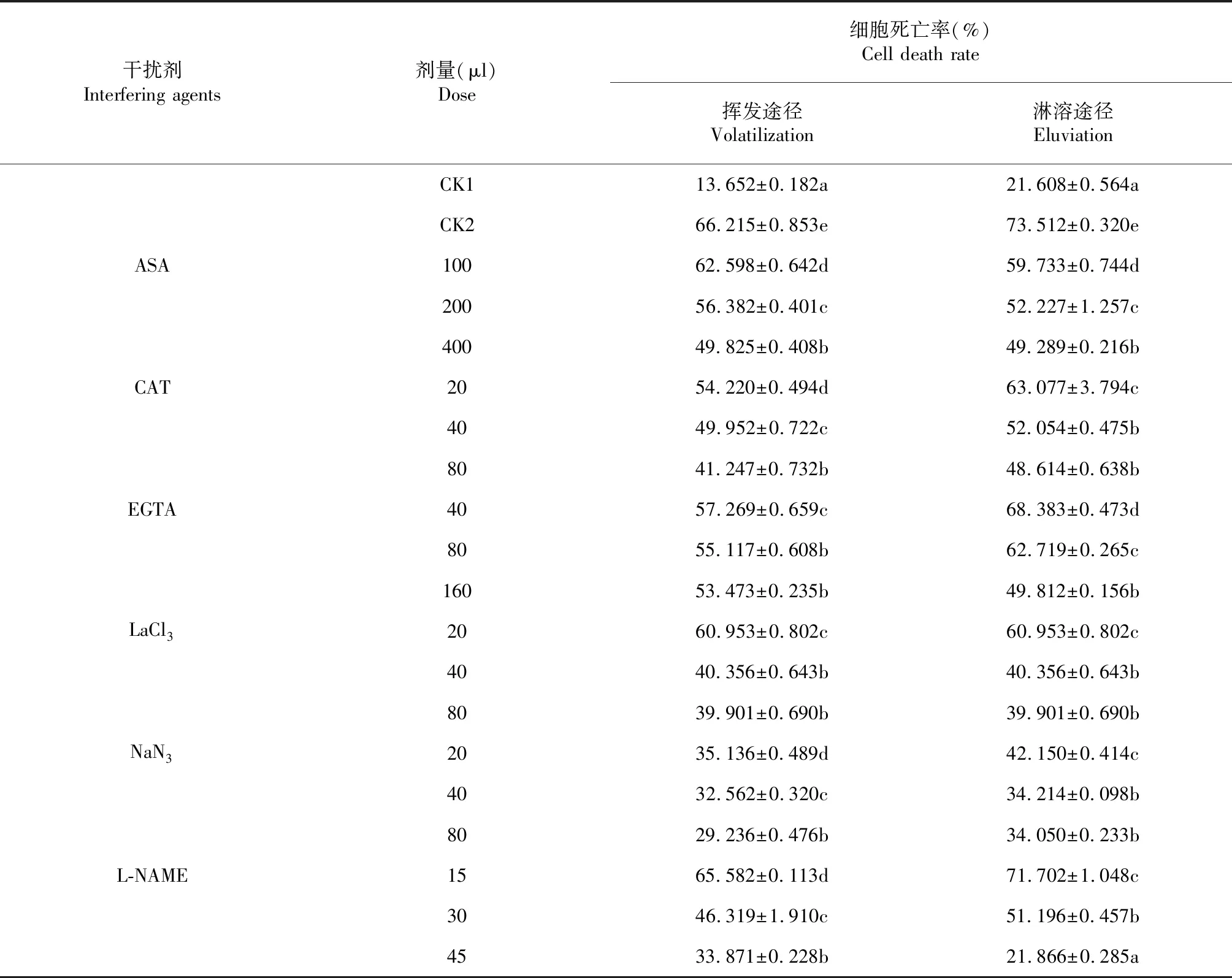
表2 AsA、CAT、EGTA、LaCl3、NaN3和L-name对加拿大蓬挥发油作用下细胞死亡的缓解效应
2.3 6种干扰剂对加拿大蓬挥发油致豌豆保卫细胞死亡的缓解效应
2.4 Z-VAD-FMK对加拿大蓬挥发油经不同途径致豌豆保卫细胞死亡的缓解效应
Z-VAD-FMK(benzyloxycarbonyl-Val-Ala-Asp-fluoromethyl ketone)是一种广谱Caspase抑制剂,可抑制Caspase蛋白酶家族的活性,从而抑制Caspase依赖性细胞凋亡的发生[17]。经不同剂量泛Caspase抑制剂Z-VAD-FMK处理后,挥发油经不同途径诱导的豌豆保卫死亡率均随Z-VAD-FMK处理剂量的增加而降低(表3)。在两条途径中细胞死亡率均在Z-VAD-FMK剂量为40 μl时达最低水平。其中,挥发途径细胞死亡率由66.215 %下降到10.892 %,显著低于对照(P<0.05);淋溶途径细胞死亡率由73.512 %减少至19.637 %,与对照接近(P>0.05)。由此可见,Z-VAD-FMK能显著抑制由加拿大蓬挥发油经不同途径诱导的保卫细胞死亡,推测这种细胞死亡属于Caspase样蛋白酶激活引起的植物PCD现象。
3 讨 论
3.1 加拿大蓬挥发油经不同途径对豌豆保卫细胞的毒性效应
有研究表明[18-19],入侵植物常可造成受体植物光合器官的损伤,降低其光合效率,从而抑制受体植株的生长发育。加拿大蓬也可导致玉米成熟植株叶面积减小,叶绿素a含量显著降低,光合效率受到抑制[20]。结果证实,加拿大蓬挥发油对受体植物叶保卫细胞具有较强的遗传致畸效应和细胞致死效应,与周健等[21]的研究结果一致。加拿大蓬挥发油通过挥发或淋溶途径均可使保卫细胞产生遗传损伤,诱发Caspase依赖性细胞凋亡,导致气孔无法进行闭合调节。这很可能是入侵植物挥发性化感物质进入受体植物,对体内细胞进行化感攻击的一个早期关键环节。推测进入植物体内的化感物质也可能通过类似方式,对光合器官以及营养、生殖器官造成毒性效应,影响受体植物的生理生化机能,最终表现为植株水平上的生长发育受阻、光合效率下降、作物产量降低等现象。
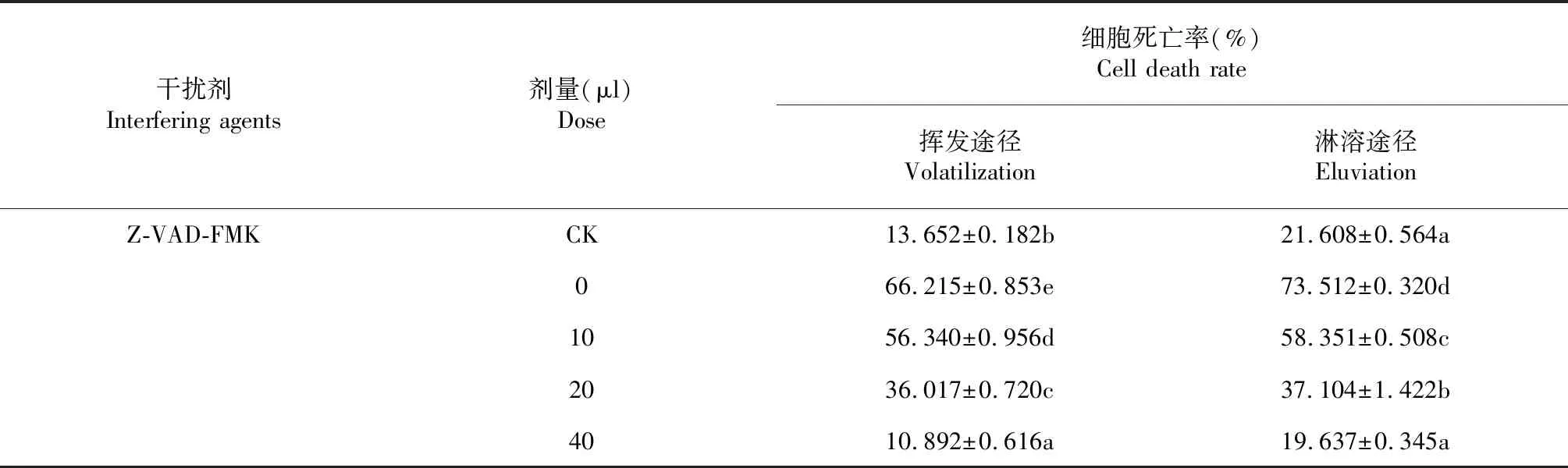
表3 泛 Caspase抑制剂对加拿大蓬挥发油作用下细胞死亡的缓解效应
3.2 经挥发和淋溶两条途径诱发的豌豆保卫细胞毒性效应差异
一般认为,入侵植物释放的挥发性化感物质少部分通过淋溶进入土壤影响受体植物根系[22],大部分则通过空气或雨雾淋溶作用于受体植物的地上器官。由于加拿大蓬挥发油的主要成分均为难溶于水的萜类化合物及其氧化物、醇类、酚类以及酮类化合物等,因此在本研究的模拟条件下,利用DMSO进行了助溶,但数据显示助溶剂对细胞死亡率和核畸变率的影响均不具有统计学意义。此外,加拿大蓬挥发油通过两条途径均可致使细胞活性下降,诱导细胞发生畸变。在同样的处理剂量下,通过淋溶途径作用于受体细胞时显示出更强的毒性效应(淋溶途径和挥发途径下隶属函数总平均值分别为0.475和0.398),与张红等[8]的研究结论相似。由于不同的途径中作用于受体植物的化感物质有效浓度会因实验方法的不同而产生较大差异,不同受体植物对不同途径下化感胁迫的响应也有较大区别,因此关于化感途径的相关研究还需要进一步开展下去。
3.3 ROS、NO和Ca2+参与加拿大蓬挥发油经不同途径对豌豆保卫细胞的毒性效应
前人的研究表明[23],植物体通过复杂的信号调控机制控制着细胞的各种生理功能,当植物遭遇内、外环境因子刺激时,ROS积累,作为信号分子进行信息的传递,触发不同的信号响应途径,可引发植物组织产生一系列的保护措施,如介导细胞发生程序性死亡等[24]。抗坏血酸(AsA)和过氧化氢酶(CAT)均能清除细胞内多余的活性氧[25-26],二者分别显著缓解了加拿大挥发油经两种途径诱导的细胞程序性死亡,表明ROS,特别是其中的H2O2,参与了该过程的信号调控。
在植物体抵抗外界刺激时,随着ROS的爆发,NOS活性通常也随之增强,使NO迅速积累[27]。由于植物体内的NR也是一种NOS[28],因此,NR抑制剂NaN3和NOS抑制剂L-NAME均可抑制NO的产生。加拿大挥发油经两种途径诱导的保卫细胞死亡被NaN3或L-NAME显著缓解,表明该过程不仅与ROS的积累有关,气体信号分子NO也发挥着非常重要的调控作用。
王毅等[29]的研究表明,NO和ROS可通过Ca2+信号系统调控细胞程序性死亡来抵御外界刺激,NO的含量可影响胞内ROS和Ca2+的水平。积累的ROS可激活Ca2+通道,使胞外Ca2+内流而导致胞内Ca2+水平升高[30-31]。Ca2+螯合剂EGTA能够降低细胞外Ca2+浓度从而阻止胞外Ca2+内流,Ca2+通道抑制剂LaCl3则能够阻止外源Ca2+进入细胞。二者均可显著抑制加拿大挥发油经两种途径诱导保卫细胞死亡,说明该过程还与胞内Ca2+的积累有关。由此推测,加拿大蓬挥发油的细胞毒性也可能是通过NO和ROS相互作用调节保卫细胞内Ca2+水平的变化而引起的。
4 结 论
加拿大蓬挥发油经挥发途径和淋溶途径均可诱导豌豆保卫细胞发生核畸变并大量死亡,且淋溶途径的致畸致死效应较强。泛Caspase抑制剂Z-VAD-FMK和抗氧化剂AsA、CAT,Ca2+调节剂EGTA、LaCl3,NO抑制剂NaN3和L-NAME 6种干扰剂均可有效缓解挥发油诱导的保卫细胞死亡(P<0.05),表明这种现象属于Caspase依赖性的细胞凋亡,ROS、NO和Ca2+参与了这一过程的信号转导调节。

