基于磁共振扩散加权图像的诺模图在前列腺癌与前列腺增生鉴别诊断中的应用及其诊断PI-RADS 4 分中前列腺癌的可行性
陈丽华 ,刘爱连,郭 妍,李 昕,郭 丹,宋清伟,魏 强
(1.大连医科大学附属第一医院,辽宁 大连 116011;2.通用电气医疗集团,北京 100176)
前列腺癌(Prostatic carcinoma,PCa)是男性第二常见的肿瘤[1],也是男性癌症死亡的主要原因,常合并前列腺增生(Benign prostatic hyperplasia,BPH),早发现、早诊断及鉴别诊断具有重要的临床意义。目前,前列腺磁共振扩散加权成像(Diffusion-weighted imaging,DWI)在临床上有着较广泛的应用[2-4]。前列腺报告数据系统(PI-RADS V2)[5]作为一种质量控制手段规范报告,可以减少医师之间的诊断不一致性。PI-RADS 4 分为可疑PCa,评分较为复杂,临床上误诊率较高[6-7]。传统的基于医师肉眼观察的影像方法获得的影像特征,与医师的临床经验有很大关系,从而忽略了更多肉眼无法分辨的有价值的影像特征。影像组学是一种能够将影像数据转化为具有高分辨率的可挖掘的定量参数的方法[8]。有研究显示,MRI 影像组学对于PCa 的诊断与鉴别诊断有着重要价值[9],结合影像组学模型可以提高PI-RADS 的诊断效能[10]。
本研究旨在探讨应用影像组学提取、分析前列腺DWI 图像的影像特征并结合诺模图,用以鉴别PCa 与BPH 的应用价值,同时探讨其对于PIRADS 4 分的可疑PCa 病例诊断的可行性。
1 资料与方法
1.1 一般资料
回顾性收集于我院接受前列腺3.0T MR 检查的患者,纳入标准:①可配合MR 检查,前列腺成像清晰;②MR 检查后1 月内进行手术或穿刺,有病理结果证实。排除标准:①MR 检查前曾接受活检或相关治疗者;②既往前列腺手术者;③MRI 伪影重,图像质量欠佳。以时间为节点,按照PCa∶BPH样本量=1∶1 的比例,收集PCa 130 例(2010 年7月—2017 年10 月),年龄50~90 岁,平均(72.26±8.29)岁;BPH 130 例(2010 年7 月—2016 年7 月),年龄51~87 岁,平均(69.13±8.24)岁。本研究经伦理委员会同意,知情同意书舍弃。
设立随机种子,将260 例数据,即PCa 130 例与BPH 130 例均按照7∶3 的比例,随机划分为训练组和验证组(图1)。
1.2 仪器与方法
采用GE Signa HDXT 3.0T 磁共振扫描仪,8通道腹部线圈。患者检查前禁食、禁水4 h,清洁肠道,排空尿液。对所有患者行MRI 常规T1WI、T2WI脂肪抑制扫描、对比动态增强MRI(Dynamic contrast-enhanced,DCE-MRI)扫描及DWI 扫描。DWI扫描采用回波平面成像脉冲(Echo planar imaging,EPI)序列,DWI 扫描参数:TR 3 575 ms,TE 87 ms,b值取0、1 000 s/mm2,层厚5 mm,层间距1 mm,FOV=30cm×30cm,矩阵128×128,NEX=8,扫描时间约139s。
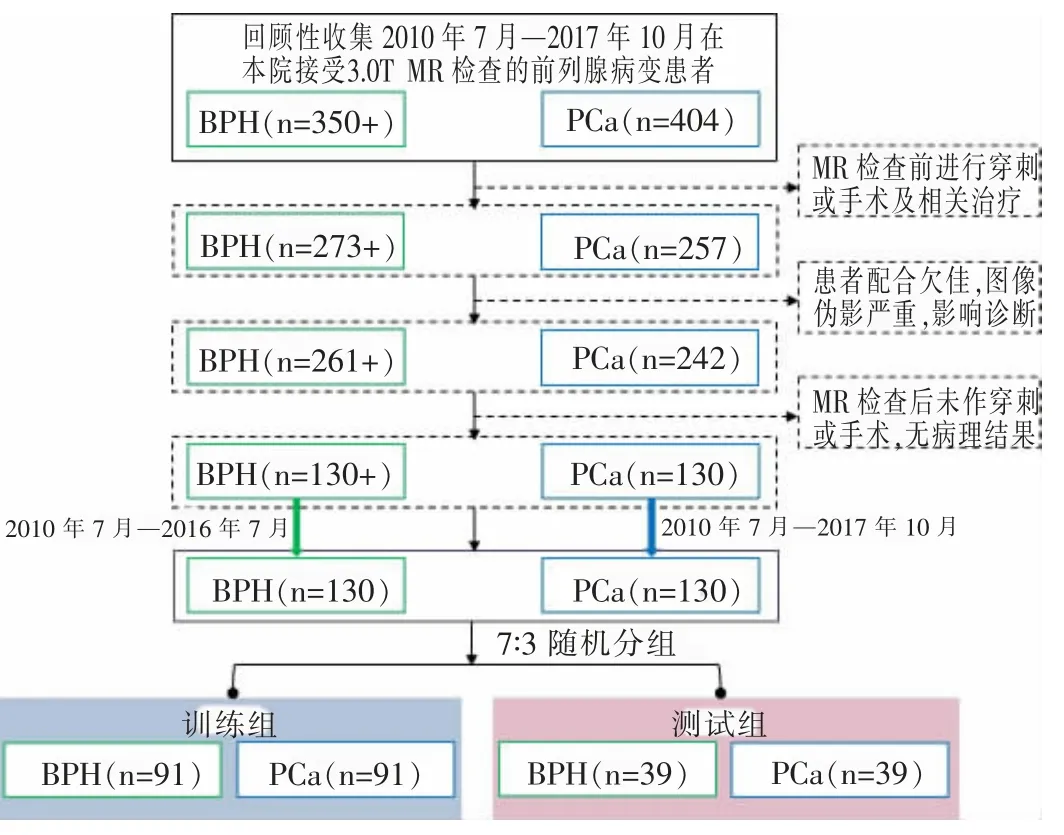
图1 PCa 与BPH 患者收集流程。Figure 1.The flow chart of PCa and BPH collection.
1.3 PI-RADS 评分
由2 名具有5 年MR 诊断经验的影像医生在PACS 系统上对所有入组病例进行阅片,根据PIRADS V2 评分标准,经协商进行1~5 分的评分,将评分为4 分的病例列为可疑病变组[5]。
1.4 模型构建
分别构建临床模型、组学模型及联合模型,流程见图2。
1.4.1 临床模型

图2 临床模型、组学模型、联合模型构建流程。Figure 2.The building process of clinical model,radiomic model and nomogram.
在训练组中,将传统方式获取得到的年龄、病灶位置、DWI 信号特点及总前列腺特异性抗原(Total prostate specific antigen,TPSA)值4 个因素分别经过秩和检验或t 检验,然后分别将有统计学意义的特征纳入单因素逻辑回归和多因素逻辑回归分析,筛选有统计学意义的特征,建立临床模型,并分别在训练组和验证组中绘制ROC 曲线,评估临床模型的效能。
1.4.2 组学模型
①图像分割:由2 名影像医生于DWI 图像上共同勾画感兴趣区(Region of interest,ROI),选取病灶显示最大层面,为了避免勾画病灶区域时受主观因素影响,同时考虑到BPH 患者大多呈弥漫性分布,故本研究中沿前列腺边缘勾画出包含最大层面整个前列腺的ROI[11],勾画的范围两人通过协商取得一致;对于DWI 信号未升高的病例,结合T2WI、DCE-MRI 图像及穿刺结果确定病变层面(图3)。②特征提取:经Artificial Intelligence Kit 软件(AK,通用电气医疗,中国)自动计算,得到基于前列腺轮廓的关于形态特征、DWI 信号值相关的一阶直方图特征以及基于灰度共生矩阵和步长矩阵等的纹理特征,共396 个。③特征降维:经最小冗余最大相关(The minimum redundancy maximum relevance,MRMR)和LASSO(Least absolute shrinkage and selection operator)算法,选择并保留在训练组中鲁棒性最好且对模型贡献率最高的特征。④模型构建:基于上述保留的组学特征,在训练组样本中,构建多元逻辑回归,经十折交叉验证方法,得到最优回归模型,即组学模型。并分别在训练组和验证组中,绘制ROC 曲线,评估模型效能。
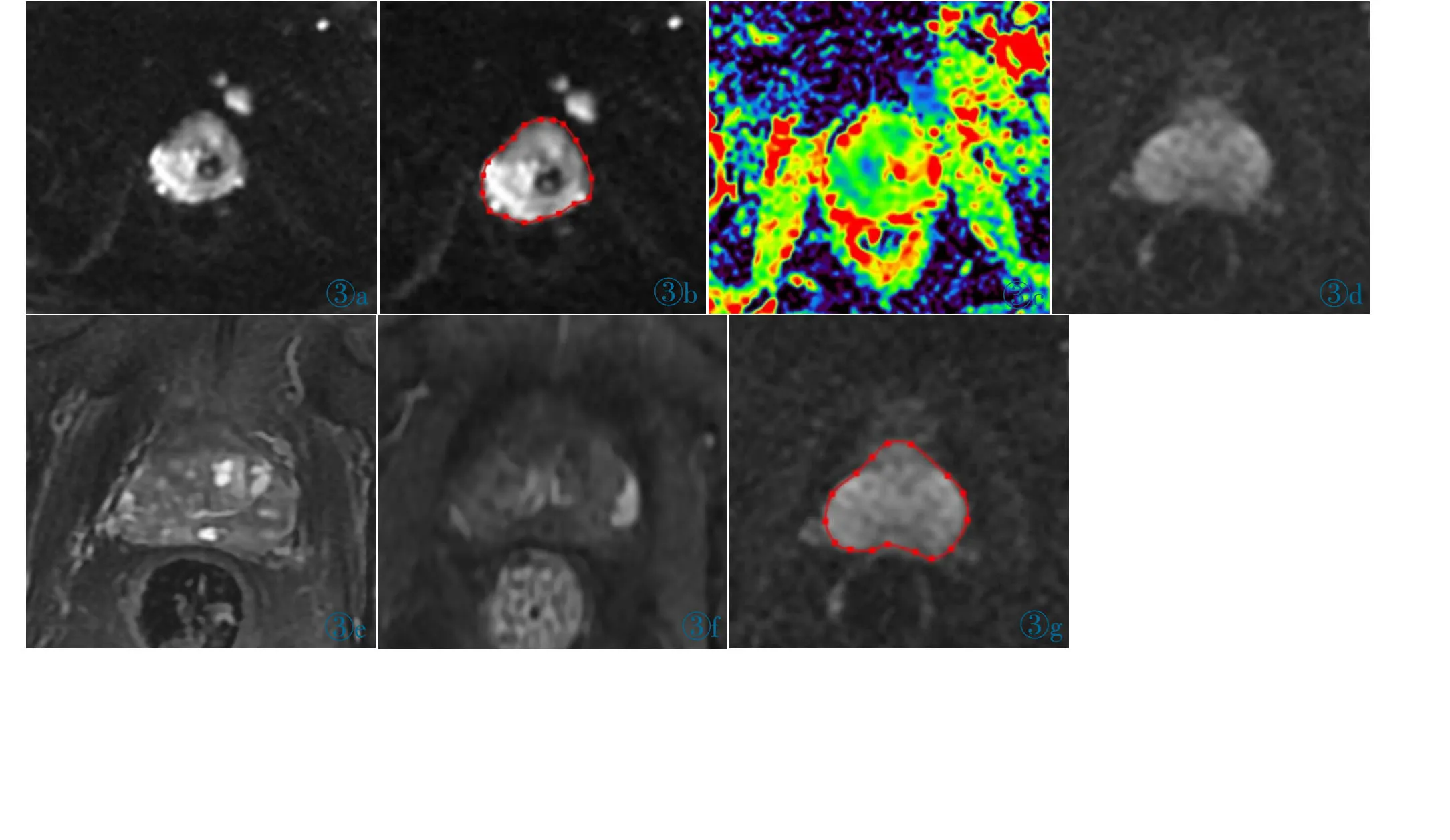
图3 患者,男(图3a~3c),75 岁,PCa,DWI 图(图3a)示右侧外周带明显高信号,在病灶最大层面沿前列腺边缘勾画ROI(图3b);患者,男(图3d~3f),88 岁,DWI 图(图3d)未见明显高信号,T2WI(图3e)示左侧外周带不均匀低信号,DCE-MRI(图3f)见明显强化,联 合T2WI、DCE-MRI 确 定 病灶所在层面,在DWI 图像上勾画ROI(图3g)。Figure 3.PCa,75 years old male (Figure 3a~3c),DWI image (Figure 3a) shows obviously high signal in the right peripheral zone,ROI was sketched along the edge of the whole prostate gland at the slice with the maximum diameter of the lesion (Figure 3b).PCa,88 years old male(Figure 3d~3f),there was no high signal on DWI image(Figure 3d),but,T2WI image(Figure 3e) shows mixed signal in the left peripheral zone,and enhanced obviously on DCE-MRI image(Figure 3f),then ROI was sketched at the same slice(Figure 3g).
1.4.3 联合模型
联合上述构建的组学模型和临床模型,采用逐步向后剔除的方法,构建多元逻辑回归的联合模型,并绘制诺模图,采用ROC 曲线、校准曲线和决策曲线分别评估联合模型在训练组和验证组的效能和临床应用价值。
1.5 分层分析
将被医生评估为PI-RADS 4 分的病变,代入到上述构建的3 个模型中,分别验证并比较模型在可疑病变中的鉴别诊断效能。
1.6 统计学分析
所有统计分析工作均使用R 语言(版本3.3.2,http://www.rproject.org)完成。3 种模型之间的曲线下面积(AUC)比较采用DeLong 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 基本信息
患者基本信息包括年龄、DWI 信号特点、TPSA水平及病灶位置,结果见表1。
2.2 PI-RADS 评分结果
根据PI-RADS V2 评分标准,评分结果见表2,其中PI-RADS 4 分患者共63 例。
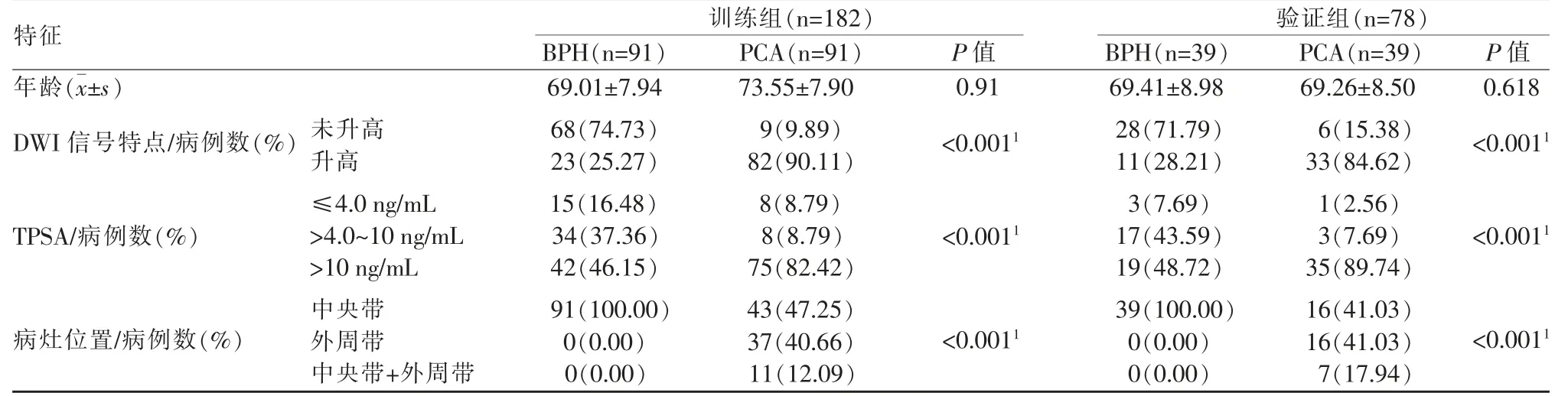
表1 患者基本信息

表2 PI-RADS 评分结果
如表2 所示,在PI-RADS 4 分的病例中,PCa患者30 例,BPH 患者33 例,所占比例相仿,阳性预测值不到50%,鉴别较困难。
2.3 临床模型结果
基于常规临床特征,构建多元逻辑回归模型,临床模型的AUC 在训练组和验证组分别为0.88、0.82,敏感度分别为78.30%、74.42%,特异度分别为89.47%、80%,诊断准确率分别为82.97%、76.92%,见图4。
2.4 组学模型结果
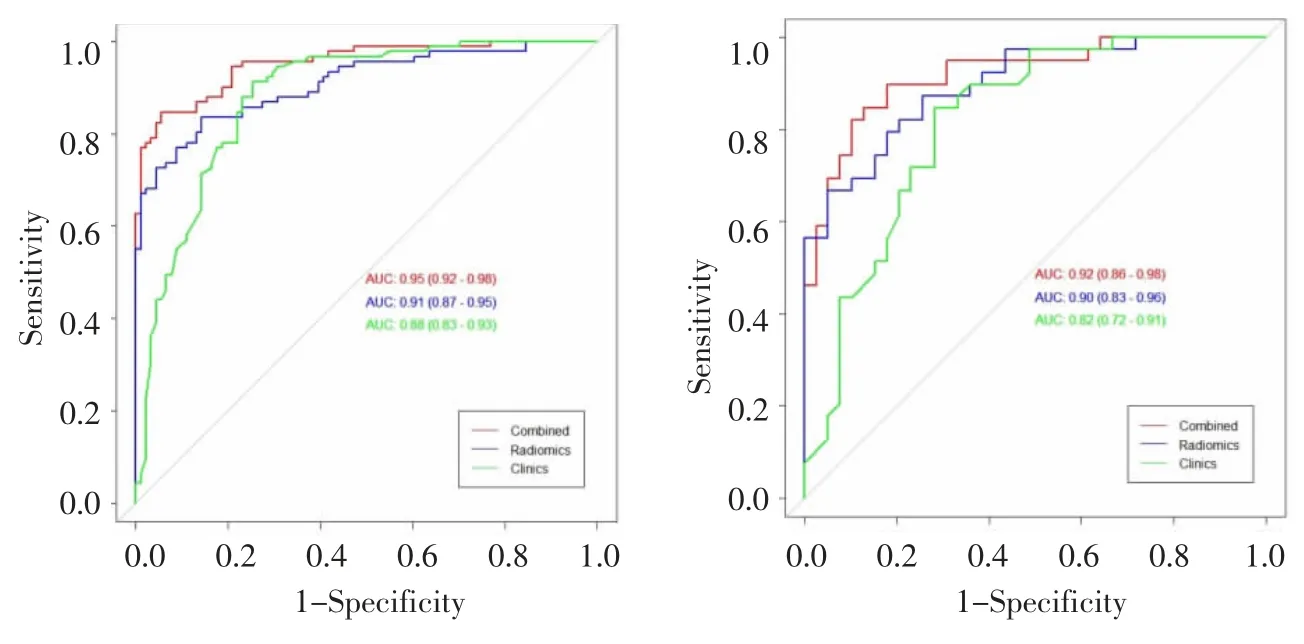
图4 临床模型、组学模型和联合模型鉴别诊断BPH 和PCa 的ROC 曲线,其中图4a 为用于评价该模型在训练组诊断效能的ROC 曲线,图4b 为用于评价验证组的ROC 曲线。Figure 4.The ROC curves of clinical models,radiomics model and combined model distinguished BPH and PCa,Figure 4a and Figure 4b were ROC curves for training and testing dataset.
经特征降维,筛选后得到的特征有12 个。组学模型的计算公式为:Radscore=1.635×uniformity+0.504×HaraEntroy +1.272 ×LowIntensitySmallAreaEmphasis +0.424×ClusterShade_angle45_offset4-0.423×stdDeviation+0.369×ClusterShade_angle135_offset7+0.081×sumEntropy-0.058×Range+0.016×ClusterProminence_angle45_offset7 -0.268 ×GLCMEntropy_AllDirection_offset4_SD-0.034×skewness+0.568。
组学模型的AUC 在训练组和验证组分别为0.91、0.90,敏感度分别为85.71%、74.36%,特异度分别为83.52%、87.18%,诊断准确率分别为84.62%、80.77%,见图4。
2.5 联合模型结果
联合模型的诺模图见图5 所示。

图5 用于预测PCa 的诺模图。注:①Radscore 即为组学评分,可经上述计算公式计算得到;②DWI 结果为1 时表示信号有升高,0表示信号未升高;③TPSA 数值为≤4 ng/mL 时,在图中以0 表示,>4~10 ng/mL 时,以1 表示,>10 ng/mL 时,以2 表示。Figure 5.Radiomics nomogram for PCa prediction.Note:①Radscore was calculated by the Radiomics,which can be obtained by the above formula calculation;②DWI signal raised was denoted as 1,signal unraised was denoted as 0;③When the TPSA value range was ≤4 ng/mL,it was denoted as 0 in the figure;range >4~10 ng/mL,it was denoted as 1;>10 ng/mL,it was denoted as 2.
举例说明,若1 名60 岁患者,经TPSA 检测其指标范围为>4~10 ng/mL,DWI 图像经放射科医生诊断其前列腺病变部位信号未升高,最终代入诺模图,60 岁对应Points 分值为6 分;DWI 未升高即对应为0,同理为0 分;TPSA 属于1 类,则对应Points 分值为1 分;其组学评分经计算得到Radscore 数值为4,即对应Points 分值为64 分。累计以上得分为6+0+1+64 分,对应到诺模图中的Total Points 标尺中71分,因此其对应恶性的可能为77.5%。该结果表明,当DWI 图像显示结果可能为良性,TPSA 显示为可疑病变时,诺模图可能会为临床医生诊断提供巨大的帮助。
经验证,联合模型即诺模图的AUC 在训练组和验证组分别为0.95、0.92,敏感度分别为93.90%、83.33%,特异度分别为86%、88.89%,诊断准确率分别为89.56%、85.90%(图4),校准性能和临床应用价值采用校准曲线和决策曲线(图6,7)。
在训练组中,联合模型诊断效能大于组学模型(P<0.05)及临床模型(P<0.05),组学模型与临床模型的诊断效能间差异无统计学意义(P>0.05);在验证组中,联合模型诊断效能大于临床模型(P<0.05),其余间差异无统计学意义(P>0.05)。
图6 中,横坐标为预测值,纵坐标为实际值,对角虚线为完美的预测模型,而我们所得到的模型为其中细虚线,平均绝对误差为0.017,均方误差为0.000 4,判定系数R2值为0.679 8。其中R2表示模型与理想模型的拟合度,越接近1 表明拟合度越高,一般来讲,R2>0.5 即表明回归模型效果良好,结果表明本研究中诺模图的拟合度较好。
图7 中命名为“With Radscore”的红色实线为联合模型,即诺模图,“Without Radscore”绿色实线为未融合影像组学特征之前的模型,即临床模型。结果表明,当阈值可能性高于0.01 时,诺模图的净收益高于被识别为“全部恶性”或“全部良性”组的结果,并优于临床模型,且两条曲线的分离度较好。
2.6 分层分析结果
将63 例PI-RADS 4 分的可疑病变代入上述构建的3 个模型中,可见临床模型对于该类可疑病变,几乎没有诊断效能,AUC 仅为0.54,而组学模型的诊断效能显著优于临床模型(P<0.05),AUC 为0.81,联合模型的诊断效能低于组学模型(P<0.05),其AUC 为0.73,联合模型和临床模型的诊断效能间差异无统计学意义(P>0.05),ROC 曲线见图8。

图6 诺模图的校准曲线。图6a:训练组;图6b:验证组。Figure 6.Calibration curve of nomogram.Figure 6a:Training group;Figure 6b:Testing group.
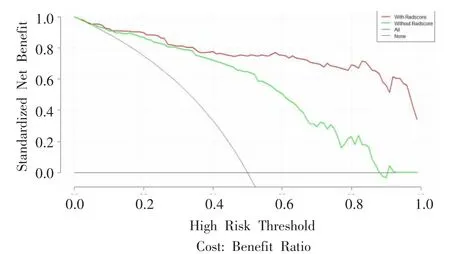
图7 诺模图的决策曲线。Figure 7.Decision curve of nomogram.

图8 3 个模型在PI-RADS 4 分的可疑前列腺病变中的鉴别诊断效能。Figure 8.The ROC curves of three models in PI-RADS 4 for differential diagnosis.
3 讨论
近年来,我国PCa 呈明显持续增长趋势,正成为严重影响我国男性健康的泌尿系恶性肿瘤[12]。PCa自然病程长,个体间特性差异大,其预后及治疗主要取决于早期诊断及分期。
MRI 因其具有较高的软组织分辨率、多参数及多平面成像、无创等优点,成为目前临床上前列腺检查的首选方法。较常规MRI 序列,DWI 能在活体组织中评价水分子的微观扩散运动,同时DWI 还提供了定量参数,表观扩散系数(Apparentdiffusion coefficient,ADC)在PCa 的检出、鉴别诊断及术前预测等方面都有应用[13-15]。DWI 中b 值的选取对图像及其定量参数的测量有较大影响[16],目前还没有完全统一的b 值;另外,DWI 还会受到患者和检查设备之间差异等因素的影响[17]。因此,单一的功能成像方法不能满足诊断需求。
MRI 多序列成像为影像医师提供多方面参考的同时,也带来了一些不便。临床工作中,不同影像医师采用不同序列进行前列腺MRI 影像报告,对同一病例可能给出不同的诊断结果,影响了影像医师与临床医师之间的信息沟通。PI-ARDS 产生的目的是减少影像医师之间对待同一病例诊断结果的多样性,综合分析T2WI、DWI 及DCE-MRI 序列,对来自多中心、多参数磁共振的图像更容易达到诊断的共识[18]。但是,PI-RADS 是对传统影像的观察、人为分析,与影像医师的经验有很大关系。临床工作中,对于PI-RADS 4 分的病例诊断仍较困难,本研究中,PI-RADS 4 分的病例共63 例,其中PCa 有30 例,阳性预测值仅为47.62%。因此,诊断PI-RADS 4 分中的PCa 病例受到研究者们的关注[6-7]。
近年来,随着医学影像成像技术以及信息分析技术的长足发展,高通量提取病灶的影像特征信息来进行定量、分析、建模得以实现,即影像组学,影像组学是在已有的影像学资料的基础上,应用软件进行计算、分析,进而为临床诊断及治疗提供更多的参考信息。自2012 年这一概念提出后,PCa 的影像组学研究受到了众多学者的关注,从形态学、MR 图像到基因方面均有研究[11,20-21]。
对于MR 图像,大家的研究主要集中于T2WI、DWI 的ADC 图和DCE-MRI[22-23]。Ginsburg 等[22]的研究中,从80 例PCa 患者中,通过分析T2WI 图、ADC图纹理特征及DCE-MRI 的动力学等相关特征,得到11 个最为稳定的组学特征,建立组学模型,能够很好地鉴别发生于结合带的PCa 和外周带的PCa。本研究中,直接分析DWI 图像的组学特征,经特征降维、筛选后得到12 个特征,建立组学模型,并分别在训练组和验证组中绘制ROC 曲线,评估其效能,结果显示该模型诊断效能良好,训练组和验证组中AUC 分别为0.91、0.90。除了组学模型,本研究还构建了由年龄、病灶位置、DWI 信号特点、TPSA 值4个因素获得的临床模型,以及基于两者的联合模型,即诺模图,分析显示,联合模型的诊断效能显著优于临床模型及组学模型(P<0.05),在训练组和验证组中AUC 分别为0.95、0.92。
Chen 等[24]的研究中,通过分析T2WI 和DWI 的ADC 图的组学特征,建立组学模型,其鉴别PCa 与非PCa 病变的诊断效能高于PI-RADS 的诊断效能,AUC 分别为0.999、0.867。Wang 等[25]鉴别PCa 与正常前列腺组织的研究中,建立了基于T2WI、DWI及DCE-MRI 的组学模型,与PI-RADS 比较,组学模型的诊断效能显著优于PI-RADS(P<0.001),PIRADS 结合组学模型后,诊断效能提高,AUC 为0.983。既往研究证明,对于PCa 的鉴别诊断,组学模型优于传统PI-RADS,同时也能改善PI-RADS 的诊断效能。相比现有的组学研究,本研究重点探讨所构建的临床模型、组学模型及联合模型对于诊断PIRADS 4 分这类临床中较难鉴别的病例的可行性,结果显示,组学模型的诊断效能优于临床模型(P<0.05),也优于联合常规临床因素的联合模型(P<0.05),考虑在该类可疑病变的诊断中,常规肉眼识别的DWI 信号特点以及TPSA、病灶位置、年龄等都没有较好的诊断价值,组学模型则突显了相应的诊断优势,且本研究中的组学模型构建仅基于DWI 图像,AUC 即可达0.81,有望通过联合多参数MR 组学特征,对该类可疑病变进行进一步的研究。
本研究的不足之处在于对病灶的勾画主要采用手动勾画的方式,虽然规避了勾画病变本身可能引起偏倚的因素,选择了全腺体的分割方式,但仍会受人为因素的影响,相信随着人工智能技术的发展和软件功能的提升,对于前列腺等小器官的分割可以做到完全自动;另一方面,在病灶分割部分,本研究选取病灶所在最大层面二维勾画ROI,有待后续研究在ROI 的勾画方式上进一步提升,进行多层面三维立体容积的勾画;第三,病例中PI-RADS 4 分病例数较少,有待增加病例数进一步验证。
综上,基于前列腺DWI 图像的诺模图,能够很好地鉴别PCa 与BPH,可以客观、定量评估肿瘤的异质性,有望成为一种非侵袭性且有效的诊断工具。对于PI-RADS 4 分病变,常规的临床模型诊断效能远不如组学模型,有望进一步扩充样本量,深入探究影像组学在临床可疑病变中的鉴别诊断价值。

