HIV/AIDS-TB患者抗结核药物治疗强化期红细胞系的变化
舒远路,杨翠先,张 米,李健健,邓雪媚,董兴齐
(1. 大理大学公共卫生学院,云南 大理 671000; 2. 云南省传染病医院检验科,云南 昆明 650301)
结核分枝杆菌(Mycobacteriumtuberculosis, TB)感染已成为艾滋病(AIDS)患者最常见的机会性感染和死亡的主要原因之一[1],67%~88% AIDS合并TB感染的死亡患者发生在抗结核药物治疗的强化期内[2-3],在人类免疫缺陷病毒(HIV)/AIDS合并TB感染(HIV/AIDS-TB)患者中,TB感染能否得到有效控制,是影响AIDS患者预后的关键因素。尽管接受抗逆转录病毒治疗(ART)的HIV/AIDS患者感染TB的风险降低了70%~90%[4],但无论是在结核病的高或低流行地区,合并TB感染发生率仍较高[5]。HIV和TB感染均可造成机体血液系统的损伤,引起贫血[6-7]。25%的HIV/AIDS患者出现贫血,其中76.2%贫血为轻度贫血[8]。16.7%的TB患者存在贫血[9]。调整身体质量指数(BMI)和HIV感染后的多因素分析发现TB感染是贫血发生的危险因素[10],文献[11]报道贫血已成为HIV/AIDS患者疾病进展和死亡的独立危险因素。
HIV/AIDS-TB患者应尽早启动ART,CD4+T细胞计数<200/μL应在抗结核治疗2~4周内开始ART;CD4+T细胞计数为200~500/μL应在抗结核治疗2~4周,最长8 周时开始ART;CD4+T细胞计数>500/μL也应在8周内开始ART。一线抗病毒推荐方案为AZT(齐多夫定)/TDF(替诺福韦)+3TC(拉米夫定)+EFV(依非韦伦)[12]。ART可改善HIV感染所致的贫血症状,无论免疫抑制程度如何或何时启动ART,随治疗时间延长,血红蛋白(HGB)水平均有所提高[13],文献[14]报道ART治疗后贫血的发生率降低30.5%。但因ART药物的毒副作用导致部分患者可发生贫血,AZT以消化系统症状和贫血较常见[15],TDF则表现为肾毒性和骨毒性[16]。而几乎所有的抗结核药物均能引起血液系统不良反应,7.47%为全血细胞减少症,10.55%为各类贫血[17],其中以利福霉素最常见,吡嗪酰胺和异烟肼次之,这些抗结核药物可引起血液系统中一种有形成分的改变或全血系统的异常[18],所以抗HIV与抗TB联合治疗后易导致血液学红细胞系的异常改变[19]。目前有关HIV/AIDS-TB患者联合治疗在强化期内的红细胞系参数变化情况报道较少,故本文收集2014—2017年某传染病专科医院HIV/AIDS-TB住院患者强化期内的红细胞系部分参数,旨在分析联合治疗在强化期内红细胞系的变化差异,为临床HIV/AIDS-TB患者的治疗提供参考依据。
1 对象与方法
1.1 研究对象 选取2014—2017年某传染病专科医院HIV/AIDS(WHO分期为Ⅲ/Ⅳ期)住院患者TB筛查阳性,确诊为HIV/AIDS-TB的患者。纳入标准:(1)年龄18~60岁,既往无TB感染史;(2)无血液系统疾病;(3)强化期内无同时服用其他已知有抑制造血功能的药物;(4)服药依从性良好。排除标准:(1)抗结核治疗前存在严重的贫血或者血液系统疾病的患者;(2)非TB感染的患者。
1.2 结核病诊断标准 结核病诊断参考2001版《肺结核诊断和治疗指南》的诊断标准[20]。
1.3 治疗与分组 以异烟肼(INH)、利福平(RIF)、乙胺丁醇(EMB)和吡嗪酰胺(PZA)四联标化方案抗结核,按常规剂量1次/d,强化期治疗8周。将研究对象分为3组:在ART基础上接受抗结核药物联合治疗组(A组);抗结核药物治疗8周内开始ART联合治疗组(B组);抗结核药物治疗8周后开始ART治疗组,即单纯抗结核药物治疗组(C组)。其中A组和B组根据ART方案不同又分为AZT+3TC+EFV(AZT组)和TDF+3TC+EFV(TDF组)。
1.4 观察方法 抗结核治疗前基线(0周)和治疗后1、2、4、8周定期采血样检测血常规,使用希森美康XS-800i自动血细胞分析仪进行检测,统计红细胞系参数红细胞(RBC)、HGB、红细胞平均体积(MCV)和红细胞分布宽度(RDW-CV)。
2 结果
2.1 一般资料 共选取HIV/AIDS-TB患者180例,其中A组71例,B组75例,C组34例。共85.00%(153例)的患者发生轻度贫血,其中A、B、C组分别为84.51%(60/71)、85.33%(64/75)和85.29%(29/34),3组患者发生轻度贫血情况比较,差异无统计学意义(χ2=0.022,P=0.989)。在ART基础上(A组)与未在ART基础上(B组和C组)的患者出现小细胞低色素性贫血分别为2例、11例,出现大细胞性贫血分别为11例、4例。见表1。

表1 HIV/AIDS-TB患者的基本特征[例(%)]
*:为Fisher's确切概率法检验
2.2 抗结核治疗前基线红细胞系参数比较 在ART基础上接受抗结核药物联合治疗组(A组)与未在ART基础上接受抗结核药物治疗组(B组和C组)患者接受抗结核药物治疗前基线RBC和MCV比较,差异均有统计学意义(均P<0.05)。见表2。
表2A组与(B+C)组患者抗结核治疗前基线红细胞系参数及比较
Table2Baseline erythrocyte lineage parameters and comparison between group A and group (B+C) before anti-tuberculosis drug therapy

组别RBC(×1012/L)HGB(g/L)MCV(fL)RDW-CV(%)A3.62±0.67113.53±21.1093.84±10.7915.84±3.08B+C3.84±0.80111.16±22.4787.66±8.5915.59±2.62t-2.0350.7554.5340.610P0.0430.4510.0000.542
2.3 抗结核治疗后红细胞系参数比较 3组患者在接受抗结核药物治疗后1、2、4、8周的RBC与基线比较,差异均无统计学意义(均P>0.05),见图1a,但B组呈现上升趋势;仅B组在治疗4~8周时,HGB高于基线(均P<0.05),见图1b;A组和B组在治疗1周时,MCV较基线上升(均P<0.05),而C组在治疗2周时才上升(均P<0.05),见图1c;A组在治疗2周时,RDW-CV较基线增高(均P<0.05),而B组在治疗1周时就增高(均P<0.05),虽然C组在治疗2~4周RDW-CV增高(均P<0.05),但治疗8周时恢复至基线水平(P>0.05),见图1d。

◆:为A组该时间与基线比较,差异有统计学意义(P<0.05);★:为B组该时间与基线比较,差异有统计学意义(P<0.05);▲:为C组该时间与基线比较,差异有统计学意义(P<0.05)
图1不同组别患者接受抗结核治疗后红细胞系参数的变化情况
Figure1Changes in erythrocyte lineage parameters in patients in different groups after anti-tuberculosis therapy
2.4 不同ART治疗对红细胞系参数的影响 在接受抗结核药物治疗前,A组和B组患者中AZT/3TC/EFV(AZT组)和TDF/3TC/EFV(TDF组)患者RBC和HGB基线比较,差异均无统计学意义(均P>0.05)。在接受抗结核药物治疗后, A组患者中AZT组患者RBC和HGB与基线比较,均有下降趋势,但差异均无统计学意义(均P>0.05),见图2a、2b;TDF组RBC与基线比较,差异均无统计学意义(均P>0.05),见图2a,但HGB在4~8周时较基线上升(均P<0.05),见图2b。B组患者中AZT组患者RBC和HGB与基线比较,差异均无统计学意义(均P>0.05),见图3a、3b;TDF组患者RBC与基线比较,差异均无统计学意义(均P>0.05),见图3a,但HGB在4~8周时较基线上升(均P<0.05),见图3b。
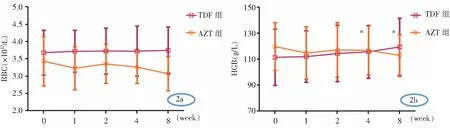
*:为TDF组该时间与基线比较,差异有统计学意义(P<0.05)

*:为TDF组该时间与基线比较,差异有统计学意义(P<0.05)
3 讨论
HIV/AIDS患者在任何CD4+T细胞计数水平均可感染TB,其感染TB后抗结核治疗原则与HIV阴性的结核病患者一致[21]。研究[3]显示,在ART基础上接受抗结核药物治疗、抗结核药物治疗8周内或8周后开始ART,三者间的不良反应发生率比较,差异无统计学意义,血液系统方面的不良反应总发生率为24.4%。AIDS患者全血细胞减少较常见,并具有慢性病贫血表现,以正细胞和正色素性较常见,涂片显示RBC大小不一,有异形红细胞症,缗钱和背景染色增强,偶尔呈现微血管病性溶血性贫血的特征[22]。在接受抗结核药物治疗前,HIV/AIDS-TB患者贫血主要为正常细胞性贫血,接受ART治疗患者的大细胞性贫血高于未治疗患者,与文献[14]报道一致,可能与ART治疗有关,核苷类逆转录酶抑制剂(NRTIs)可使巨幼红细胞DNA的一碳基物质合成障碍,细胞分裂S期延长,细胞核酸物质增加,在形态上体现为幼红细胞体积增大,经脱核发育成体积增大成熟的红细胞[23];而未接受ART治疗患者的小细胞低色素性贫血则多于治疗患者,先前的研究[24]发现未接受ART治疗患者小细胞低色素性贫血的发生率是接受ART治疗患者的5倍,推测小细胞低色素性贫血主要为缺铁性贫血,TB感染增加了对细胞铁的消耗,导致缺铁性贫血的发生[25]。
接受抗结核药物治疗后,3组患者的红细胞系参数MCV、RDW-CV在治疗不同时间后均有上升,A组、B组较C组更明显,MCV和RDW可反映红细胞体积大小和异质性,二者增大常表现为大细胞性贫血和溶血性贫血[26]。大细胞性贫血是因缺乏维生素B12(VitB12)或叶酸导致脱氧核糖核酸合成障碍所致,TB患者的VitB12并不缺乏[27],但服用INH可使患者叶酸缺乏而产生大细胞性贫血[28]。RIF与血浆蛋白结合后,可促进抗利福平抗体和利福平免疫复合物的产生,若吸附在红细胞上,可激活补体导致红细胞损伤,造成免疫性溶血性贫血[29]。同时,在强化期内抗结核药物联合用药易导致肝损伤[30],而肝损伤患者和HIV/AIDS患者均易产生胃黏膜病变,使外源性叶酸、VitB12吸收减少,且肝叶酸、VitB12的储备能力也下降,导致红细胞的体积增大或异质性改变。此外,服用抗结核药物后,TB感染得到有效控制,红细胞可在血液中获得足够浓度的铁离子,小细胞低色素性贫血得到改善[10]。
ART或抗结核药物治疗均可使患者的血液学发生异常变化,ART药物间联合暴露与血液学指标降低有紧密联系[31]。本研究中接受ART治疗患者在抗结核药物治疗前RBC基线稍低于未接受ART患者,而MCV基线则高于未接受ART患者,与王晗等[32]的研究一致。抗结核药物治疗4周内为全血细胞减少、贫血的高发阶段[17],3组患者在强化期内RBC无显著改变,B组患者在接受抗结核药物治疗4周时HGB上升,与陈隽等[33]研究的HIV阴性结核病患者治疗时间一致,一些研究[34-35]也显示强化期治疗后HGB均高于治疗前基线,而A组和C组患者的HGB无改变,推测HIV/AIDS-TB患者的HGB改善的程度与联合治疗开始的时间有关。HGB浓度可作为ART治疗疗效的检测指标[36],在合并贫血患者中HGB水平与预后紧密相关[11]。
A组和B组中AZT组和TDF组的患者在接受抗结核药物治疗前RBC和HGB基线并无差异,而接受抗结核药物治疗后,A组中AZT组患者RBC随治疗时间延长呈下降趋势,推测在抗结核药物治疗的巩固阶段,极可能诱发贫血。有接受抗结核药物治疗史、AZT组的ART方案和CD4+T<200/μL与成人患者的贫血发生有关[37],含AZT药物的治疗组患者发生贫血的概率是不含AZT治疗组的3.34倍[38],且AZT引起的贫血具有时间依赖性[39]。AZT能以dDNA类似物参与细胞核DNA复制,幼红细胞体积增大,脱核形成巨幼红细胞[25],相对于其他核苷类似物,骨髓细胞对AZT更敏感,骨髓象显示红细胞不发育、红系成熟停滞发育不良和巨幼红细胞生成,补充VitB12或叶酸不能预防AZT引起的巨幼红细胞性贫血[40],故临床治疗过程中在强化期结束后的巩固期内应定期复查血常规。而B组中AZT组患者在强化期治疗内RBC和HGB未发生明显变化,可能与临床医生的治疗经验有关,对可能存在贫血倾向的患者未实施基于AZT的ART方案。A组和B组中TDF组患者HGB在接受抗结核治疗4周均较基线增高,与向信春等[41]研究有差异,可能与所选取的研究对象及样本量不同有关。虽RBC浓度逐步升高,但短期内效果不明显。
综上所述,HIV/AIDS-TB患者经治疗后血液学红细胞系变化复杂,抗结核药物治疗8周内接受ART治疗的患者可得到较好的临床转归,不同ART方案联合抗结核治疗的红细胞系参数变化有差异,TDF方案治疗的效果较理想。HIV/AIDS-TB患者在抗结核治疗过程中应尽早启动抗HIV治疗,治疗过程中应密切关注红细胞系的变化,及时调整联合治疗方案,提高HIV/AIDS-TB患者的生活质量。

