老年住院患者反复使用万古霉素疗效及安全性分析
马宗强,安洪亮,李金林
南京梅山医院 1药剂科;2ICU,南京 210039
万古霉素是目前治疗耐甲氧西林金黄色葡萄球菌(MRSA)、肠球菌感染的首选抗生素。美国传染病协会(IDSA)《万古霉素治疗指南(2009年版)》指出:支持万古霉素血药谷浓度维持在15~20mg·L-1的安全性资料有限[1],尤其对于老年患者,由于其本身肾脏储备功能低,且疾病严重程度、合并用药等多种因素均可使其在使用万古霉素时的肾毒性风险增加,故安全性仍有待研究[2]。现回顾性分析我院ICU收治的30例老年肺部感染患者反复应用万古霉素的疗效及安全性,为临床合理用药提供理论依据。
1 资料与方法
1.1 临床资料
收集2015年1月至2018年8月本院ICU使用万古霉素治疗肺部感染的患者。入选标准:(1)年龄≥70岁;(2)应用万古霉素治疗≥2次;(3)2次使用万古霉素时间间隔在15~30天内;(4)正规监测万古霉素血药浓度。
排除标准:(1)年龄<70 岁;(2)接受血液透析的患者;(3)休克;(4)使用升压药;(5)疗程<7 d;(6)使用利尿剂,呋塞米≥40mg·d-1;(7)心功能衰竭Ⅲ~Ⅳ级。
符合标准患者共30例,年龄71~87(81.33.±4.10)岁。入选患者选择万古霉素的依据如下[2]:(1)呼吸道分泌物临床细菌培养及药敏试验提示,对万古霉素敏感的革兰阳性球菌感染的患者,对苯唑西林耐药。(2)病原学培养虽未见革兰阳性球菌,但临床经抗革兰阴性菌治疗后效果不佳,高度怀疑存在革兰阳性球菌感染的患者。
1.2 万古霉素监测方案
所用万古霉素(商品名:来可信,每瓶0.5 g),浙江医药股份有限公司新昌制药厂生产。
血药浓度测定(TDM):依据IDSA《万古霉素治疗指南》[1]规定,在静脉滴注第4次给药前抽取静脉血,采用荧光偏振免疫法(FPIA)测定万古霉素血药谷浓度。根据首次测得的谷浓度调整药物剂量,每次调整剂量后,连续给药3次后监测谷浓度,使其谷浓度维持在 10~20mg·L-1。
1.3 观察指标
在患者用药前、疗程中、治疗后进行细菌培养、涂片、药敏试验、影像学检查、肝肾功能检查、尿量等。常规收集记录病程中患者症状及体征变化、炎症指标(C反应蛋白、降钙素原)、病原学指标、尿量等;记录万古霉素用药前、疗程中及治疗后的尿素氮(BUN)、血肌酐(Scr)、胱抑素 C(Cys C)、β2-微球蛋白(β2-MG)等指标。
1.4 评价标准
1.4.1 疗效评价 依据原卫生部1993年颁布的《抗菌药物研究指导原则》,临床疗效判定标准为4级:(1)痊愈:症状、体征、实验室检查及病原学检查4项指标,均恢复正常;(2)显效:病情明显好转,但上述4项有1项未完全恢复正常;(3)进步:用药后病情有所好转,但上述4项有2~3项未达正常;(4)无效:用药72h后病情无明显进步或加重者。
有效率(%)=(痊愈数+显效数+进步数)/总例数×100%
1.4.2 肾毒性评价标准 急性肾损伤 (AKI)的诊断,则参照2005年急性肾功能损伤网络工作组(AKIN)制定的“共识”以及2012年改善全球肾脏病预后组织 (KDIGO)的标准:(1)48 h内Scr升高≥26.5 μmol·L-1;(2)Scr高于基础值的 1.5 倍, 确认或推测 7d 内发生;(3)尿量<0.5mL·kg-1·h-1,且持续 6 h以上[3,4]。3项指标内占有1项即视为发生肾损伤。
1.5 统计学方法
应用SPSS 17.0软件处理数据,计量资料以均数±标准差()表示,计数资料以例数或率(%)表示,采用 χ2检验;对治疗前、后 Scr、BUN、Cys C、β2-MG的变化,采用配对t检验;3次之间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者基本疾病及万古霉素使用状况
入选患者30例,均以老年肺部感染收入ICU,其中9例长期滞留ICU发生肺部感染。诊断:慢性阻塞性肺疾病急性加重期12例;卒中相关性肺炎8例;其他10例。30例患者中合并高血压25例,合并冠状动脉粥样硬化性心脏病19例,合并糖尿病15例。万古霉素反复使用3次者20例。3次间血药谷浓度达标时,使用的剂量差异无统计学意义 (P>0.05)。万古霉素使用剂量及疗程见表1。
2.2 万古霉素临床疗效
3次使用万古霉素的有效率见表2,其差异无统计学意义(P>0.05)。其中第1次无效的6例患者经其它方案治疗后,临床疗效不理想,根据药敏试验的结果及会诊意见,再次使用万古霉素进行治疗,最终3例进步,3例无效。

表1 万古霉素使用剂量及疗程

表2 万古霉素临床疗效
2.3 万古霉素反复使用的肾毒性及相关指标
30例患者在接受万古霉素治疗期间,发生肾毒性情况见表3。用药次数及剂量对肾毒性发生率的差异均无统计学意义(P>0.05)。
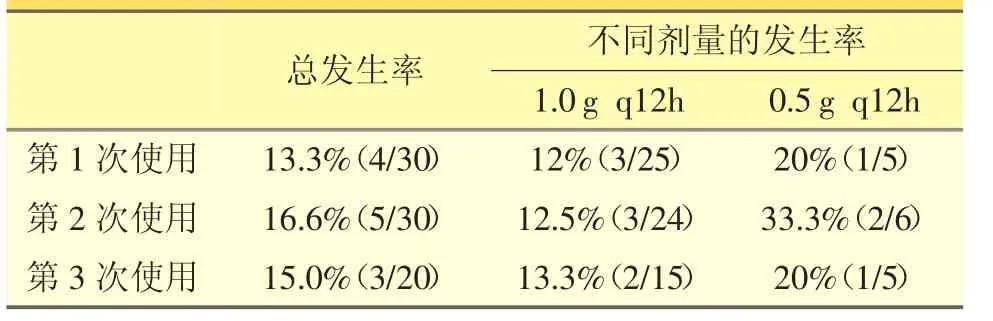
表3 万古霉素的肾毒性情况
BUN、Scr、Cys C、β2-MG 在用万古霉素药前后的变化,差异无统计学意义(P>0.05),其中 Cys C、β2-MG是肾损伤早期的检测指标,见表4。

表4 万古霉素3次使用前后肾功能相关指标的变化
3 讨 论
万古霉素是大环糖脂类抗生素,是治疗MRSA的一线用药,不良反应主要为肾脏毒性和耳毒性,由于生产工艺的提高,耳毒性显著减少。万古霉素80%~90%以原形态经肾小球滤过代谢,仅微量经胆汁排泄,其血清半衰期与肾功能相关。
老年患者由于长期住院、卧床、气管切开、肠道营养支持、广谱抗生素应用及伴有严重基础疾病等原因,易引发MRSA肺部感染。近年来,随着万古霉素在临床应用中剂量的增加,在患者中所致肾毒性越来越多。尤其是老年患者,其肾功能水平存在不同程度的衰退,药物消除半衰期将会延长,易导致万古霉素在体内的蓄积,从而引发肾损害。
万古霉素肾毒性的机制尚不明确。Elyasi S等[5]认为,万古霉素氧化作用导致的肾小管缺血是其肾毒性的主要机制;而Im DS等[6]的体内外试验证实,万古霉素具有抑制P-糖蛋白(P-pg)功能和P-pg在细胞膜上的表达与万古霉素的毒性相关。
一方面,BUN和Scr作为传统的肾脏毒性评价指标,是肾小球滤过功能丧失的结果,与肾小管的损伤并非直接相关,不能反映肾小管功能;另一方面,由于肾小球强大的代偿能力,在急性肾损伤早期,血清BUN和Scr可维持正常水平,当BUN和Scr高于正常值时,其肾小球滤过率(GFR)已降到正常人的1/3。
Cys C作为一种非糖基化碱性蛋白,仅在患者肾脏内清除,其浓度取决于患者的GFR,在血液中的浓度,不受肌肉质量、年龄等因素的影响,且具有较高的特异性和灵敏度。故Cys C已被美国食品药品监督管理局(FDA)和欧洲药品管理局(EMEA)共同宣布为新的生物标志物来评价药源性肾损害[7]。
β2-MG是尿微量蛋白的一种,当其增加,提示肾小球滤过率已有所下降。Cys C联合β2-MG可以更早地反映肾功能损害的情况。
由表2、表4可以看出,把万古霉素的谷浓度控制在10~20 mg·L-1时,老年肺部感染患者反复应用万古霉素是有效的且安全的。这样既避免了血药谷浓度过低(<10 mg·L-1),可能造成的细菌耐药及万古霉素中介敏感金黄色葡萄球菌(VISA)和异质性万古霉素中介金黄色葡萄球菌(hVISA)的出现[8],又避免了过高的血药谷浓度对患者肾功能的损害。张海燕等[9]研究显示,万古霉素致AKI的临界谷浓度为 19.50 mg·L-1、陈春燕等[10]研究结果为 21.10 mg·L-1,说明在中国人群中出现万古霉素所致的AKI临界谷浓度不完全相同,但基本控制在20mg·L-1左右。
需要说明的是,本文为减少混杂因素的影响,设置了较多的排除标准,因而纳入的样本量较小;随着细菌耐药情况的日趋复杂,加上老年患者自身情况的差异性,老年感染患者如何安全有效的应用万古霉素,还有待于大规模的前瞻性研究。

