绿原酸通过PI3K/Akt信号通路抑制异丙 肾上腺素诱导的心肌肥大
杨 洋, 李 觉
(同济大学医学院,上海 200092)
心肌肥大是心脏对多种心血管刺激,如激素、细胞因子和外界压力等因素的刺激下的一种适应性反应,持续性的心肌肥大会造成心脏的失代偿,并进一步发展为心肌缺血、心律失常和心力衰竭,甚至猝死,心肌肥大是心血管疾病发病率和死亡率增高的主要原因之一[1]。因此,探讨心肌肥大的发病机制,寻求有效的防治措施具有重要意义。研究[2]表明,心肌肥大主要与细胞内磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路激活密切相关。绿原酸(CGA)类物质是植物体内有氧呼吸过程中经莽草酸途径产生的一种苯丙酸类次生代谢产物[3],是咖啡酸与奎尼酸形成的缩酚酸[4],具有较强的生物活性,具有抗氧化、抗病毒、抗肿瘤、免疫调节、降糖等多种作用[5]。CGA在异丙肾上腺素(ISO)诱导的心肌肥大中,通过NF-κB信号通路,提升细胞内活性氧(ROS)水平,从而起到抑制心肌肥大的作用[6]。在细胞凋亡调节过程中,糖原合成酶激酶3β(GSK-3β)具有重要意义,而GSK-3β是PI3K/Akt信号通路的作用底物,激活的PI3K/Akt促进GSK-3β磷酸化,间接出现细胞凋亡减少。然而,PI3K/Akt信号通路是否参与CGA抑制心肌肥大少见报道。本研究通过H9c2大鼠心肌细胞建立ISO诱导的心肌肥大模型并应用PI3K/Akt特异性抑制剂LY294002来观察PI3K/Akt信号通路在CGA预处理抑制心肌肥大中的作用。
1 材料与方法
1.1 材料与试剂
H9c2大鼠心肌细胞;胎牛血清、DMEM培养基购自HyClone公司;LY294002、p-Akt兔单克隆抗体、Akt兔多克隆抗体、山羊抗兔二抗;CCK-8细胞活力检测试剂盒、SDS-PAGE凝胶试剂盒、SDS-PAGE蛋白上样缓冲液、ISO、CGA购自Sigma公司。细胞培养箱购自美国Thermo公司;荧光显微镜购自日本Olympus公司;流式细胞仪购自美国Becton Dickinson公司。
1.2 研究方法
1.2.1 H9c2细胞的培养 H9c2细胞培养于含10%胎牛血清,1×105U/L青霉素,100mg/L链霉素的DMEM高糖培养基中,在37℃、5%CO2培养箱中,每2~3d换液,待细胞长到85%~90%时传代。取对数生长期,生长良好的细胞进行实验。
1.2.2 CCK-8法检测不同浓度CGA对H9c2细胞活力的影响 H9c2心肌细胞胰酶消化后使用完全培养基种于24孔板中,24h后换1%胎牛血清培养基。24h后分为对照组及CGA 10、50、100μmol/L培养基处理组。48h后吸弃细胞上清液,加入含10% CCK-8的完全培养基溶液培养2h后450nm波长下检测吸光度(D450)。
1.2.3 心肌细胞肥大模型建立 H9c2心肌细胞胰酶消化后使用完全培养基种于24孔板中,24h后换1%胎牛血清培养基同步化。24h后分为对照组及2、5和10μmol/L浓度ISO处理组。48h后胰酶消化,采用Vicell细胞计数仪计数后进行蛋白质含量检测。
1.2.4 不同浓度CGA组心肌细胞表面积的测定设立CGA的浓度梯度为0、10、50、100μmol/L,正常对照组加同等体积的不含胎牛血清的DMEM,分别对H9c2心肌细胞进行处理。作用48h后计算各组心肌细胞表面积。
1.2.5 分组 将培养的H9c2心肌细胞随机分为5组。(1) 空白对照组: 给予PBS 2mL DMEM完全培养基作为安慰剂,2h后置入2mL DMEM完全培养基中48h;(2) ISO组: 给予PBS 2mL后,10μmol/L ISO+2mL DMEM完全培养基培养48h;(3) ISO+CGA组: 10μmol/L ISO+100μmol/L CGA+2mL DMEM完全培养基培养48h;(4) ISO+CGA+LY294002组: 10μmol/L ISO+100μmol/L CGA+10μmol/L LY294002组+2mL DMEM完全培养基培养48h;(5) ISO+LY294002组: 10μmol/L ISO+10μmol/L LY294002组+2mL DMEM完全培养基培养48h。
1.2.6 CCK-8检测细胞存活率 将H9c2心肌细胞以6×103/孔接种于96孔培养板中,继续培养72h后随机分组并按照上述方法处理后,于每孔中加入10% CCK-8溶液继续培养1.5h,用酶标仪检测450nm波长下吸光度(D450)。细胞存活率%=(实验组D450/对照组D450)×100%。
1.2.7 流式细胞术检测心肌细胞活性氧类(ROS)含量 取对数生长期的H9c2心肌细胞,以1×106/孔接种于6孔板培养,分组处理后,置37℃、5% CO2细胞培养箱中孵育30min,按照活性氧检测试剂盒说明书操作,按1∶1000用无血清培养液稀释二氯二氧基荧光素-乙酰乙酸盐(DCFH-DA),使其最终浓度为10μmol/L,去除细胞培养液,加入100μL稀释好的DCFH-DA,用PBS洗涤细胞3次,用流式细胞仪检测心肌细胞内的荧光强度,其激发波长为485nm,发射波长为510~540nm,测定的荧光强度与细胞内产生的ROS呈正比关系。
1.2.8 流式细胞术检测心肌细胞凋亡 将H9c2心肌细胞分组处理,置于5%CO2、37℃细胞培养箱中培养,用Annexin Ⅴ-FITC/PI凋亡试剂盒检测细胞凋亡,各组细胞按实验方法处理后,收集细胞用PBS洗涤1次,0.25%的胰酶消化收集心肌细胞并离心后弃上清液,再用PBS漂洗2次。用500μL结合缓冲液重悬细胞后,加入FITC标记的Annexin-Ⅴ(40mg/mL)和PI(50mg/mL)各5μL,混匀后于室温避光孵育15min,立即上流式细胞仪检测各组心肌细胞凋亡水平。
1.2.9 Western印迹法检测Caspase、Akt、p-Akt、Gsk-3β、p-Gsk-3β蛋白表达 将各组处理好的H9c2心肌细胞用0.25%胰酶消化后,用PBS洗涤3次,加入裂解液,4℃裂解30min,然后转移至EP管中离心(离心半径10cm,12000r/min,4℃,离心5min),10min后取上清液,用BCA蛋白检测试剂盒检测总蛋白,加入5×上样缓冲液煮沸5min。取30μg蛋白进行SDS-PAGE,然后将蛋白转移到PVDF膜上。用5%的脱脂奶粉室温封闭1h,加入一抗(Akt 1∶1000、p-Akt 1∶1000),4℃摇床孵育过夜,TBST洗膜后加入二抗(1∶3000),室温摇床1h,用发光试剂对膜进行冲洗和浸泡,化学发光成像分析仪对条带进行分析。
1.3 统计学处理

2 结 果
2.1 不同浓度CGA组心肌细胞表面积的测定
ISO显著增加心肌细胞表面积50%,而CGA预处理之后可防止ISO诱导的细胞肥大(图1A)。与无CGA预处理的ISO组相比,10μmol/L CGA的预处理组心肌细胞的表面积减少20%,50μmol/L CGA组心肌细胞的表面积减少30%,100μmol/L CGA预处理组细胞大小几乎无变化,差异具有统计学意义(P<0.05),见图1B。从而选取100μmol/L CGA作为后续实验的给药剂量。
2.2 CGA预处理对H9c2心肌细胞活性的影响
与ISO组相比,100μmol/L的CGA能抑制ISO诱导的心肌肥大,细胞存活率明显增加(P<0.05);与CGA组相比,CGA+LY组细胞存活率明显降低(P<0.05),见图2。

图1 CGA对心肌细胞的预处理显著抵抗 ISO诱导的肥大作用Fig.1 The pretreatment of cardiomyocytes by CGA significantly resists the effect of ISO-induced hypertrophyA: 荧光显微镜下观察到的不同处理条件下细胞大小;B: Image J量化细胞面积;细胞区域由图像J软件测量;与对照组相比,#P<0.05;与ISO组相比,*P<0.05
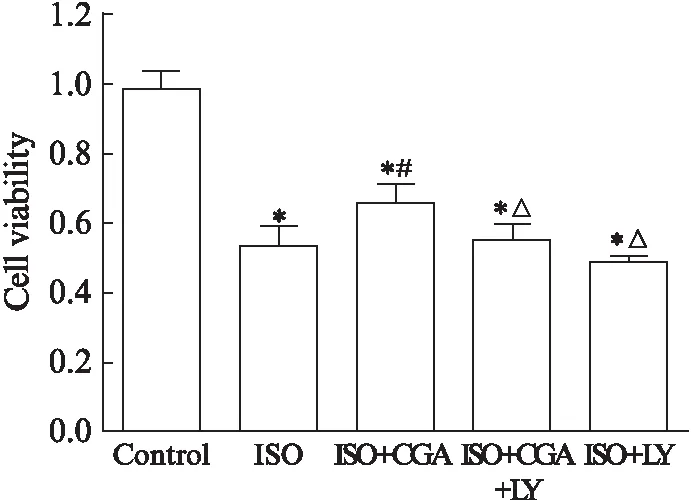
图2 各组心肌细胞活性Fig.2 Cell viability of groups与对照组相比,*P<0.05;与ISO组相比,#P<0.05;与ISO+CGA组相比,△P<0.05
2.3 CGA预处理减轻H9c2心肌细胞由ISO诱导的细胞凋亡
与空白对照组(9.6%±1.0%)相比,ISO组的凋亡率(30.5%±3.1%)明显增加(P<0.05);与ISO组相比,CGA处理组凋亡率(13.9%±1.5%)明显增加(P<0.05)。与CGA处理组相比,ISO+CGA+LY294002组的凋亡率(20.1%±1.6%)明显增加(P<0.05),见图3。

图3 CGA对H9c2细胞凋亡的影响Fig.3 Effects of CGA on H9c2 apoptosis与对照组相比,*P<0.05;与ISO组相比,#P<0.05;与ISO+CGA组相比,△P<0.05
2.4 CGA预处理降低H9c2心肌细胞ROS水平
ISO组荧光强度(212±36)与空白对照组(27±6)相比,细胞的ROS水平增加(P<0.05);CGA预处理组(80±10)与ISO组相比,细胞的ROS水平减少(P<0.05);LY294002组(168±17)与CGA预处理组相比,细胞的ROS水平增加(P<0.05),见图4。
2.5 CGA预处理对H9c2心肌细胞的Caspase、Akt、p-Akt、Gsk-3β、p-Gsk-3β蛋白表达的影响
与空白对照组相比,ISO组Caspase-3表达水平明显升高(P<0.05);p-Akt、p-Gsk-3β表达水平明显降低(P<0.05)。与ISO组相比,CGA预处理组的Caspase-3表达水平明显降低(P<0.05);p-Akt、p-Gsk-3β表达水平明显升高(P<0.05)。LY294002抑制了CGA对Akt与Gsk-3β的磷酸化作用(P<0.05),见图5。

图4 CGA对ISO诱导的心肌细胞ROS水平的影响Fig.4 Effects of CGA on the level of ISO-induced ROS与对照组相比,*P<0.05;与ISO组相比,#P<0.05;与ISO+CGA组相比,△P<0.05
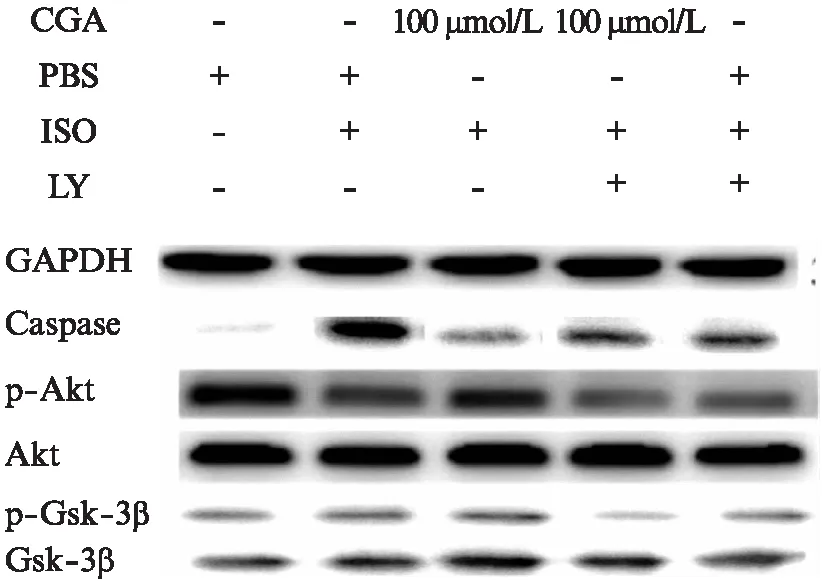
图5 CGA对Caspase、Akt、p-Akt、Gsk-3β、 p-Gsk-3β蛋白表达水平的影响Fig.5 Effects of CGA on the level of Caspase, Akt, p-Akt, Gsk-3β, p-Gsk-3β
3 讨 论
心肌细胞在出生后不久就会失去增殖能力,因此心脏缺乏修复氧化应激引起的损伤的内源性再生能力[7]。所以,本研究关注的是CGA对H9c2心肌细胞肥大的预防作用,而不是晚期的保护作用。CGA是肉桂酸衍生物,广泛存在于植物叶、花和果实中,其中许多已经被用作传统中药,并被报道有降低血压、恢复血管弹性和保护心脏的功能[8-9],但CGA对心肌细胞肥大的抑制作用少见报道。CGA可能是中药中这些功能的重要的生物活性成分。
本研究主要证实了CGA预处理能抑制心肌肥大,且在此过程中,PI3K/Akt信号通路参与了CGA预处理对H9c2心肌细胞肥大的抑制作用。心力衰竭是一种不可逆的终末期心脏病。预防和逆转心肌肥厚是治疗心力衰竭的最佳阶段。目前,研究[10]表明,在ISO刺激下,CGA的预处理可有效抑制心肌细胞的肥大。CGA可能是治疗心肌肥大的一种有前景的药物。PI3K/Akt信号通路被认为是细胞内最重要的生存通路,其最明显的作用是调节细胞凋亡过程,能够抑制细胞凋亡[11]。动物实验己经证实药物预处理可通过激活PI3K/Akt信号途径在心肌细胞肥大中发挥重要作用,表现为增加细胞活性,抑制细胞凋亡[12-13]。PI3K/Akt/GSK-3β信号途径在心肌细胞肥大中发挥重要作用,调节GSK-3β的活性可能会成为治疗冠心病、心功能不全的新策略[14]。
本研究发现,与空白对照组相比,ISO组细胞存活率明显下降,产生的ROS增加,Caspase-3蛋白表达增加,心肌细胞凋亡明显增加。给予CGA预处理后,心肌细胞存活率增加,凋亡率降低,Caspase-3蛋白表达降低;与ISO组相比具有明显差异。本实验还发现,CGA预处理可明显抑制心肌细胞凋亡,应用抑制剂LY294002,CGA的抑制作用消失,提示心肌细胞内PI3K/Akt-Gsk-3β信号转导通路参与CGA抑制心肌肥大作用。结果显示CGA预处理增加了p-Akt的表达,而阻断剂LY294002抑制了Akt的磷酸化。Akt磷酸化的表达变化与抑制心肌细胞肥大的作用效应是一致的,因此提示PI3K/Akt信号通路参与了CGA预处理对心肌肥大的抑制。
综上所述,本研究结果提示,CGA预处理可能通过激活PI3K/Akt信号通路参与抑制心肌细胞H9c2的心肌肥大,但是CGA预处理具体是激活了PI3K/Akt信号通路中哪些效应分子还有待进一步研究。

