利用饲养细胞体外扩增高纯度的效应NK细胞
郭振兴, 张艳慧, 刘绍辉
(1. 同济大学医学院,上海 200092; 2. 山东省千佛山医院儿科,济南 250014)
自然杀伤(nature killer, NK)细胞是一类大颗粒淋巴细胞,表型为CD3-CD56+,发源于骨髓,主要分布于外周血、肝脏和脾脏[1-2]。在功能上,NK细胞介于固有免疫和适应性免疫之间,具有一定的记忆性[3-6]。然而NK细胞仅占人体外周血细胞的5%~15%,且大多数处于未激活状态。NK细胞的体外扩增技术仍不成熟,限制了NK细胞临床应用的普及[7-8]。
本方案采用饲养细胞(FC)来扩增外周血单核细胞(peripheral blood mononuclear cells, PBMCs)中的NK细胞,通过FC胞膜表面所表达的表面分子与目的细胞的相互作用,选择性地刺激目的细胞的增殖。Phan等[9]利用构建的GE_K562细胞(K562-mbIL15-41BBL)共培养人PBMC 21d后,NK细胞增殖达到977倍左右[10]。本研究在此基础上构建了两类FC,即第1代FC(FC-000,K562-41BBL)及第2代FC(FC-002,K562-41BBL-mbIL15-mbIL21)。两者的主要区别是是否带有膜结合型的IL-15及IL-21,这两类细胞因子均具有促进NK细胞增殖的作用。本研究通过比较两类FC对NK细胞增殖的影响并通过NK细胞群的表型鉴定、功能作用的验证来确定最优FC,以优化NK细胞的扩增技术。
1 材料与方法
1.1 试剂及细胞
人非小细胞肺癌细胞系A549于美国模式培养物集存库获得;FC是通过慢病毒转导K562细胞系所构建而来,即第1代FC(FC-000,K562-41BBL)及第2代FC(FC-002,K562-41BBL-mbIL15-mbIL21);重组人白细胞介素2(rhIL-2)购自PeproTech公司;RPMI 1640培养基、DMEM培养基和胎牛血清购自Gibco公司;磷酸盐缓冲液(PBS)和青/链霉素购自Hyclone公司;庆大霉素购自上海中西制药有限公司;淋巴细胞分离液购自CEDARLANE公司;吖啶橙/碘化丙啶(AO/PI)购自Nexcelom Bioscience公司;流式抗体均购于BD公司。
1.2 样本及细胞培养方法
人PBMCs样本来源于健康供体的新鲜外周血,将3mL外周血加入等体积的杜氏磷酸缓冲液(DPBS)稀释后再与Lympholyte®-H按2∶1的体积进行密度梯度离心分选,室温离心(800×g,20min),收集PBMC层并用DPBS进行稀释,再次离心(800×g,10min),将细胞洗2~3次,然后用RPMI 1640培养液重悬。分离后的PBMC可用添加了10%胎牛血清(FBS)、10%DMSO的RPMI 1640培养液冻存液重悬,分装后置于液氮罐中冷冻保存待用。
人非小细胞肺癌细胞系A549用含有10%FBS、100mg/L青霉素、100U/mL链霉素的DMEM培养基培养;FC用10%FBS、1%青/链霉素的RPMI 1640培养基培养,收获细胞于辐照仪中100Gy辐照;FC、PBMC的共培养体系则是用含有300U/mL的rhIL-2、10U/mL庆大霉素、10%FBS的RPMI 1640培养基培养。以上细胞培养体系均置于含5%CO2、37℃的恒温培养箱里。
在实验当天时,将供体PBMC以及辐照的两类FC密度调整到1×106/mL后,分别按照1∶1的FC∶PBMC比例混合进行共培养。7d时,再次按照1∶1比例添加FC,每1~2d进行换液或补液;14d时,收获细胞,统计并进行表型分析及杀伤实验。设置不加FC的单独PBMC组作为对照。
1.3 NK细胞表型及纯度鉴定
分别在0、14d收集共培养体系中的细胞并调整至2×105/mL,将细胞分为3组,分别以标记anti-CD3、anti-CD56、anti-NKG2A、anti-NKG2C、anti-NKG2D、anti-CD94、anti-NKp30、anti-NKp44、anti-NKp46、anti-CD158a、anti-CD158b、anti-CD158e1、anti-CD69、anti-DNAM-1、anti-2B4抗体作为实验组;以标记IgG1-APC、IgG1-PE、IgG2b-PE、IgM-FITC、IgG2b-BV650、IgG1-BV786、IgG1-BV421、IgG1-BV510组作为同型对照组;未加抗体组为阴性对照。4℃避光孵育30min后用含2%FBS的PBS洗2遍,重悬后上流式细胞仪进行检测,利用FlowJo软件进行数据的处理。培养体系中CD3-CD56+细胞的占比即为NK细胞的纯度。
1.4 NK细胞的杀伤实验
杀伤实验利用艾森生物的实时无标记细胞分析仪(RTCA)进行,该细胞分析仪通过嵌在E-plate板上孔底的微电子感应器阻抗变化去感受细胞的有无以及贴壁、黏附和生长程度的改变,可实时、直观地反映细胞增殖、存活、凋亡、形态变化等细胞生物学变化情况。13d时,收集A549细胞并调整密度为1×105/mL,然后向RTCA专用96孔板每孔加入100μL A549细胞悬液进行铺板;14d时,收获共培养体系中的细胞并用含rhIL-2的DMEM培养基调整细胞密度为2×105/mL,然后分别按照效靶比E∶T为5∶1、1∶1、0.2∶1的比例添加NK细胞,杀伤体系终体积200μL(含300U/mL rhIL-2、10%FBS、100mg/L青霉素、100U/mL链霉素的DMEM),设置未加NK细胞的A549组作为对照组;所有组均设置复孔。加入NK细胞2h后,计算杀伤效率,所得实验数据(细胞指数、杀伤时间等)采用RTCA Software 2.0软件进行处理。杀伤72h后,收集杀伤体系上清液,利用流式检测干扰素-γ(IFN-γ)的表达水平,分析其平均荧光强度(mean fludrescence intensity, MFI),MFI值的高低代表着NK细胞分泌IFN-γ的能力强弱。
1.5 统计学处理

2 结 果
2.1 FC-002及FC-000体外扩增NK细胞倍数及纯度
FC-000表达细胞共刺激配体41BBL,但不表达mbIL21和mbIL15,见图1A;FC-002同时表达41BBL、mbIL21、mbIL15,见图1B,证明此批FC构建成功。与对照组相比,两类FC均能刺激NK细胞的扩增。但FC-002对NK细胞的扩增倍数(3325倍)优于FC-000(10倍)(P<0.05),见图1C。且FC-002扩增的NK细胞纯度(93.5%)也高于FC-000所扩增的NK细胞纯度(70.2%)(P<0.05),见图1D。表明FC-002体外扩增NK细胞效果优于FC-000。

图1 FC表型及共培养14d后NK细胞的扩增倍数及纯度Fig.1 The expansion fold and purity of NK cells in co-culture systemA: FC-000表型;B: FC-002表型;C: 共培养14d的NK细胞扩增倍数;D: 共培养14d的NK细胞纯度
2.2 FC-002促进具有特定功能性受体的NK细胞群增殖
与对照组相比,两类FC与PBMCs共培养14d后,FC-000刺激扩增的NK细胞的NKG2D、NKp44、CD69、CD158a分别上升30%、49%、45%、28%(P<0.05),FC-002刺激扩增的NK细胞的NKG2D、NKp44、CD69分别上升43%、65%、46%(P<0.05),CD158a则为4%(P>0.05),见图2。
2.3 FC-002扩增的NK细胞肿瘤杀伤及IFN-γ表达能力
加入NK 2h后,与对照组相比,E∶T=5∶1时,FC-002的NK细胞杀伤效率(95%)高于FC-000的NK细胞(33%)(P<0.05);E∶T=1∶1时,FC-002的NK细胞杀伤效率(45%)高于FC-000的NK细胞(13%)(P<0.05)。E∶T=0.2∶1时,FC-002的NK细胞杀伤效率(21%)高于FC-000的NK细胞(0%)(P<0.05)(图3A、图3B)。与此同时,FC-002扩增的NK细胞杀伤肿瘤细胞时具有更高的IFN-γ表达能力,为FC-000的NK细胞表达能力的4倍(P<0.05),见图3C、图3D。

图2 NK细胞功能性受体分析Fig.2 Functional receptor analysis of NK cells
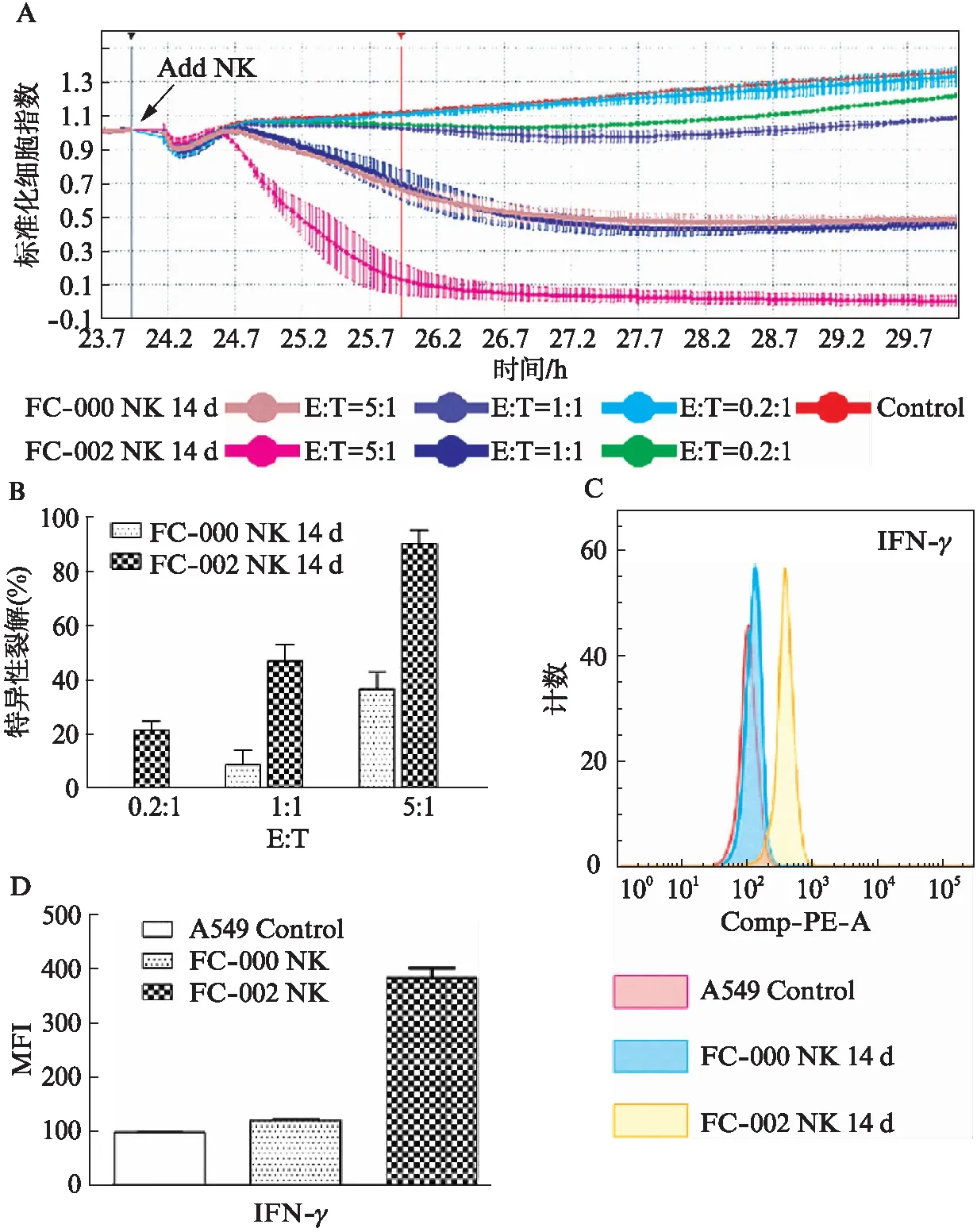
图3 NK细胞对A549的杀伤能力Fig.3 Killing effect of NK cells on A549 A: RTCA检测两种NK细胞对A549生长的影响;B: 加入NK 2h后的杀伤效率;C: 杀伤72h后上清液IFN-γ水平比较;D: IFN-γ表达的MFI
3 讨 论
NK细胞是一种大颗粒淋巴细胞,不需要预先致敏、无主要组织相容性复合体(MHC)限制性,能够对各种外来抗原、自身突变细胞等进行非特异的杀伤,在机体免疫系统中起重要作用[11-13];近年,Bjorklund等[14]利用NK细胞对16例骨髓增生异常综合征/急性髓性白血病(MDS/AML)患者进行免疫细胞治疗,其中6例患者取得了完全缓解及部分缓解,3例在治疗后3年仍未复发,证明了NK细胞临床治疗肿瘤的潜力。当前体外扩增NK细胞的方法主要分为2种,一种是联合细胞因子IL-12、IL-15、IL-18等进行扩增[15-18],Torelli等[19]利用IL-2、IL-15共培养PBMC 2周,NK细胞增殖16倍。另一种方法是利用FC刺激NK细胞扩增,Pahl等[20]利用构建的GE_K562细胞(K562-mbIL15-41BBL)共培养人PBMC 21d后,NK细胞增殖达到977倍。到目前为止,采用FC进行NK细胞扩增的方案在扩增倍数和纯度上要优于联合细胞因子的扩增方案,但仍具有很大的优化空间。
FC主要利用慢病毒等载体将特定基因转导入某些肿瘤细胞株,使其细胞表面表达出特定的蛋白等小分子物质,再采用X射线辐照,使得这类转导后的细胞失去增殖能力,同时仍保留完整的细胞膜表面,FC胞膜上的功能性配体可选择性地激活PBMC中的NK细胞,从而实现NK细胞的扩增。扩增活化效果主要与FC胞膜表达的功能配体分子组合有关[21]。本研究构建了第1代FC(FC-000,K652-41BBL)和第2代FC(FC-002,K562-41BBL-mbIL15-mbIL21),两者的主要区别是是否带有膜结合型的IL-15及IL-21,这两类细胞因子均具有促进NK细胞增殖的作用[22]。通过实验发现FC-002能够在14d内将NK细胞扩增倍数提高到3300倍左右,远高于FC-000,且优于Phan等[9]体外扩增NK细胞的方案。
NK细胞发挥作用依赖于细胞表面多种受体的影响,如NKG2D、NKG2A、NKG2C、NCRs、KIRs、DNAM-1、2B4等[23-24],这些信号综合决定了NK细胞是否发挥作用。除此之外,两类FC均能够选择性扩增具有功能性受体NKG2D、NKp44、CD69的NK细胞群,NKG2D和NKp44作为激活性受体,能够激活NK细胞,使其发挥杀伤作用;CD69作为NK、T细胞的激活性标志[25-27],表明本方案体外扩增的NK细胞得到激活。IFN-γ是由NK细胞分泌的一种细胞因子,其对于天然免疫与适应性免疫抵抗病毒、细菌的感染起关键作用。体外杀伤效果显示,FC-002扩增的NK细胞在杀伤能力及IFN-γ表达能力上均优于FC-000;而FC-000所扩增的NK细胞群带有抑制性受体CD158a的表达,FC-002对于表达CD158a的NK细胞群则无增殖效应,提示CD158a抑制性受体的表达抑制了NK细胞的杀伤活性,而在FC上构建膜结合型的IL-15及IL-21则不会促使表达这类受体的NK细胞增殖。
总之,本研究方案通过对两种FC的比较,证明了第2代FC(FC-002)无论是在NK细胞的体外扩增上,还是NK细胞纯度、NK细胞杀伤效率及IFN-γ表达能力上均优于第1代FC(FC-000)。FC-002能够显著提高NK细胞的扩增倍数,并促进了具有NKG2D、NKp44、CD69功能性受体的NK细胞群的扩增。NK细胞体外扩增技术及其在肿瘤临床治疗方面的安全性、有效性和免疫生物学相关性仍需继续研究和完善,相信NK细胞的临床应用会随之逐渐普及。

