脂肪肝和脂肪胰患者营养状态差异的研究
朱国英, 黄东平, 方 青, 方敏彦, 杨长青, 朱风尚
(1. 同济大学附属普陀人民医院临床营养科,上海 200060; 2. 同济大学附属同济医院消化科,上海 200065)
脂肪肝(fatty liver, FL)及相关疾病谱与慢性肝病重症化、代谢综合征、心血管疾病的关系已受到临床广泛关注[1]。但临床对脂肪胰(fatty pancreas, FP)的认知或关注甚少[2]。研究[2]表明,FP不仅与胰岛素抵抗、代谢综合征、心血管疾病关系密切,而且在胰腺炎和胰腺癌风险中起重要作用。本研究通过比较脂肪肝及脂肪胰患者人体测量和成分指标、实验室营养指标的差异,为重视和规范脂肪胰的营养干预提供依据。
1 资料与方法
1.1 一般资料
连续前瞻性收集2017年1月—2018年8月在同济大学附属同济医院消化科就诊的脂肪肝和/或脂肪胰患者、同时期健康体检患者共372例。分为脂肪肝组(FL组,112例)、脂肪胰组(FP组,102例)、脂肪肝合并脂肪胰组(合并组,80例)和非脂肪肝和/或脂肪胰对照者(对照组,78例)。本研究脂肪肝包括非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)96例和酒精性肝病(alcoholic liver disease, ALD)16例。脂肪肝诊断标准采用2018版NAFLD和ALD指南定义标准[1,3]。脂肪胰诊断以上腹部平扫或增强CT诊断标准界定[4]: 胰腺轮廓尚清晰,实质整体密度与肾脏相同但低于脾密度,边缘较模糊;脂肪所浸润胰腺组织均一或不均低密度,点片状局限或广泛小叶内或小叶间。
1.2 纳入及排除标准
纳入标准: 年龄18~70岁;符合脂肪肝和/或脂肪胰临床工作定义;患者同意并签署知情同意书。排除标准: 由病毒、自身免疫、药物、肝豆状核变性导致的脂肪肝者;有恶性肿瘤病史或严重胃肠道、心肺、肾和血液系统疾病者;有活动性精神疾病或心身疾病者;妊娠、哺乳期或备孕妇女;极度肥胖或体质量指数(body mass index, BMI)≥37.5kg/m2、无法平卧而不能行生物电阻抗分析法(bioelectrical impedance analysis, BIA)检测者。
1.3 人体测量指标检测
营养状态相关的人体测量(anthropometry)指标包含BMI、三角肌皮褶厚度(triceps skin fold, TSF)、上臂中点围(mid arm circumference, MAC)、上臂肌围(arm muscle circumference, AMC)和手握力等,以标准化检查法进行[5],每项指标检测3次,取均值以保证质量控制。身高/体质量测试: 受试者脱鞋呈正立姿势站在底座上,躯干挺直,上肢自然下垂,脚跟并拢,脚尖分开约60°,头部正直,两眼平视前方,站稳后读取数据。测定TSF要求被检者站立位,上臂自然下垂,统一取左上臂背侧肩胛骨肩峰至尺骨鹰嘴之连线中点,两指捏起皮肤及皮下组织,用皮褶厚度计(武邑县东润医疗器械厂)测定TSF;MAC测定要求上臂自然下垂于身体一侧,软尺环于左臂背侧肩胛骨肩峰至肘部鹰嘴间之连线中点,计数时软尺松紧适度。握力器测试时,受试者用优势手持握力计,身体直立,两脚自然分开,两臂自然下垂,开始测试时尽可能用最大力紧握握柄,禁止摆臂、下蹲,或者将握力计接触身体,测试两次,取最大值。身高/质量仪、握力器由同方健康科技股份有限公司提供。以TSF和MAC数值计算AMC。AMC=MAC(mm)-3.14×TSF(mm)。
1.4 人体组成检测
人体成分分析仪(同方健康科技股份有限公司)以BIA进行标准化检测。利用电流在身体脂肪和非脂肪组织时阻抗值之间的差别计算人体脂肪、骨骼肌和矿物质量。标准化检测要求受试者摘下身上所有携带的金属物品,包括手机、手表、钥匙等,脱去鞋和袜子,同时将裤腿折叠到小腿中部,站立到测试仪器所标记出来的足部站立区,受试者双手自然握住测试手柄,双臂张开与身体两侧成30°左右夹角,双眼目视前方,不要说话不要动,保持平静的心情。测试工组人员依据受试者测试信息表上的身高、年龄、性别情况输入至仪器屏幕中,保持上述姿势1~2min即可。
1.5 实验室营养指标检测
实验室营养相关指标包括血红蛋白(hemoglobin, HGB)、总蛋白(total protein TP)、白蛋白(ALB)、前白蛋白(PAB)、总胆固醇(TC)、三酰甘油(TG)、空腹血糖(FBG)和空腹血清胰岛素(fasting serum insulin, FINS)。以德国BAYER ADVIO 2400全自动生化分析仪检测,然后根据FINS和FBG值计算胰岛素抵抗指数(HOMA-IR)。
1.6 统计学处理

2 结 果
2.1 患者基线资料比较
FL组患者112例,男、女性分别为64、48例,平均年龄为(51.6±18.3)岁;FP组患者102例,男、女性分别为61、41例,平均年龄为(49.6±24.8)岁;合并组患者80例,男、女性分别为49、31例,平均年龄为(50.7±20.6)岁。对照组患者78例,男、女性分别为43、35例,平均年龄为(48.6±19.5)岁;各组在性别(χ2=0.82,P=0.40)和年龄(t=1.04,P=0.77)上具有可比性。同时,FL组患者病因学(NAFLD和ALD)构成比差异也无统计学意义(P>0.05)。
2.2 人体测量和人体组成指标比较
各组人体测量指标中TSF、MAC、AMC和手握力差异均无统计学意义(P>0.05),而BMI差异明显(P<0.05)。对BMI的组间比较结果显示,无论FP组和FL组相比(P=0.02),还是合并组和FL组相比(P=0.03),BMI均明显升高,但FP组和合并组间差异无统计学意义,见表1。人体组成指标中,各组骨骼肌量和矿物质量整体均数间差异无统计学意义(P>0.05),而脂肪组织量差异明显(P<0.05)。对脂肪组织量的组间比较结果同样发现,无论FP组和FL组相比(P=0.00),还是合并组和FL组相比(P=0.00),患者脂肪组织量均明显升高,但FP组和合并组间差异无统计学意义(P>0.05),见表1。
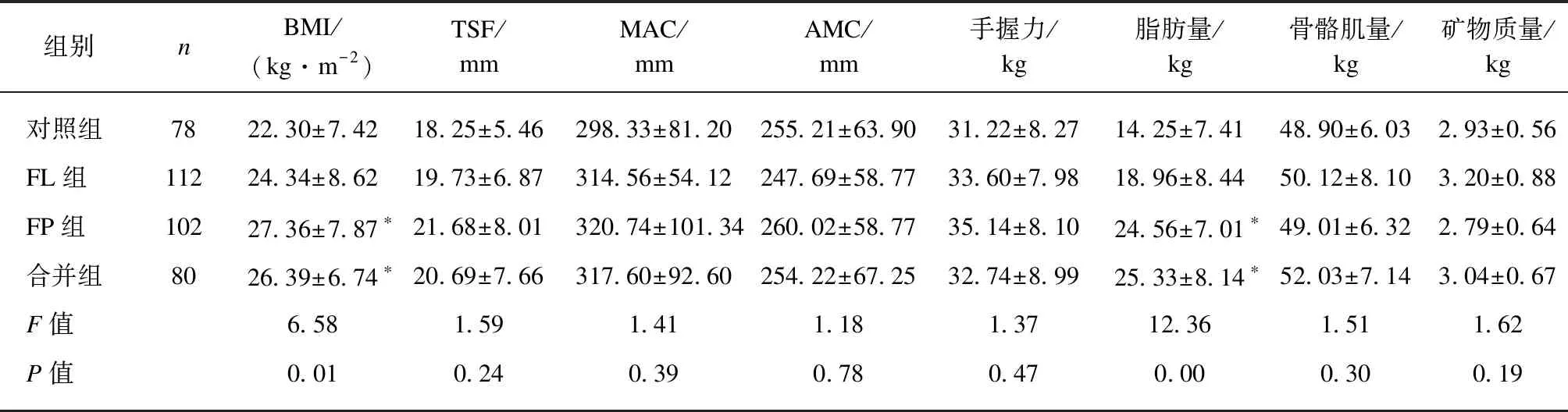
表1 人体测量和组成指标比较
与FL组相应指标比较,*P<0.05
2.3 实验室营养指标比较
各组实验室营养指标中,HGB、TP、ALB和PAB 4个指标整体均数间差异均无统计学意义(P>0.05),而TC、TG、FBG和HOMA-IR等4个指标差异明显(P<0.05)。但TC的组间比较分析未发现有统计学意义的组间差异。TG组间分析结果显示,无论FP组和FL组相比(P=0.04),还是合并组和FL组相比(P=0.03),TG均明显升高,且合并组较FP组更高(P=0.03),见表2。FBG组间分析显示,无论FP组和FL组相比(P=0.00),还是合并组和FL组相比(P=0.00),FBG均明显升高,但合并组和FP组差异无统计学意义。同样,HOMA-IR组间分析发现,无论FP组和FL组相比(P=0.00),还是合并组和FL组相比(P=0.00),HOMA-IR均明显升高,但合并组和FP组差异无统计学意义(P>0.05),见表2。
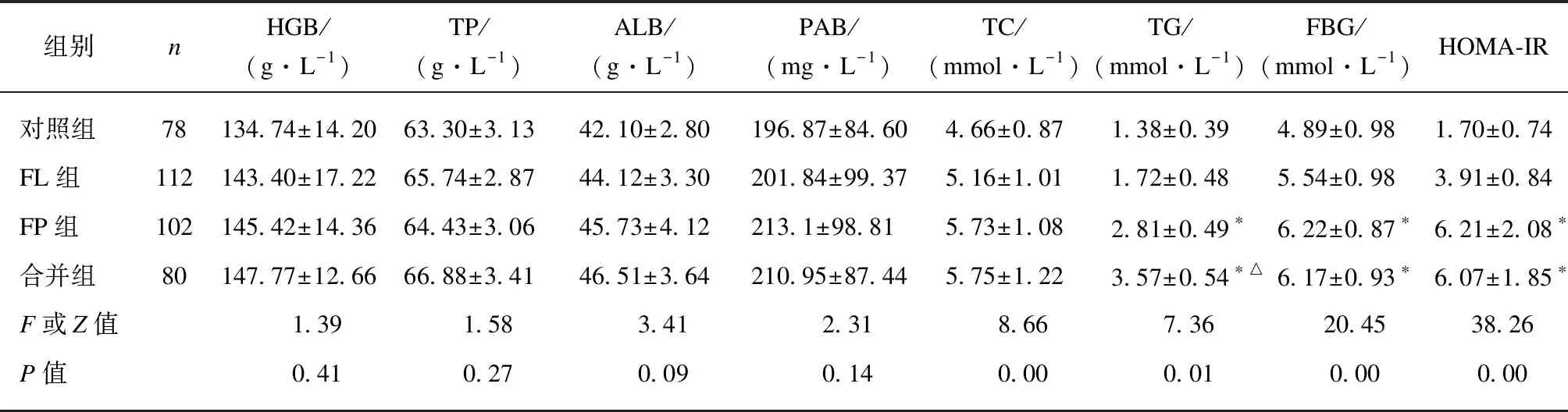
表2 各组实验室营养指标比较
与FL组相应指标比较,*P<0.05;与FP组相应指标比较,△P<0.05;
3 讨 论
脂肪胰既往又称胰腺脂肪浸润(pancreatic fat infiltration)、非酒精性脂肪性胰腺病(non-alcoholic fatty pancreas disease, NAFPD)[6]。相比于对脂肪肝及相关疾病谱(单纯脂肪肝、脂肪性肝炎及其肝硬化)的知晓度和重视度,脂肪胰是近年来较突出的临床问题[7-8]。脂肪胰与脂肪肝有较多共同的危险因素(肥胖/高BMI、年龄、胰岛素抵抗、糖尿病),但脂肪胰的2型糖尿病、胰腺炎甚或胰腺癌临床代谢风险比脂肪性肝病更高[9]。脂肪胰患者可能较脂肪肝患者更迫切地需要营养干预,如更严格的膳食营养上的热量控制,中等程度有氧运动量和频率的增加。为此,本研究比较脂肪肝和脂肪胰患者营养状态的差异,为规范脂肪胰的营养干预提供依据。
肥胖是脂肪肝与脂肪胰密切联系的纽带[9]。虽然本研究结果TSF、MAC、AMC和手握力、骨骼肌量和矿物质量等指标组间差异无统计学意义,但本研究结果证实了脂肪肝和(或)脂肪胰较正常组BMI明显升高[9]。同时也发现,无论FP组和FL组相比(P=0.02),还是合并组和FL组相比(P=0.03),BMI均明显升高,该结果暗示脂肪胰较脂肪肝可能有更大的营养过剩风险。另外,FP组和合并组间BMI差异不明显,表明了脂肪胰较脂肪肝有更大的营养过剩权重。
本研究结果还显示无论脂肪肝和/或脂肪胰,脂肪组织量、三酰甘油等营养指标均较对照组明显升高,这与既往较多研究一致[9]。但本研究另外发现,和脂肪肝组相比,无论是脂肪胰或脂肪肝合并脂肪胰者,其上述指标升高更为明显。这也提示脂肪胰较脂肪肝有更高营养过剩风险。既往受认识水平和检测手段限制,肥胖过程中的脂肪胰甚至被认为是无害或仅是脂肪异位沉积的一部分[10]。但越来越多的证据显示,脂肪胰不仅增加代谢综合征、心脑血管风险,还通过下降B细胞功能,加重胰岛素抵抗和胰腺局部炎症,导致糖尿病、胰腺炎和胰腺癌风险明显增加[11]。
脂肪胰常与脂肪肝共存,二者可能存在一定的先后关系。韩国Lee等[9]发现脂肪肝和脂肪胰共存率为67.9%,单有脂肪胰者29.9%,单有脂肪肝者2.2%,表明胰腺脂肪浸润提示胰岛素抵抗和脂肪异位沉积,脂肪胰可很好地预测脂肪肝发生。有研究[12-13]认为,脂肪过多分解后,先导致胰腺脂肪堆积,后以游离脂肪酸通过门脉系统进入肝脏,从而导致脂肪肝的发生。Uygun等[14]报道脂肪肝患者脂肪胰发生率51.2%(43/84)显著高于健康组14%(5/35),合并脂肪胰的脂肪肝患者腰围、糖化血红蛋白和餐后血糖均明显高于未合并者。本研究结果从客观营养指标的角度证明了脂肪胰患者较脂肪肝患者更易发生胰岛素抵抗和营养过剩风险。但本研究属于单中心、中等样本量研究,缺乏大宗长期随访的对比资料,尚需大样本量的长期临床随访进一步进行验证。
综上,随着近年慢病管理防治关口理念前移的不断深入,本研究初步结果显示临床上亟需重视和积极营养干预脂肪胰。

