不同甘薯品种抗UV-B辐射增强的效应分析*
孟凡来,郭华春
不同甘薯品种抗UV-B辐射增强的效应分析*
孟凡来1,2,郭华春1**
(1.云南农业大学农学与生物技术学院,昆明 650201;2.云南省文山州农业科学院,文山 663000)
用比色法研究人工增强UV-B辐射对盆栽‘滇紫甘薯24’(‘DZS24’)和‘徽薯’(‘HS’)成熟叶片渗透调节物质含量和抗氧化酶比活力的影响及其种间差异。结果表明:增强UV-B辐射下2品种的可溶性糖含量(SSC)均随辐射强度的增加而显著降低,可溶性蛋白质含量(SPC)均为前期随辐射强度的增加而降低,后期随辐射强度的增加而升高,但‘HS’的变化幅度均大于‘DZS24’,‘DZS24’的游离脯氨酸含量(FPC)随辐射强度的增加而增加,‘HS’则与其相反;2品种的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)比活力随辐射强度的增加而升高,POD(过氧化物酶)比活力随辐射强度的增加而降低,但相同辐射下‘DZS24’的SOD比活力的增幅大于‘HS’,POD和CAT比活力的变幅小于‘HS’。因此‘DZS24’具有比‘HS’更强的渗透调节和抗氧化能力,更适于在UV-B辐射强烈的低纬高原地区种植。
甘薯;UV-B辐射;渗透调节物质;抗氧化酶比活力
大气臭氧层破坏导致到达地表的太阳UV-B辐射(280−320nm)增加,过量的UV-B辐射可以攻击植物的DNA、蛋白质和膜系统进而对植物的生长发育和生理代谢等多方面产生负面影响[1]。因此,研究UV-B辐射增强对生物的效应并制定有效的防护对策,已成为世界各国在农作物栽培过程中面临的一项重大课题[2-3]。植物在面临强UV-B胁迫时一方面通过积累可溶性糖、可溶性蛋白质和脯氨酸等主要渗透调节物质[4],来维持或强化叶片细胞在强UV-B辐射下的渗透调节能力,另一方面通过提高SOD(超氧化物歧化酶)、POD(过氧化物酶)及CAT(过氧化氢酶)等抗氧化系统关键酶的活性,减轻活性氧自由基(ROS)的损伤[5],使植物体内活性氧维持在一个较低的水平,防止活性氧引起的膜脂过氧化及其它伤害。当UV-B辐射剂量超过植物自身所能承受的阈值后,则会导致细胞膜脂质过氧化,从而使植物产生氧化伤害现象[6]。苏贝贝[7]研究发现,颠茄游离脯氨酸和可溶性糖含量随UV-B辐射强度的增加而增加,且随着处理天数的增加均呈先增加后降低的趋势。李晓阳等[8]报道用低剂量的UV-B辐射(辐射剂量≤1.0kJ·m−2·d−1)可促进拟南芥中可溶性蛋白质含量的增加,而高剂量的辐射(辐射剂量>1.0kJ·m−2·d−1)则抑制其合成。欧阳磊等[9]研究发现,随着UV-B辐射时间的增加,烟草品种K326的SOD和POD活性较对照显著增加,CAT活性呈先增加后降低的趋势。
甘薯[(L.)Lam.]具有低投入、高产出、耐干旱、耐脊薄特性,尤其适合云南山地农业生态条件,为云南第二大薯类作物,在云南省的经济和社会生活中具有举足轻重的作用。薯肉颜色为紫色至深紫色的甘薯称为紫甘薯()又称紫薯,与普通甘薯相比,其富含花青素、黄酮、绿原酸等多种营养成分,具有抗氧化、预防心血管疾病、抗癌和护肝等保健功效[10−11],随着生活水平和健康意识的提高,紫甘薯越来越受到消费者的青睐,市场前景看好,适当发展优质紫甘薯栽培,不仅有利于居民膳食结构的优化,而且也是发展云南高原特色农业、效益农业的有效途径。云南地处低纬高原,空气稀薄,紫外线较强[12],受臭氧破坏的影响也较大,因此,研究臭氧破坏后UV-B增强对当地重要农作物甘薯的影响及其反应机制,对保证当地甘薯产业持续平稳发展具有重大意义,而且具有一定的科研前瞻性。当前国内外学者已对小麦、玉米和大豆等作物受UV-B辐射增强的影响进行了较为深入系统的研究[13−14],但关于UV-B辐射对甘薯效应的研究鲜有报道。本试验以生物学性状不同的2个甘薯栽培品种为研究对象,通过室外盆栽人工增强UV-B辐射的方法,研究UV-B辐射增强对其渗透调节物质和抗氧化酶比活力的影响,分析该2个甘薯品种渗透调节物质和抗氧化酶的特性差异,旨在为低纬高原抗UV-B优良甘薯品种的选育和甘薯抗UV-B机理的研究提供理论依据。
1 材料与方法
1.1 试验材料
紫色甘薯:‘滇紫甘薯24’(‘DZS24’)(品种登记号:云种鉴定2015046号)由云南农业大学薯类作物研究所选育的高产优质紫色甘薯品种[15];普通甘薯:‘徽薯’(‘HS’),为20世纪70年从安徽引进的优质鲜食品种,现为云南省建水甘薯种植区的主栽品种[16],由云南省建水农业技术推广站提供(表1)。

表1 不同甘薯品种主要营养器官特征
1.2 试验设计
试验在云南农业大学后山试验田内(25.04° N,102.73° E,海拔1950.0m)进行,采用盆栽,盆高35cm,直径40cm;基质为红壤土和腐殖土按1:1比例混匀,株行距为35cm×40cm。2017年6月15日进行扦插,约20d后发根缓苗(7月5日)开始UV-B照射,直至收获结束照射。
将带有防雨灯架的紫外灯安装于田间搭建的网架上,紫外灯管(UVB-40,南京产)波长280~320 nm,辐照强度以灯管至甘薯最高叶面的高度和灯管数量调节,用UV-B型紫外辐照计测量辐照强度(北京产)。灯管高度随植株的生长高度进行调整,同时对照组安装空灯架以使其与处理的自然光照条件一致。设对照(CK:自然光照)、低辐射剂量(T1:在自然光照基础上增加3.6kJ·m−2·d−1)和高辐射剂量(T2:在自然光照基础上增加7.2kJ·m−2·d−1)3个处理,分别相当于昆明地区0%、14.4%和28.8%的臭氧衰减量(以夏至日晴天UV-B辐射强度10kJ·m−2·d−1为背景值),每天照射5h(11:00−16:00)直至收获。每处理重复3次,每重复栽种15株,四周设1行保护行。7月25日第一次取样,此后每隔20d取样一次,整个生育期共取样5次。每次取样于9:00−10:00进行,按处理梯度分别取样,选取主蔓倒6−倒10叶,快速剔除主脉并用锡铂纸包好放入液氮罐中,于实验室内贮存于−80℃冰箱中待用。
1.3 测定项目
1.3.1 甘薯叶片渗透调节物质含量的测定
叶片游离脯氨酸含量(Free Proline Content,FPC)采用茚三酮显色法[17],可溶性蛋白质含量(Soluble Protein Content,SPC)采用考马斯亮蓝G250法[17],可溶性糖含量(Soluble Sugar Content,SSC)采用硫酸−蒽酮法[17]。
1.3.2 甘薯叶片抗氧化酶活性的测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)分别采用SOD-2-Y、POD-2-Y和CAT-2-Y试剂盒测定[18]。
1.3.3 甘薯叶片抗氧化酶比活力的计算
SOD、POD和CAT的比活力均为其酶活力除以可溶性蛋白质含量。
1.4 数据分析
采用Excel2016软件对实验数据进行统计和作图,采用SPSS22.0软件对数据进行单因素方差分析和相关性分析。
2 结果与分析
2.1 UV-B辐射增强下不同甘薯品种叶片中渗透调节物质含量的变化
2.1.1 游离脯氨酸含量
由图1可见,增强UV-B辐射下,‘DZS24’和‘HS’的游离脯氨酸含量(FPC)总体上随辐射时间的增加而降低,但具体看来二者存在较大差异。与对照相比,‘DZS24’在T1、T2处理下的变化趋势与对照一致,而HS在T2处理下的谷值则比对照提前20d。‘DZS24’T1、T2的最大增幅分别出现在第20天(10.79%)和第80天(29.96%),最大降幅分别出现在第40天(18.05%)和第20天(0.56%);‘HS’T1、T2的最大增幅均出现在第60天,分别显著增加了17.55%和23.55%,最大降幅均出现在第40天,分别显著下降了10.60%和41.40%。整个处理过程中‘DZS24’总体上呈T2>CK>T1的趋势,‘HS’大致在前期呈CK>T1>T2,后期呈T1>CK>T2的趋势。相关分析表明,‘DZS24’和‘HS’的FPC与辐射强度的相关系数分别为0.671和−0.771,且均与辐射强度呈显著相关性(P<0.05)。可见,增强UV-B辐射下‘DZS24’的FPC随辐射强度的增加而增加,‘HS’则与之相反。

图1 增强UV-B辐射下不同甘薯品种叶片的游离脯氨酸含量(FPC)
注:小写字母表示处理间在0.05水平上的差异显著性。短线表示标准误差。下同。
Note:Lowercase indicates the difference significance among treatments at 0.05 level. The short bar is standard error. The same as below.
2.1.2 可溶性蛋白质含量
由图2可知,相同辐射下‘HS’和‘DZS24’的可溶性蛋白质含量(SPC)总体上呈低−高−低的变化趋势。具体看来,‘DZS24’T1和T2的最低值(第40天)均比对照(第60天)提前20d,‘HS’(第40天)则均比对照(第100天)提前60d。‘DZS24’T1和T2的最大增幅均出现在第60天,分别增加了24.74%和11.98%;‘HS’的最大增幅均出现在第100天,分别增加了25.86%和22.17%。相同辐射下‘DZS24’的变化幅度总体上小于‘HS’,可见‘HS’的SPC受到的影响更大。相关分析表明,‘DZS24’和‘HS’的SPC与辐射强度的相关系数分别为0.112和0.337,且相关性均不显著。
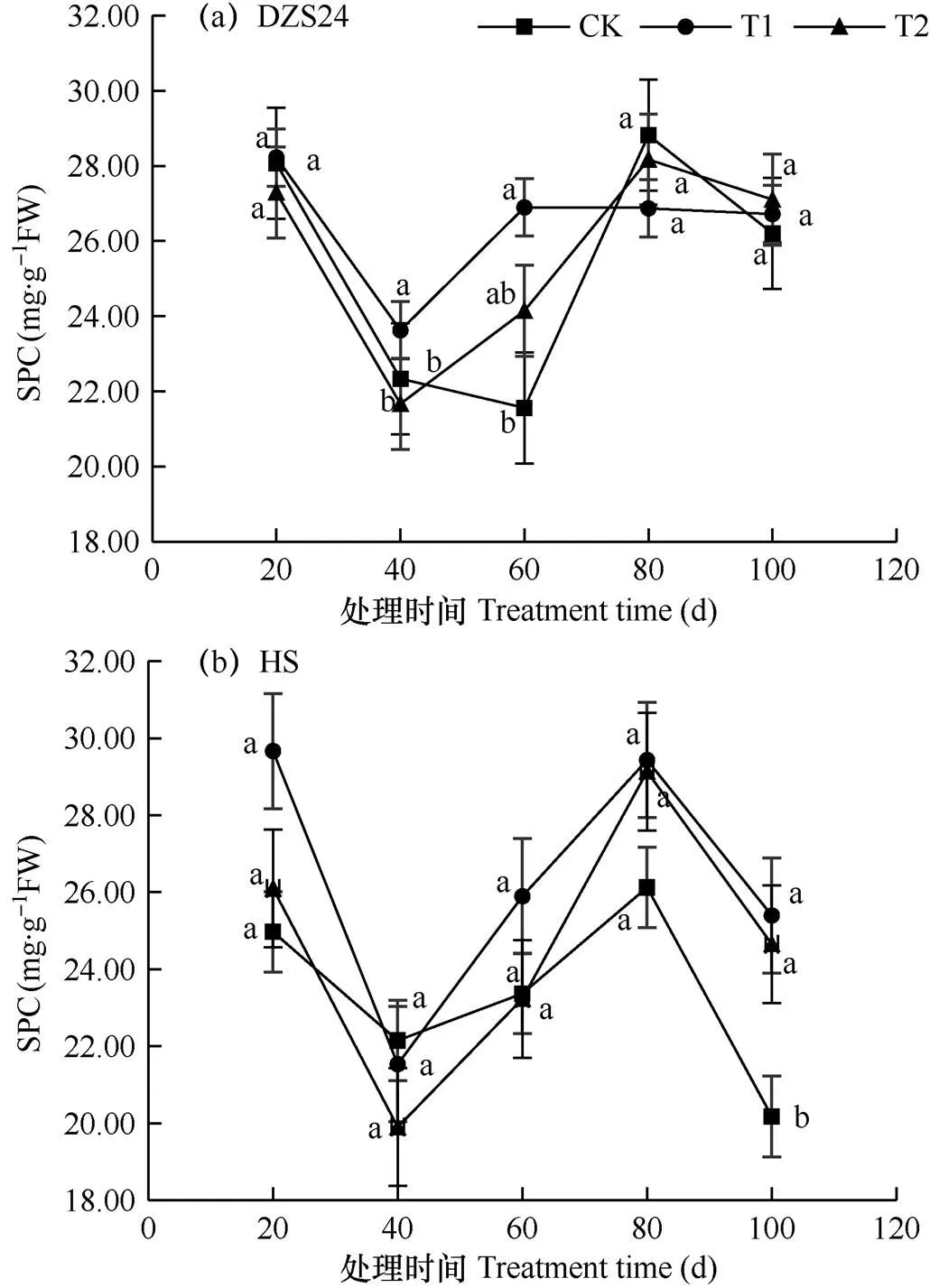
图2 增强UV-B辐射下不同甘薯品种叶片的可溶性蛋白质含量(SPC)
2.1.3 可溶性糖含量
从图3可看出,相同UV-B辐射下‘DZS24’和‘HS’的可溶性糖含量(SSC)总体呈先升高后下降的趋势,整个生育期内均呈CK>T1>T2的趋势,且均显著低于对照。与对照相比,T1和T2处理下‘DZS24’的最大降幅分别出现在第20天(30.13%)和第80天(38.98%),‘HS’的则均出现在第20天(34.79%,29.04%)。相关分析表明,‘DZS24’和‘HS’的SSC与辐射强度的相关系数分别为−0.983和−0.986,且均与对照呈极显著相关性(P<0.01)。增强UV-B辐射下2个甘薯品种的SSC均随辐射强度的增加而下降,且‘HS’的降幅总体上均大于‘DZS24’。

图3 增强UV-B辐射下不同甘薯品种叶片的可溶性糖含量(SSC)
2.2 UV-B辐射增强下不同甘薯品种叶片中抗氧化酶比活力的变化
2.2.1 超氧化物歧化酶比活力SOD
从图4可知,相同辐射下‘DZS24’和‘HS’的SOD比活力都随生育期的增加而下降,但两个品种表现出较大的不同,整个生育期内‘DZS24’的SOD比活力大致呈T2>T1>CK的趋势,而‘HS’波动较大,变化趋势不明显。与对照相比,T1、T2处理下‘DZS24’的最大增幅分别出现在第40天(37.82%)和第60天(88.32%),‘HS’则分别出现在第40天(26.07%)和第80天(64.57%)。T1处理下‘DZS24’的SOD比活力仅第40天时显著升高,‘HS’仅第100天时呈显著降低;T2处理下‘DZS24’的SOD比活力均显著升高,‘HS’在第20天和第80天显著高于对照,第100天显著低于对照。相关分析表明,‘DZS24’和‘HS’的SOD与辐射强度的相关系数分别为0.876(P<0.01)和0.735(P<0.05),可见二者皆与辐射强度密切相关,但相同辐射下‘DZS24’的增幅均明显大于‘HS’。

图4 增强UV-B辐射下不同甘薯品种叶片的超氧化物歧化酶(SOD)比活力
2.2.2 过氧化物酶比活力
‘DZS24’和‘HS’的POD比活力大致呈T1>CK> T2的趋势。但具体看来,不同辐射下呈现出不同的变化趋势,T1处理下‘DZS24’和‘HS’的变化趋势与对照基本一致,总体随辐射时间的增加而升高,T2处理下则均呈先升高后降低的趋势(图5)。与对照相比,T1处理下‘DZS24’和‘HS’的最大增幅均出现在第40天,分别显著增加了1.07倍和92.50%,最大降幅分别出现在第80和20天,分别显著降低了11.28%和76.88%;T2处理下‘DZS24’和‘HS’的最大降幅分别出现在第60天(66.25%)和第80天(83.29%)。T1处理下‘DZS24’仅第40天与对照呈显著差异,‘HS’则均与对照呈显著差异;T2处理下‘DZS24’除第80天外都与对照呈显著差异,‘HS’则除第40天外都与对照呈显著差异。相关分析表明,‘DZS24’和‘HS’的POD与辐射强度的相关系数分别为0.343(P>0.05)和−0.764(P<0.05)。可见相同辐射下‘HS’的变化幅度大于‘DZS24’,POD比活力与辐射强度的关系比‘DZS24’更密切。

图5 增强UV-B辐射下不同甘薯品种叶片的过氧化物酶(POD)比活力
2.2.3 过氧化氢酶比活力
由图6可看出,增强UV-B辐射下‘DZS24’和‘HS’的CAT比活力总体上呈先升高后下降的趋势,但两者存在较大差异,‘DZS24’的CAT比活力呈CK>T2>T1趋势,‘HS’的CAT比活力上下波动较大,趋势不明显。与对照相比,T1和T2处理下‘DZS24’和‘HS’的最大增幅均出现在第20天,分别增加28.14%、37.76%和13.30%、1.64倍,最大降幅分别出现在第80天(33.47%)、第40天(15.00%)、第60天(46.94%)和第100天(36.35%)。T1处理下‘DZS24’在第20−80天与对照呈显著差异,‘HS’仅第60天、第100天与对照呈显著差异;T2处理下‘DZS24’除第20天外均与对照无显著差异,‘HS’仅在第20、40、100天与对照呈显著差异。相关性分析表明,‘DZS24’和‘HS’的CAT与辐射强度的相关系数分别为−0.172和−0.519,二者均与辐射强度无显著相关性。可见UV-B辐射下2品种的CAT比活力均有不同程度的降低,而且T1 图6 增强UV-B辐射下不同甘薯品种叶片的过氧化氢酶(CAT)比活力 植物的渗透调节物质,在抵御逆境胁迫中起着重要作用。本研究发现增强UV-B辐射下除SSC外,‘DZS24’和‘HS’的FPC和SPC均有不同程度的增加,这与郝文芳等[19]的研究结果相似,表明2个甘薯品种均能通过渗透调节来缓解逆境胁迫造成的伤害。脯氨酸是生物体蛋白质的重要组成成分,受到逆境胁迫时,生物体内的脯氨酸会大量积累[20],并且抗逆性强的品种FPC上升更迅速[21],增强辐射初期‘DZS24’的FPC均升高,‘HS’则显著降低,高辐射剂量下‘DZS24’的FPC显著增加,‘HS’总体上均低于对照,说明‘DZS24’更耐UV-B辐射。然而低辐射剂量下‘DZS24’的FPC显著降低,‘HS’则前期显著降低后期显著升高,这可能是由于二者对UV-B辐射的适应性存在种间差异,‘DZS24’的叶片在UV-B辐射初期通过快速增加FPC来缓解逆境伤害导致的渗透压变化,后期随着植株的生长,低强度UV-B辐射对其不构成伤害,而‘HS’叶片前期受逆境胁迫而受到伤害,经过一段时间的适应于后期通过增加FPC来抵抗逆境。SPC的变化主要取决于辐射强度和植物对UV-B的敏感程度[22]。UV-B辐射下‘DZS24’的SPC相对较稳定,而‘HS’则在前期无显著变化,后期显著升高,说明2品种存在种间差异,‘DZS24’对UV-B辐射增强的敏感度小于‘HS’。可溶性糖既是植物体内主要的储能物质,又对逆境条件下的植物细胞起渗透调节作用[23]。本研究中2品种的SSC均显著低于对照且与辐射强度呈极显著负相关,与前人的研究结果相同[24],这可能与增强UV-B辐射使光合作用受到抑制有关。 增强UV-B辐射可导致植物体内的活性氧增加,植物通过增加体内的SOD、POD和CAT等抗氧化酶来清除活性氧,其中SOD是生物体内清除自由基的首要物质,CAT和POD的主要作用是清除H2O2,它们相互协调最大程度地保护细胞[20]。本研究中2品种的SOD比活力均与UV-B辐射强度相关性较高,CAT比活力与UV-B辐射强度无显著相关性,‘HS’的POD表现出较强的累积效应,这一结果与陈宗瑜等[25]的研究结果相似。但‘DZS24’的SOD比活力在低辐射剂量下总体上均无显著变化,高辐射剂量下均显著升高,说明低辐射剂量未对‘DZS24’造成伤害,而在高辐射剂量下‘DZS24’也可通过自身的调节机制适应生长环境。‘HS’的SOD和CAT比活力在增强UV-B辐射下均呈先升高后降低的趋势,这与李惠梅等[26]的研究结果类似,说明增强UV-B辐射下‘HS’体内的膜脂过氧化随辐射时间的延长而加剧,导致膜结构受到破坏,蛋白质和核酸等变性,使其代谢紊乱,抑制了编码SOD和CAT基因的表达量。‘HS’和‘DZS24’的POD比活力在高辐射剂量下显著降低,表明长时间或高剂量UV-B辐射对甘薯叶片的生理生化活动具有一定的抑制作用,钝化相关保护酶的活性[27],但‘DZS24’在辐射后期显著升高,表明‘DZS24’具有较强的自身调节能力,耐受性更强。 综上所述,增强UV-B辐射均对‘DZS24’和‘HS’造成不同程度的胁迫,但其伤害程度因辐射剂量和植物特性不同而异,但总体上增加高剂量UV-B辐射下2品种启动的保护机制作用最强,而在高辐射剂量下‘DZS24’的FPC和SOD比活力显著增加,SPC和CAT比活力无显著变化,SSC的降幅小于‘HS’,POD比活力的变幅小于‘HS’,而‘HS’经过长期辐射后各指标均降低,据此可以推断紫色品种甘薯‘DZS24’更能适应UV-B辐射增强的环境。 [1] 祁虹,段留生,王树林,等.全生育期UV-B辐射增强对棉花生长及光合作用的影响[J].中国生态农业学报,2017,25(5): 708-719. Qi H,Duan L S,Wang S L,et al.Effect of enhanced UV-B radiation on cotton growth and photosynthesis[J].Chinese Journal of Eco-Agriculture,2017,25(5):708-719.(in Chinese) [2] 张海丽.过量表达增强水稻抗UV-B辐射机制的初步研究[D].福州:福建农林大学,2009:1. Zhang H L.Preliminary study on the mechanism of overexpression low silicon rice gene 1() to enhance rice UV-B resistance[D].Fuzhou:Fujian Agriculture and Forestry University,2009:1.(in Chinese) [3] Brown B A,Jenkins G I.UV-B signaling pathways with different fluence-rate response profiles are distinguished in mature Arabidopsis leaf tissue by requirement for UVR8,HY5, and HYH[J].Plant Physiology,2008,146(2):576-88. [4] Mao C X,Chen M M,Wang L,et al.Protective effect of cerium ion against ultraviolet B radiation-induced water stress in soybean seedlings[J].Biological Trace Element Research,2012, 146(3):381-387. [5] Ning W,Peng X,Ma L,et al.Enhanced secondary metabolites production and antioxidant activity in postharvestThunb.in response to UV radiation[J].Innov Food Sci & Emerg Techn,2012,13(1):231-243. [6] 陈贵,胡文玉,谢甫绨,等.提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J].植物生理学通讯,1991,27(1):44-46. Chen G,Hu W Y,Xie P T,et al.Solvent for extracting malondialdehyde in plant as an index of senescence[J].Plant Physiology Journal,1991,27(1):44-46.(in Chinese) [7] 苏贝贝.UV-B辐射对颠茄生理特性及次生代谢产物含量的影响[D].重庆:西南大学,2016:27. Su B B.Effects of UV-B on physiological characteristics and secondary metabolites content of theL.[D].Chongqing:Southwest University,2016:27.(in Chinese) [8] 李晓阳,陈慧泽,韩榕.UV-B辐射对拟南芥种子萌发和幼苗生长的影响[J].植物学报,2013,48(1):52-58. Li X Y,Chen H Z,Han R.Effect of UV-B irradiation on seed germination and seedling growth of[J]. Chinese Bulletin of Botany,2013,48(1):52-58.(in Chinese) [9] 欧阳磊,周冀衡,陈习羽,等.UV-B辐射对烟草形态、光合色素和抗氧化酶活性的影响[J].湖南农业科学,2012,(5):21-23. Ouyang L,Zhou J H,Chen X Y,et al.Effects of UV-B radiation on tobacco morphology and photosynthetic pigments and activity of antioxidant enzyme in tobacco[J].Hunan Agricultural Sciences,2012,(5):21-23.(in Chinese) [10] 彭强,高彦祥,袁芳.紫甘薯及其花色苷的研究与开发进展[J].食品科学,2010,31(23):401-405. Peng Q,Gao Y X,Yuan F.Research progress on purple sweet potato and its anthocyanins[J].Food Science,2010,31(23): 401-405.(in Chinese) [11] 吴春,孙胜敏,姜黎明,等.紫甘薯花青素的功能特性研究[J].化学与黏合,2012,34(6):13-14. Wu C,Sun S M,Jiang L M,et al.Study on functional properties of purple sweet potato anthocyanins[J].Chemistry and Adhesion,2012,34(6):13-14.(in Chinese) [12] 陈宗瑜.云南气候总论[M].北京:气象出版社,2001:47. Chen Z Y.General discussion of Yunnan climate[M].Beijing: China Meteorological Press,2001:47.(in Chinese) [13] 吴杏春,林文雄,郭玉春,等.UV-B辐射增强对水稻叶片抗氧化系统的影响[J].福建农业学报,2001,16(3):51-55. Wu X C,Lin W X,Guo Y C,et al.Effect of enhancing Ultraviolet-B radiation on antioxidant systems in rice seedling leaves[J].Fujian Journal of Agricultural Sciences,2001,16(3): 51-55.(in Chinese) [14] 林文雄.水稻对UV-B辐射增强的生理响应及其分子机制研究[J].中国生态农业学报,2013,21(1):119-126. Lin W X.Physiological responses and molecular mechanism of rice() exposed to enhanced UV-B radiation [J].Chinese Journal of Eco-Agriculture,2013,21(1): 119-126. (in Chinese) [15] 龚燕雄,张贵合,李彩斌,等.紫甘薯新品系在云南不同地区的生长表现及其块根花色苷含量差异[J].云南农业大学学报,2017,32(4):582-587. Gong Y X,Zhang G H,Li C B,et al.Growth performance and content of anthocyanin in new purple sweet potato lines in different regions of Yunnan[J].Journal of Yunnan Agricultural University,2017,32(4):582-587.(in Chinese) [16]孙茂林.云南薯类作物的研究和发展[M].昆明:云南科技出版社,2003:193-194,197. Sun M L.Research and development of potato crops in Yunnan[M].Kunming:Yunnan Science and Technology Press, 2003:193-194,197.(in Chinese) [17] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社, 2006:142-143,144-147,228-230. Gao J F.Experimental instruction in plant physiology[M]. Beijing:Higher Education Press,2006:142-143,144-147,228-230. (in Chinese) [18] 杨鑫,李丽淑,樊吴静,等.诱抗剂对马铃薯疮痂病抗性诱导的生理机制[J].南方农业学报,2018,49(6):1111-1117. Yang X,Li L S,Fan W J,et al.Physiological mechanism of inducers to resistance inducing of potato scab[J].Journal of Southern Agriculture,2018,49(6):1111-1117.(in Chinese) [19] 郝文芳,赵洁,蔡彩虹,等.3种胡枝子抗氧化酶和渗透调节物质对干旱和增强UV-B辐射的动态响应[J].环境科学学报,2013,33(8):2349-2358. Hao W F,Zhao J,Cai C H,et al.Dynamic response of antioxidant enzymes and osmotic adjustment substances to drought and enhanced UV-B radiation in three[J]. Acta Scientiae Circumstantiae,2013,33(8):2349-2358.(in Chinese) [20] 杨璐,赵天宏.UV-B辐射增强对大豆根系活性氧代谢及抗氧化系统的影响[J].华北农学报,2018,33(5):174-180. Yang L,Zhao T H.The effect of enhanced UV-B radiation on soybean root's activate oxygen metabolism and antioxidative system[J].Acta Agriculturae Boreali-Sinica,2018,33(5):174-180. (in Chinese) [21] 邹凯茜,商桑,田丽波,等.低温胁迫对嫁接苦瓜幼苗渗透调节物质的影响[J].热带作物学报,2018,39(8):1533-1539. Zou K X,Shang S,Tian L B,et al.Effects of low temperature stress on osmotic solutes of grafted bitter gourd seedlings[J]. Chinese Journal of Tropical Crops,2018,39(8):1533-1539.(in Chinese) [22] Nedunchezhian N,Annamalainathan K,Kulandaivelu G.Induction of heat shock-like proteins inseedlings growing under ultraviolet-B (280-320nm) enhanced radiation[J].Physiologia Plantarum,2010,85(3): 503-506. [23] 董靖,李红丽,董智,等.H2S对NaCl胁迫下草木樨幼苗生理指标及抗氧化酶活性的影响[J].草业科学,2018,35(10): 2430-2437. Dong J,Li H L,Dong Z,et al.Effect of H2S on physiological indexes and antioxidant activity of sweet clover seedlings under NaCl stress[J].Pratacultural Science,2018,35(10): 2430-2437.(in Chinese) [24] Santos I,Fidalgo F,Almeida J M,et al.Biochemical and ultrastructural changes in leaves of potato plants grown under supplementary UV-B radiation[J].Plant Science,2004, 167(4):925-935. [25] 陈宗瑜,王毅,钟楚.自然和人为条件下UV-B辐射减弱对烟草抗氧化酶活性的影响[J].中国农业气象,2010,31(3): 395-401. Chen Z Y,Wang Y,Zhong C.Effects of solar UV-B radiation on antioxidase activity in tobacco leaf[J].Chinese Journal of Agrometeorology,2010,31(3):395-401.(in Chinese) [26] 李惠梅,师生波.增强UV-B辐射对麻花艽叶片的抗氧化酶的影响[J].西北植物学报,2005,25(3):519-524. Li H M,Shi S B.Effects of enhanced UV-B radiation on antioxydative enzymes inleaves[J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(3):519-524. (in Chinese) [27] 战莘晔,殷红,李雪莹,等.UV-B辐射增强对粳稻光合特性及保护酶活性的影响[J].沈阳农业大学学报,2014,45(5): 513-517. Zhan S Y,Yin H,Li X Y,et al.Effect of UV-B radiation on photosynthetic characteristics and protective enzyme activities ofrice[J].Journal of Shenyang Agricultural University, 2014,45(5):513-517.(in Chinese) Effect Analysis of Anti-UV-B Enhancement of Two Sweet Potato Cultivars MENG Fan-lai1,2, GUO Hua-chun1 (1. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China; 2. Wenshan Academy of Agricultural Sciences in Yunnan Province, Wenshan 663000) The effects of artificial UV-B enhancement on osmoregulation substance contents and specific activity of the antioxidant enzymes and their interspecific differences of the mature leaves of potted ‘Dianziganshu24’(‘DZS24’) and ‘Huishu’(‘HS’) were studied by using colorimetry. The results showed that: under enhanced UV-B, the soluble sugar contents (SSC) significantly reduced with the UV-B enhancement, the soluble protein contents (SPC) decreased at the earlier stage and increased at the later stage with the enhancement for two cultivars. Moreover, the variation range of SSC and SPC of ‘HS’ was larger than that in ‘DZS24’. The free proline contents (FPC) increased in ‘DZS24’ and decreased in ‘HS’ with the enhancement. The specific activity of superoxide dismutase (SOD) and catalase (CAT) increased, while the peroxidase (POD) specific activity decreased with the enhancement for the two cultivars. However, the increasing range of SOD specific activity of ‘DZS24’ was larger than ‘HS’ and the variation range of POD and CAT specific activity was less than ‘HS’ under the same UV-B. Therefore the osmotic regulation and antioxidant capacity of ‘DZS24’ is stronger than ‘HS’ and more suitable for planting in low latitude plateau with the intense UV-B. Sweet potato; UV-B radiation; Osmoregulation substance; Antioxidant enzyme specific activity 10.3969/j.issn.1000-6362.2019.05.003 孟凡来,郭华春.不同甘薯品种抗UV-B辐射增强的效应分析[J].中国农业气象,2019,40(5):293-300 2018−11−26 。E-mail: ynghc@126.com 国家农业产业技术体系(CARS-09-15P) 孟凡来(1983-),博士生,主要研究甘薯栽培及逆境生理。E-mail: zmfk11@163.com
3 结论与讨论
3.1 讨论
3.2 结论

