特利加压素联合白蛋白输注治疗肝肾综合征患者疗效及尿NGAL和KIM-1对疗效的预测价值*
徐曼曼,陈 煜,李 爽
肝肾综合征(hepatorenal syndrome,HRS) 是晚期肝硬化患者众多并发症之一[1-3]。根据疾病进展情况,可将HRS分为两型:即1型是快速进展型肾损伤;2型HRS则表现为缓慢进展性肾损伤[4]。一旦诊断HRS,其预后极差,1型和2型HRS患者中位生存期分别为1个月和6.7个月[5]。目前,特利加压素联合白蛋白输注是治疗HRS患者的首选方案[6],其有效率约为40%~70%[7]。本研究应用特利加压素联合白蛋白输注治疗肝硬化并发HRS患者,观察了尿中性粒细胞明胶酶相关脂质运载蛋白(urine neutrophil gelatinase-associated lipocalin,uNGAL)和尿肾损伤因子-1(urine kidney injury factor-1,uKIM-1)对治疗效果的预测价值。
1 对象与方法
1.1 研究对象 2017年5月1日~2018年4月30日于北京佑安医院住院治疗的肝硬化并发HRS患者19例,男性17例,女性2例;平均年龄为57.1±9.5岁。其中乙型肝炎肝硬化9例,酒精性肝硬化7例,丙型肝炎肝硬化3例。HRS诊断标准:1,明确诊断为肝硬化和存在腹水;2,根据2015年国际腹水俱乐部[6]关于急性肾损伤(acute kidney injury,AKI)的诊断标准,确定存在AKI,即:sCr水平在48 h内升高≥0.3 mg/dl(26.5 μmol/L),在前7d内sCr水平比基线值(确定或推测)升高≥50%。sCr基线值:在过去的3 m内获得的sCr值可作为sCr基线值。如果患者前3 m内多次检测sCr,则采用入院前最近的一次作为基线值。如果不能获得患者先前的sCr,则把入院时的sCr水平作为基线值;3,连续2 d停用利尿剂并输注白蛋白(1 g·kg-1)扩充血容量,患者无应答(肌酐无恢复);4,无休克表现;5,当前或最近未使用过肾毒性药物(如非甾体类抗炎药、氨基糖苷类抗生素、碘化造影剂等);6,无肉眼可见的结构性肾损伤征象,定义如下:无蛋白尿(>500 mg/d)、无微量血尿(>50红细胞/HP)、肾脏超声检查正常。入选标准:肝硬化并发HRS患者,年龄≧18岁,同意参与研究。排除标准:并发甲状腺疾病、恶性肿瘤、近期应用过肾毒性药物或应用过造影剂、有原发或继发性肾脏病、并发尿路感染、存在心肺功能不全或不愿配合治疗者。本研究符合医学伦理学要求,并经医院医学伦理委员会批准,患者或其家属签署知情同意书。
1.2 治疗方法 入组患者均接受肝硬化常规内科综合治疗,给予特利加压素起始剂量0.5 mg加入0.9%氯化钠或5%葡萄糖溶液中静脉滴注,1次/6 h,连续2 d。对未出现早期应答(sCr下降>25%)者,则将特利加压素的剂量加倍,最大剂量为12 mg·d-1(即每4 h静脉给药2 mg)。治疗第4 d时,评估疗效。对无应答或部分应答(sCr有所改善,但仍>1.5 mg/dL)者,则停止治疗;对有应答者,治疗持续至肾功能逆转或最长用药14 d。应用特利加压素期间,监测平均动脉压变化。
1.3 尿液指标检测 取尿液5 ml,置-70℃冰箱冻存。采用ELLSA法测定NGAL和KIM-1(武汉华美生物工程公司)和肌酐。由于随机留取尿会因尿量影响检测结果,经肌酐校正检测结果。分别对尿NGAL和尿KIM-1水平以尿NGAL/尿肌酐(uNGAL/Cr,μg/g)和尿KIM-1/尿肌酐表示。在预实验时,进行了试剂盒的敏感性和稳定性检测,其组内变异<5%,组间变异<10%。具体检测过程如下:(1)将各种试剂移至室温(18~25℃),平衡 30 min;(2)加样:分别设标准品孔、待测样本孔和复孔。每孔分别加标准品或待测尿100 μl,轻轻晃动、混匀,覆上板贴,37℃温育 2 h;(3)弃去液体,甩干;(4)每孔加入生物素标记的抗体(1:100)100 μl,覆上新的板贴,37℃温育 1 h;(5)弃去孔内液,甩干,洗板 3次,每次浸泡2 min,加洗涤缓冲液200 μl/每孔,甩干;(6)每孔加辣根过氧化物酶标记的亲和素100 μl,覆上新的板贴,37℃温育 1 h;(7)弃去孔内液,甩干,洗板 5 次,每次浸泡 2 min,200 μl/每孔,甩干;(8)每孔加入底物液 90 μl,37℃避光显色 15~30 min;(9)每孔加入终止液 50 μl,混匀;(10)在反应终止5 min内,使用酶标仪依序测量各孔450 nm光密度(OD值)。尿KIM-1检测方法同上。结果计算:以标准物的浓度为横坐标,OD值为纵坐标,用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,即为样品的实际浓度。
1.4 统计学分析 应用 SPSS 22.0软件对数据进行统计学分析,对正态分布的计量资料以(±s)表示,采用t检验;对非正态分布的计量资料以中位数(四分位数间距)表示,采用秩和检验;计数资料的比较采用Fisher精确概率计算;采用Spearman检验行相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 入组的19例肝硬化并发HRS患者均为I型HRS。经过特利加压素联合白蛋白输注治疗4 d后,结果应答12例(63.2%),未应答7例(36.8%)。两组患者年龄和性别比较,差异无统计学意义(P=0.605和P=0.386),两组自发性细菌性腹膜炎(SBP)和上消化道出血发生率比较,差异无统计学意义(P=0.526和P=0.525,表1)。两组血清ALT、AST、TBIL、DBIL、BUN、ALB 和血小板计数、血红蛋白、白细胞计数等基线资料比较,差异无统计学意义(P>0.05);应答组患者PTA显著高于非应答组(P=0.006),诊断HRS时血肌酐水平显著低于非应答组(P=0.043),差异均有统计学意义;在诊断HRS时,应答组患者 uNGAL/Cr(μg/g) 和 uKIM-1/Cr(μg/g)均显著低于非应答组(P=0.010和P=0.001);早期应答组患者90 d生存率与非应答组比,差异无统计学意义(P=0.182)。
2.2 相关分析情况 将血肌酐、uNGAL/Cr和uKIM-1/Cr进行Spearman双变量相关分析,结果显示血肌酐与uNGAL/Cr呈正相关,相关系数为0.549(P=0.022),而与uKIM-1/Cr无显著相关,相关系数为 0.213(P=0.411)。
表1 应答与无应答患者临床资料【%,(±s),M(IQR)】比较
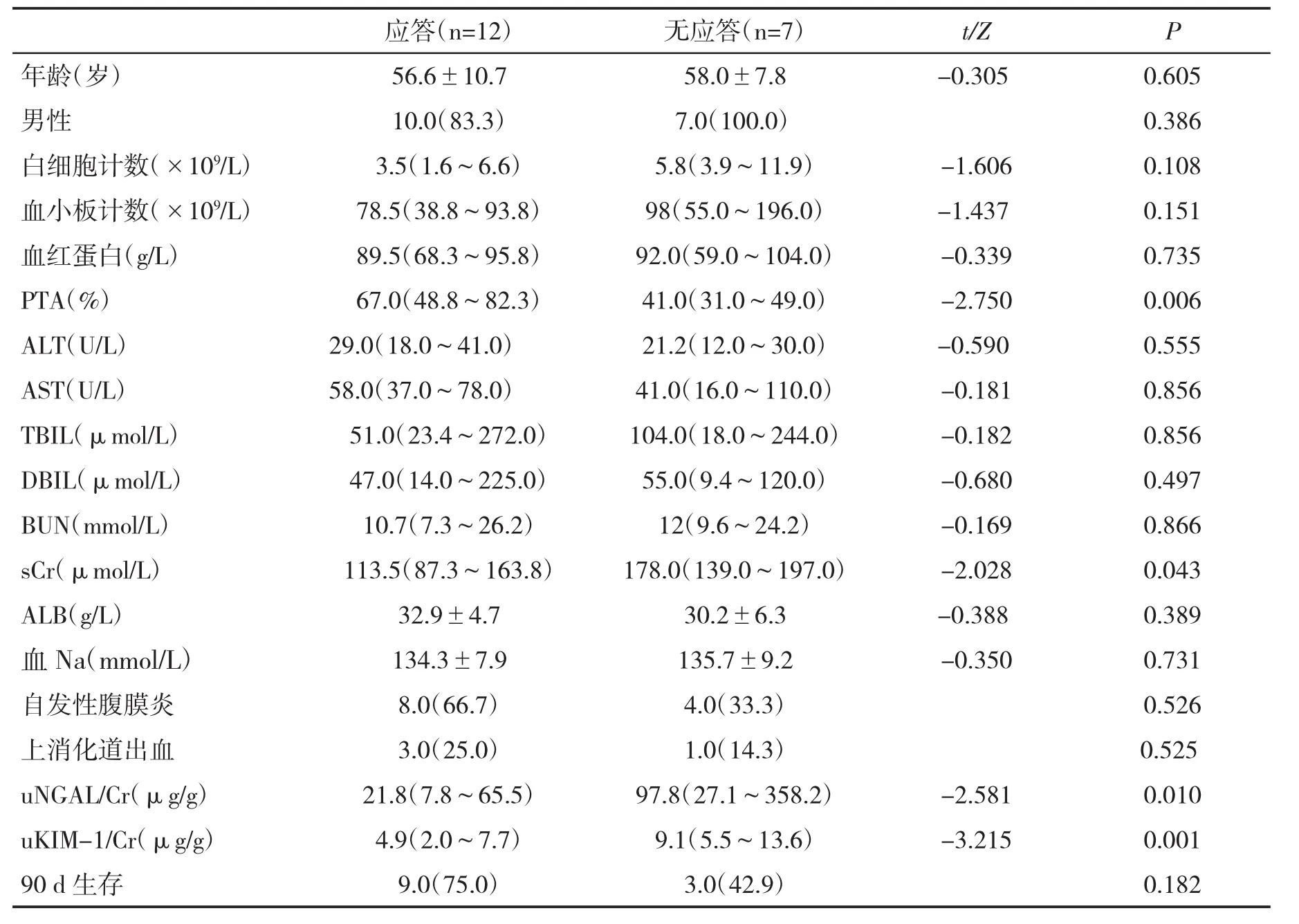
表1 应答与无应答患者临床资料【%,(±s),M(IQR)】比较
应答(n=12) 无应答(n=7) t/Z P年龄(岁) 56.6±10.7 58.0±7.8 -0.305 0.605男性 10.0(83.3) 7.0(100.0) 0.386白细胞计数(×109/L) 3.5(1.6~6.6) 5.8(3.9~11.9) -1.606 0.108血小板计数(×109/L) 78.5(38.8~93.8) 98(55.0~196.0) -1.437 0.151血红蛋白(g/L) 89.5(68.3~95.8) 92.0(59.0~104.0) -0.339 0.735 PTA(%) 67.0(48.8~82.3) 41.0(31.0~49.0) -2.750 0.006 ALT(U/L) 29.0(18.0~41.0) 21.2(12.0~30.0) -0.590 0.555 AST(U/L) 58.0(37.0~78.0) 41.0(16.0~110.0) -0.181 0.856 TBIL(μmol/L) 51.0(23.4~272.0) 104.0(18.0~244.0) -0.182 0.856 DBIL(μmol/L) 47.0(14.0~225.0) 55.0(9.4~120.0) -0.680 0.497 BUN(mmol/L) 10.7(7.3~26.2) 12(9.6~24.2) -0.169 0.866 sCr(μmol/L)113.5(87.3~163.8)178.0(139.0~197.0)-2.0280.043 ALB(g/L) 32.9±4.7 30.2±6.3 -0.388 0.389血 Na(mmol/L) 134.3±7.9 135.7±9.2 -0.350 0.731自发性腹膜炎 8.0(66.7) 4.0(33.3) 0.526上消化道出血 3.0(25.0) 1.0(14.3) 0.525 uNGAL/Cr(μg/g)21.8(7.8~65.5)97.8(27.1~358.2)-2.5810.010 uKIM-1/Cr(μg/g)4.9(2.0~7.7)9.1(5.5~13.6)-3.2150.001 90 d 生存 9.0(75.0) 3.0(42.9) 0.182
3 讨论
本研究结果显示特利加压素联合白蛋白输注治疗HRS患者,应答率为63.2%,与既往研究结果一致[7]。应答组基线血肌酐水平显著低于无应答组,即在肾损伤早期干预的效果更好,已有研究证实血肌酐能够预测特利加压素联合白蛋白的治疗效果[8-12]。有研究显示,基线总胆红素水平[13]、年龄和白细胞计数[14]也可以预测该方案的疗效。
有人在4个队列的298例肝衰竭并发HRS患者,发现经特利加压素联合白蛋白输注治疗,应答率为53%[7]。随着肝衰竭病情加重,其应答率下降。多因素分析结果显示基线血清肌酐水平和肝衰竭分期与治疗效果独立相关。该研究还进一步评估了影响患者90 d病死率的因素,结果显示患者年龄、白细胞计数和肝衰竭分期与90 d病死率相关。肝衰竭严重程度可以预测HRS的治疗效果,本研究结果发现PTA较低的患者治疗效果差,与上述研究结果相一致。
相关分析结果显示尿NGAL与血肌酐水平呈正相关,且同样是肝硬化并发HRS患者治疗效果的预测因素。肝硬化和急性肾小管坏死患者尿NGAL水平明显高于原发性氮质血症和HRS患者。结果显示区分急性肾小管坏死和HRS的尿NGAL截断点为194 mg/g Cr,其灵敏度和特异性分别为91%和82%[15]。有研究结果表明持续性AKI患者尿NGAL显著升高,由此推测尿NGAL可以用以区分肝肾综合征与其他原因引起的肾损伤[16]。KIM-1是一种跨膜管状蛋白,与肾损伤严重程度相关[17,18],与尿NGAL同样可以反映肾小管的损伤程度[19]。有研究表明尿NGAL和尿KIM-1可以预测肝硬化患者并发HRS的发生发展[20]。随着肝硬化并发HRS患者病情进展,治疗效果较差。在本研究中,非应答患者90 d生存率低于应答患者,结合上述研究结果提示对于基础肝功能差和肾损伤程度严重的患者,其生存率较低。由于本研究样本量小,未对上述结果行多因素分析,仍需进一步多中心大样本研究进行证实。

