替诺福韦酯挽救治疗HBV DNA聚合酶区204位点突变的经治慢性乙型肝炎患者疗效及安全性分析*
杨蕊西,刘茗心,陈泠忻,施剑,瞿波
目前,与肝脏有关的疾病仍然是威胁人民健康的重大危险因子之一。迄今为止,世界上有近三分之一的人群曾感染过HBV,慢性HBV携带者约有3.5亿人[1,2]。如果不及时对患者病情进行有效的控制,疾病将会进展为肝硬化或肝癌,直接导致死亡[3]。目前,对于慢性乙型肝炎(Chronic hepatitis B,CHB)患者,主要是采取抗病毒治疗[4]。临床上,抗病毒治疗药物主要有α-干扰素和核苷(酸)类似物[nucleos(t)ide analogues,NAs][5]。在应用 NAs 治疗CHB患者时,随着用药时间的延长,耐药率会逐渐上升。相对而言,恩替卡韦(entecavir,ETV)临床耐药率较低[6]。替诺福韦酯(tenofovir disoproxil fumarate,TDF)是治疗CHB患者的一线用药,常被推荐用于对其他NAs耐药的CHB患者的挽救治疗。本文应用TDF和ETV挽救治疗了HBV DNA聚合酶区204位点突变的CHB患者,观察了治疗效果及其安全性情况。
1 资料与方法
1.1 一般资料 2013年8月~2015年12月我院收治的CHB患者87例,男性62例,女性25例;年龄为28~65岁,平均年龄为(42.4±4.2)岁。诊断符合慢性乙型肝炎防治指南的标准[7]。纳入患者曾接受拉米夫定(LAM)或阿德福韦酯(ADV)治疗6个月以上,血清HBV DNA曾阴转而复阳,且经检测出现rtl204v耐药患者。排除HAV、HCV、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、妊娠期或者哺乳期女性、肝癌或曾经应用ETV或TDF治疗患者。将患者分成两组,两组在性别、年龄和病情等一般资料方面比较,差异无统计学意义(P>0.05),具有可比性。所有患者签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 治疗方法 部分患者接受ETV 1.0口服,1次/d治疗,另一部分患者接受TDF 300 mg口服,1次/d。在治疗过程中,每3个月复查。
1.3 临床检测 采集肘静脉血5 mL,经抗凝后、离心,分离血清,置于-30℃保存。使用全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)检测血生化指标,包括血肌酐(serum creatinine,sCr);采用ELISA法检测血清HBsAg和HBeAg(江苏省南通市伊士生物技术公司);采用实时荧光定量PCR法检测血清HBV DNA定量(检测的最低下限为100 IU/mL)。抽取外周静脉血2 mL,抗凝,使用流式细胞仪(ACEA NovoCyte,艾森生物有限公司)检测CD4+T淋巴细胞计数;常规计算内生肌酐清除率(creatinine clearance,Crcl),依据 sCr水平,计算 Crcl,其计算公式为:男性 Crcl=[(140-年龄)×体质量(kg)]/[0.818×sCr(μmol/L)],女性 Crcl=[(140- 年龄)×体质量(kg)]/[0.818×sCr(μmol/L)]×0.85。
1.4 定义 血清HBsAg和HBeAg转阴为其水平分别低于0.2 IU/mL;病毒学反弹:在治疗过程中曾出现病毒学应答(血清HBV DNA定量<100 IU/mL),但在继续治疗过程中,出现血清HBV DNA定量>100 IU/mL[8]。
1.5 统计学处理 应用SPSS 22.0统计学软件处理数据,计数资料以(%)表示,采用x2检验;计量资料以(±s)表示,采用 t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组生化学、病毒学和血清学应答情况比较在治疗24 w时,TDF治疗组血清ALT复常率显著高于ETV治疗组(P<0.05);在治疗72 w时,TDF治疗组血清HBV DNA阴转、HBsAg阴转和HBeAg转阴率显著高于ETV治疗组(P<0.05,表1)。
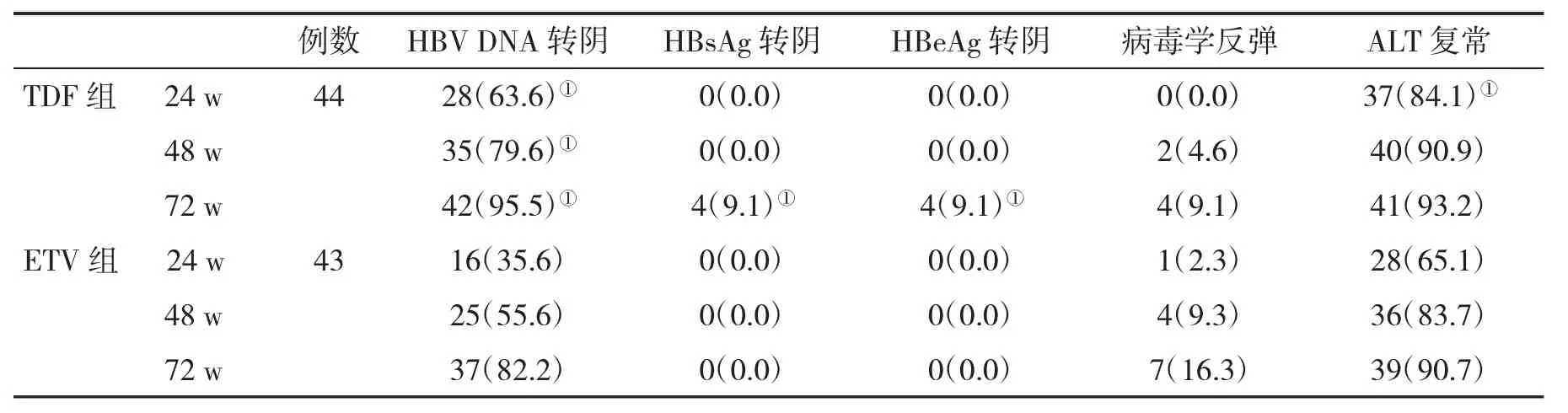
表1 两组生化学、病毒学和血清学应答率(%)比较
2.2 两组外周血T细胞计数和 Crcl变化比较 在治疗过程中,两组外周血T细胞计数和 Crcl变化
差异无统计学意义(P>0.05,表2)。
2.3 两组不良反应发生率比较 两组患者在治疗过程中,个别患者出现恶心、乏力等不适反应,但经过相应的对症处理后,症状缓解,不影响后续治疗。两组不良事件发生率比较,差异无统计学意义(P>0.05,表3)。
表2 两组外周血T细胞计数和Crcl(±s)变化比较

表2 两组外周血T细胞计数和Crcl(±s)变化比较
CD4+T细胞计数(个/μl)Crcl(ml/min)TDF 组 24 w 44 481.5±232.4 101.2±40.1 48 w 536.5±297.5 104.3±26.8 72 w 566.5±321.6 98.7±21.5 ETV组 24 w 43 475.3±229.3 105.2±42.6 48 w 565.8±255.9 102.5±30.6 72 w 565.1±256.5 99.6±26.8
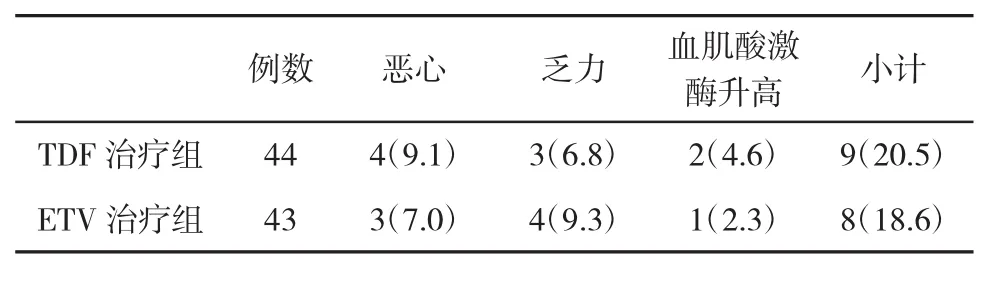
表3 两组不良反应发生率(%)比较
3 讨论
如果HBV感染长期得不到治疗和控制病情,将会进展为严重的肝硬化和肝细胞癌。因此,必须有效地控制CHB患者病情发展。HBV感染发病和疾病进展机制均较为复杂,而长期应用核苷(酸)类抗病毒治疗将会出现耐药性[9]。与耐药相关的HBV突变部位因应用的药物不同而不同,一般认为对LAM耐药者常出现HBV rtl204v单独或混合位点变异[10],而对rtl204v变异的处理往往较为棘手。有学者就耐药性进行的研究表明,应用LAM治疗的CHB患者5年耐药率从65%~70%不等,而应用ADV则为18%~29%,应用替比夫定(Telbivudine,LDT)治疗为11%~25%[11,12]。但是,应用TDF和ETV治疗CHB患者,耐药率发生率非常低[13]。ETV是一种抗HBV感染治疗的一线药物。多个研究认为,ETV对于LAM治疗失败的CHB患者具有显著的补救治疗作用[14]。TDF是一种单磷酸腺苷类似物,在肠内吸收后,随时间延长,其血药浓度升高,抗病毒作用显著,表现为能快速抑制HBV DNA复制,保护肝功能,而耐药率很低[15,16]。基于此,本研究选用TDF和ETV挽救治疗rtl204v位点突变的CHB患者。
在治疗24 w、48 w和72 w时,TDF治疗组血清HBV DNA转阴率显著高于ETV治疗组,血清ALT复常率在早期也优于ETV治疗组,但两组血清HBsAg转阴率、HBeAg转阴率和病毒学反弹发生率均很低,提示无论是ETV还是TDF挽救治疗因对LAM或ADV耐药造成的HBV rtl204v突变感染者均具有很好的效果,但应用TDF治疗,似乎起效更快,且由于应用ETV的剂量较大,不应列为首选。两组均有少量的患者发生病毒学反弹,但总体发生率很低。有学者在对TDF治疗进行研究后发现,TDF进入人体后吸收快,发挥抗病毒作用快,能够有效抑制HBV复制,且无论是初始抗病毒治疗还是挽救治疗经治的CHB患者,均具有高效的抑制病毒效果[17,18]。
ALT是判断肝功能的常用指标。当肝细胞因病毒感染而发生变性、坏死时,肝细胞受到破坏,就会释放ALT,导致其血清水平升高[19]。因此,对于CHB患者的治疗,血清ALT复常率是常用的观察指标之一。在本研究中,在治疗48 w后,两组患者血清ALT复常率都得到了很大的提高,只是在治疗早期,TDF治疗组血清ALT复常率显著高于ETV治疗组(P<0.05),可能是由于TDF更有效地抑制了HBV复制,从而减轻了免疫系统反应对肝细胞造成的损害[20]。
机体的免疫系统在CHB发病过程中起了非常重要的作用。与免疫功能相关的T淋巴细胞亚群更是首当其冲。CD4+T淋巴细胞为T淋巴细胞亚群的主要组成部分。在正常人体,CD4+T淋巴细胞保持平衡状态并维持正常的免疫功能。但当机体感染HBV后,CD4+T淋巴细胞等T细胞亚群发生平衡紊乱[21],表现为CD4+T淋巴细胞减少或CD8+T淋巴细胞增多,导致CD4+/CD4+淋巴细胞比值异常,造成机体免疫系统处于一种抑制状态。本研究两组患者在治疗48 w后,外周血CD4+细胞比例有所上升,之后趋于较稳定的状态,而两组之间相比,并未见显著差异(P>0.05),提示两药治疗对于CHB患者免疫功能并无显著的影响。
已有研究发现,由于TDF经由肾小球排泄,在长期应用TDF治疗CHB患者时,其可能会降低肾小球滤过率,对肾功能造成一定的影响。另有学者认为,应用TDF治疗CHB患者可能发生肾小管损伤、急性肾衰竭、肾性尿崩症等各种肾功能损害的表现。目前,在非常需要应用TDF而又存在肾损害的患者,临床医生是根据患者Crcl来调整用药剂量的。Crcl可以反映肾小球滤过功能和粗略地估计有效肾单位的数量。因此,可以作为判断肾损害的指标。在本研究中,两组患者在治疗过程中Crcl均无显著性变化,也就是说应用两种药物治疗并没有出现明显的肾功能异常,与以往研究结果一致。就两药物的安全性分析发现,虽然两组都有一些轻微的不良反应发生,但是否是应用药物的结果还是病情本身的表现,还难以肯定,且经过及时的对症处理,患者症状均得到缓解,未影响后续治疗,我们认为应用TDF治疗CHB患者,安全性较好。
综上所述,应用TDF挽救治疗因应用拉米夫定或阿德福韦酯治疗导致HBV DNA聚合酶区204位点突变的经治CHB患者,安全有效,表现为能快速显著抑制HBV复制,恢复肝功能指标,病毒学反弹发生率低,对肾功能和外周血T淋巴细胞亚群无显著影响,副反应发生率低。本研究选择了可能导致204位点突变的LAM或ADV治疗的经治患者,结果发现应用TDF挽救治疗,效果很好,结果令人鼓舞。但本研究检测204位点突变的方法可能来自不同的实验室,结果需要扩大印证,且治疗效果方面发现血清HBsAg和HBeAg阴转率较低,而长期治疗的效果还需要进一步观察。

