舒尼替尼治疗转移性胃癌的临床疗效及其对PDGFR和Notch信号通路基因表达的影响
王海燕,闻东
转移性胃癌是胃癌晚期阶段,已失去根治性手术机会,姑息性手术联合术后辅助治疗已成为转移性胃癌主要的治疗方案[1],放化疗辅助治疗有助于增强肿瘤局部控制率,近年来随着医疗技术的进步,对术后辅助治疗方案的报道较多[2-3],但目前临床尚未形成规范指南。舒尼替尼属酪氨酸激酶受体抑制剂,有研究证明舒尼替尼可通过抑制血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)和Notch信号通路基因表达,阻断恶性肿瘤细胞增殖过程,在改善晚期肾癌患者生存率中获得显著效果[4-5],但在转移性胃癌中的报道却很少见。本研究纳入70例转移性胃癌患者作为研究对象,探讨舒尼替尼的治疗效果及对PDGFR和Notch信号通路基因表达的影响。
1 资料与方法
1.1 一般资料
纳入2015年3月至2016年3月本院70例接受姑息性手术的转移性胃癌患者作为研究对象,按入院顺序对患者进行编号,采用随机数字表法将患者分为观察组和对照组,每组35例。两组性别、年龄、体重指数(body mass index,BMI)及肿瘤转移部位比较,差异均无统计学意义(P>0.05),见表1。具有可比性。本研究经本院伦理委员会批准同意。
1.2 入选标准
纳入标准:①均在本院接受择期姑息性手术治疗,并经手术证实为Ⅳ期转移性胃癌[6];②均签署知情同意书。排除标准:①妊娠哺乳期患者;②对治疗药物过敏者;③合并消化道出血、消化性溃疡及其他恶性肿瘤者;④预计生存期小于3个月。
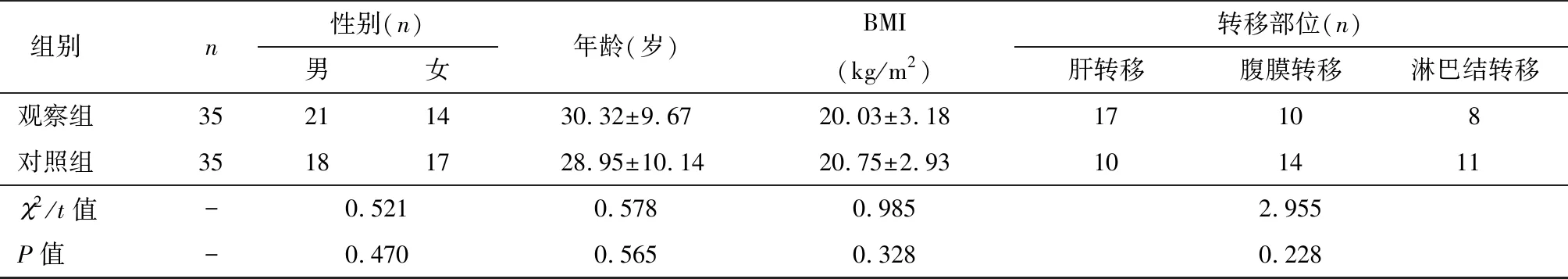
表1 两组患者基本资料比较
1.3 术后辅助治疗方案
两组患者均接受放疗序贯化疗。①放疗计划:患者行CT检查,勾画肿瘤大体肿瘤体积(gross tumor volume,GTV)、临床靶体积(clinical target volume,CTV)及计划靶体积(planned target volume,PTV),GTV为肿瘤转移区域,CTV为GTV外扩1 cm,PTV为CTV外扩1 cm。放疗剂量:1.8~2.0 Gy/次,1次/d,每周连续5 d,放疗总剂量46~52 Gy。②序贯化疗:放疗同时口服替吉奥(山东新时代药业有限公司,25 mg×36 s,国药准字H20080803),50 mg/次,2次/d,连续服用2周为1个疗程,停药1周后再次服用,共3个疗程。观察组在放疗同步序贯化疗基础上再加用舒尼替尼(辉瑞公司,12.5 mg×28 s,国药准字H20090030),口服,50 mg/次,连续服用2周后停药1周为1个周期,共3个周期。
1.4 观察指标
1.4.1 两组疗效和不良反应
疗程结束后记录两组治疗效果[7],完全缓解(complete remission,CR):所有目标病灶消失;部分缓解(partial remission,PR):基线病灶长径缩小≥30%;疾病稳定(stable disease,SD):缩小未达到PR或增加未达到PD标准;肿瘤进展(progression disease,PD):靶病灶最大径增加≥20%或出现新的病灶。以(CR+PR)/总例数×100%计算显效率。记录两组患者治疗期间不良反应发生情况,不良反应严重程度参考美国国家癌症研究所推荐标准进行[8]。
1.4.2 两组PDGFR和Notch1信号通路检测
分别在治疗前(姑息性手术后24 h)和治疗后(放化疗结束后次日)经胃镜取肿瘤组织作为实验标本,采用免疫组化法检测PDGFR和Notch信号通路表达水平,试剂盒由南京安培化工科技有限公司提供,操作按试剂盒说明书进行,记录两组患者PDGFR和Notch1信号通路基因阳性表达率。根据半定量积分法和阳性细胞比计分[9-10],0分:无色,阳性细胞数<5%;1分:浅黄色,5%≤阳性细胞数<25%;2分:棕黄色,25%≤阳性细胞数<50%;3分:棕褐色,50%≤阳性细胞数<75%;4分:阳性细胞数≥75%。以两种计分方法之和来判断结果,阴性(-):得分<2分,阳性(+):2分≤得分<5分;阳性(++):5分≤得分<8分;阳性(+++):得分≥8分。
1.4.3 两组预后比较
在患者出院后进入随访,每2周电话联系1次,询问治疗和生存情况,嘱患者每3个月入院复诊1次,行MRI辅助检查,对于有腹痛、便血等病情进展患者,应提前入院复诊。记录生存情况,两组患者均随访2年,比较两组患者2年累积总生存率。
1.5 统计学方法
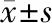
2 结果
2.1 两组疗效比较
观察组显效率为22.86%,显著高于对照组的5.71%,差异有统计学意义(P< 0.05),见表2。
2.2 两组不良反应比较
两组治疗期间贫血、白细胞减少、胃肠道反应、口腔黏膜炎及皮肤毛发改变严重程度比较,差异无统计学意义(P>0.05),见表3。
表2 两组患者疗效比较 [n(%)]
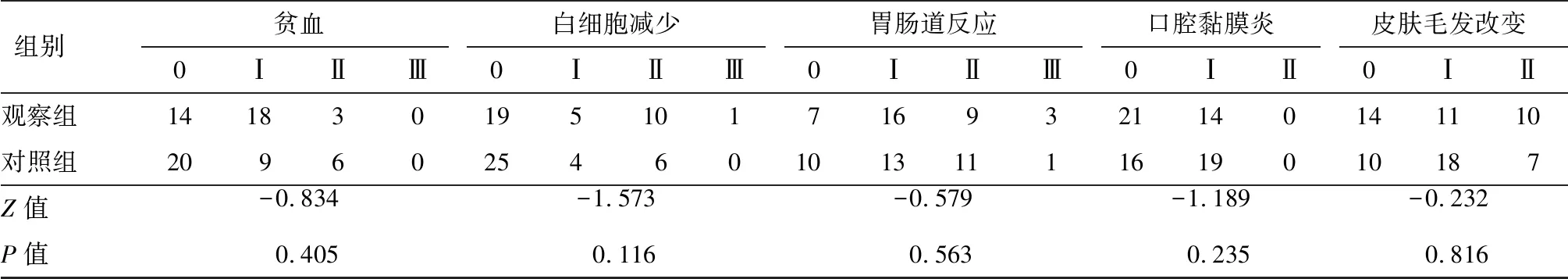
表3 两组不良反应比较(n)
2.3 两组PDGFR比较
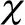
表4 两组PDGFR比较(n)
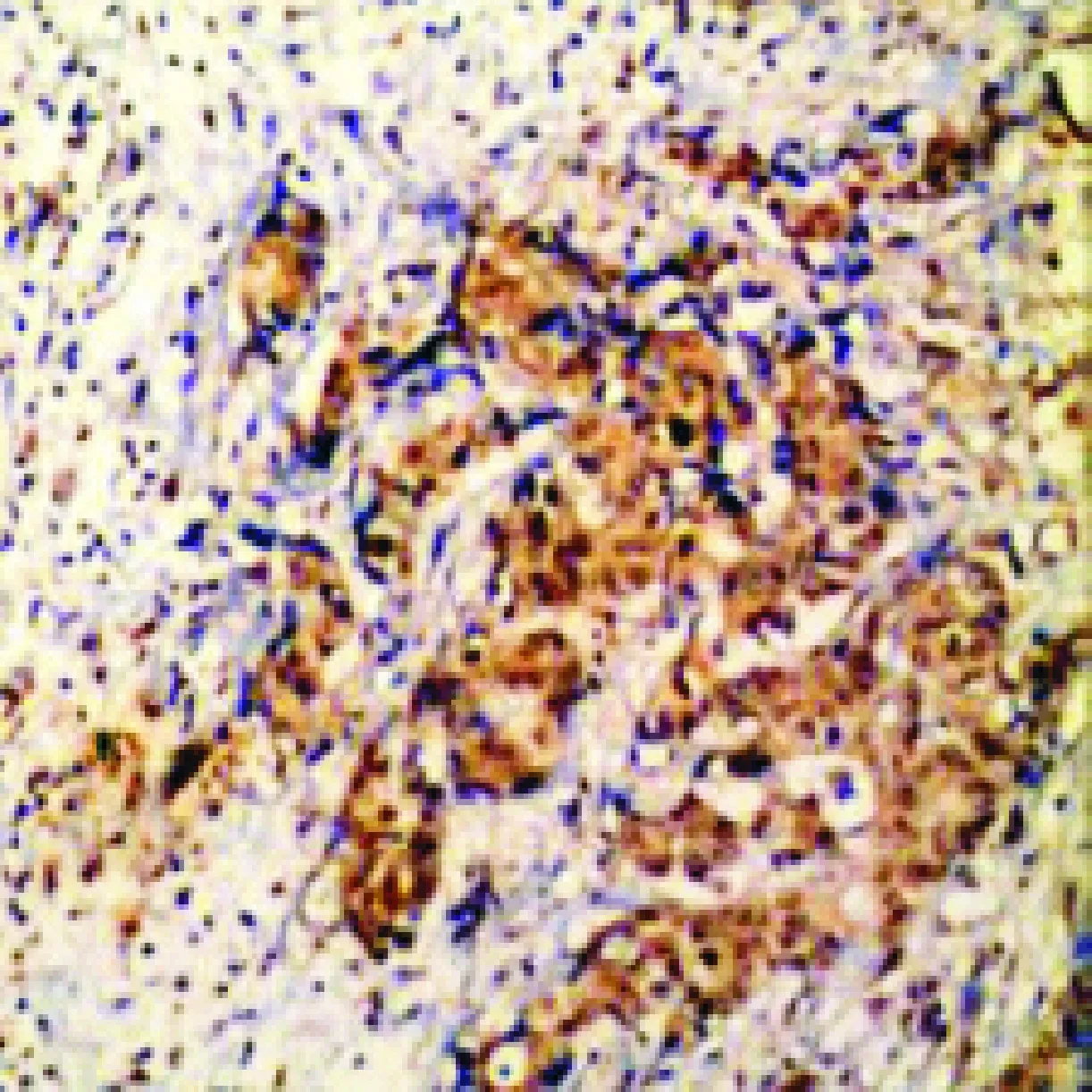
图1 免疫组化检测PDGFR蛋白阳性(×400)
2.4 两组Notch1信号通路基因比较
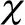
图2 免疫组化检测PDGFR蛋白阴性(×400)
图3 免疫组化检测Notch1信号通路阳性(×400)
2.5 两组预后比较
图4 免疫组化检测Notch1信号通路阴性(×400)
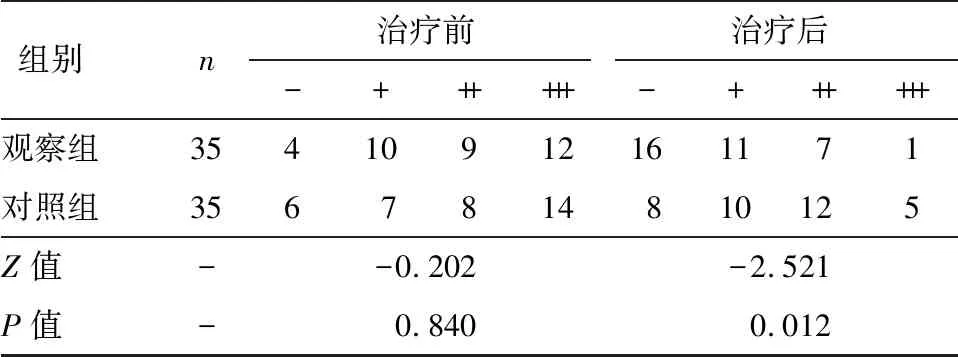
组别n治疗前治疗后-++++++-++++++观察组35410912161171对照组3567814810125Z值--0.202-2.521P值-0.8400.012
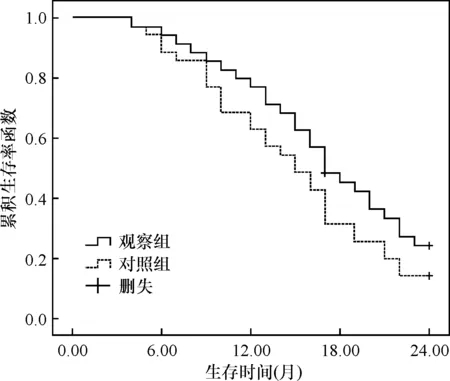
图5 两组2年累积生存函数比较
3 讨论
转移性胃癌患者已处于肿瘤晚期,肿瘤细胞发生远处转移,预后较差,如何延长转移性胃癌患者生存时间是目前临床治疗难点。目前多认为对于转移性胃癌患者,术后进行放化疗辅助治疗能发挥协同抗肿瘤作用[11-12],对于控制肿瘤进展具有重要意义。三维适形放疗能有效控制肿瘤进展,已被纳入指南,作为胃癌的基础治疗方法[13]。替吉奥是氟尿嘧啶的衍生物,但抗肿瘤作用更强,在姑息性手术后行三维适形放疗联合替吉奥序贯化疗能抑制术后肿瘤增殖,降低复发转移率[14]。熊慧如等[15]对晚期胃癌患者采用局部序贯化放疗较单纯化疗显著延长了患者的生存时间,提示替吉奥序贯化疗联合放疗对晚期转移性胃癌有效。
舒尼替尼通过阻断酪氨酸激酶磷酸化,抑制肿瘤血管增殖[16],进而达到抗肿瘤目的。动物实验还证实舒尼替尼可通过抑制胃癌BGC-823细胞[17],从而诱导肿瘤细胞凋亡。药代动力学研究发现舒尼替尼在服药12h后血药浓度达到峰值,连续给药2周后血药浓度达到稳定状态[18]。因而,本研究在放疗联合序贯治疗基础上加用2/1舒尼替尼方案,结果显示观察组显效率显著优于对照组,提示舒尼替尼有助于提高转移性胃癌患者治疗效果。但本研究随访发现两组2年累计生存率并无显著性差异,提示舒尼替尼对改善转移性胃癌患者预后的作用仍有限。但本研究随访时间较短,且纳入样本量较小,舒尼替尼对转移性胃癌患者远期预后的影响仍有待进一步研究。另外,本研究观察了两组患者治疗期间不良反应发生情况,结果显示两组各项不良反应严重程度差异均无统计学意义,与潘秀武等[19]报道一致,提示舒尼替尼并不显著加重不良反应,具有较高的安全性。
PDGFR属单链膜糖蛋白,既往研究显示PDGFR可介导酪氨酸信号传导,从而加快肿瘤细胞外基质的降解代谢,促进肿瘤内皮细胞和间质细胞增殖和血管形成[20-21]。Notch1是肿瘤细胞间相互联系的重要信号通路,通过与Jagged1配体结合,使下游正核因子κB激活[22-23],进而促进肿瘤细胞增殖。陈浩洋等[24]也认为Notch1信号通路活化可促进胃黏膜癌变过程,Notch1阳性表达率与胃癌病理分期相关。本研究也显示治疗后观察组PDGFR和Notch1阳性率显著低于对照组,提示降低PDGFR和Notch1阳性表达率可能是舒尼替尼发挥抗肿瘤作用的机制之一。但临床也有报道显示Notch1对胃癌可能具有双重效应[25],目前有关Notch1信号调控肿瘤血管和功能的分子机制尚不明确,这有待进一步深入研究。
综上,舒尼替尼用于转移性胃癌较常规治疗能提高肿瘤控制率,具有较高的安全性,这可能与舒尼替尼降低PDGFR和Notch1信号通路阳性率有关。

