低温高湿解冻改善猪肉品质特性
彭泽宇,朱明明,2,3*,张海曼,姚东昊,马长明,何鸿举,王正荣,赵圣明,康壮丽,马汉军
1(河南科技学院 食品学院,河南 新乡,453003)2(河南科技学院 畜禽产品精深加工与质量安全控制河南省工程技术研究中心,河南 新乡,453003)3(国家猪肉加工技术研发专业中心,河南 新乡,453003)4(中国农业大学 食品科学与营养工程学院,北京,100000)5(河南省商业科学研究所,河南 郑州,450002)
中国是生产猪肉的大国,自古以来形成的饮食习惯也决定了猪肉消费的主体地位[1-2]。低温冷冻因其可减缓表面微生物生长和品质劣变的速度而成为应用最广泛的贮藏方式,为猪肉及其肉制品贸易进出口和在全国各地区相互流通提供了技术保障[3-4]。而解冻是冻藏肉在加工或食用前最重要的一个步骤,也是保证冻藏肉最终品质的关键因素之一。为保证原料肉的质量,选择适宜的解冻方式尤为重要。
当前国内外研究的解冻方式有很多,空气解冻和水解冻是较传统且应用广泛的2种解冻方式[5]。其中空气解冻优点是操作较简单且成本较低,但解冻时间较长,容易出现肉品表面微生物增殖过快和肉品汁液流失等问题[6]。水解冻解冻时间较短,但存在解冻后微生物污染及色泽变化等问题[7]。近年来,随着科学技术的发展,出现了一些新型解冻方式,如微波解冻、欧姆加热解冻、高压静电解冻等[8-10]。较传统解冻方法,其优点是解冻效率高,但由于其工艺更复杂、成本更高且设备要求更高等原因,造成其在应用上有很大的局限性[11]。因此,开发能投提高解冻效率,保证解冻肉品质又经济实用的解冻方式并优化解冻参数,对于肉类加工行业意义重大。
低温解冻因其温度低,可有效防止腐败微生物滋生并减少解冻肉品质损耗而广泛用于肉类企业[12-14]。但由于其解冻时间较长导致解冻效率低下,水分损失严重,蛋白、脂肪出现氧化等品质劣变现象。因此高湿低温解冻逐步出现在大众的视野里,其既保留低温解冻的优点,同时又利用高湿环境提高解冻效率,减少汁液损失,改善解冻肉品质[15]。之前已有研究表明高湿低温解冻对牛羊肉及鸡肉品质影响较小[16-19],但国内外有关高湿低温解冻对猪肉品质特性的报道很少。因此,本试验以鲜肉和传统低温(4 ℃, RH65%~73%)解冻作为对照,通过分析解冻猪肉保水性、嫩度、新鲜度等指标并利用动态流变特性来优化低温条件下(4 ℃),猪肉解冻的最适湿度参数,旨在改善解冻后猪肉品质,为新型解冻技术的应用提供技术支持。
1 材料与方法
1.1 主要材料及试剂
新鲜的猪背最长肌(品种:杜洛克×长白×大白),河南高金食品有限公司;营养琼脂(NA)培养基,青岛海博生物技术有限公司;其他分析纯试剂,国药集团化学试剂有限公司。
1.2 仪器
CTHI-150B恒温恒湿箱,上海施都凯(STIK)仪器设备有限公司;YXQ-LS-50SII立式压力蒸汽灭菌锅,上海博迅(Boxun)医疗生物仪器股份有限公司;pH计,上海仪电科学仪器(INESA)股份有限公司;CR-400色差计,日本美能达(KONICA MINOLTA)公司;XHF-D高速分散器,宁波新芝(SCIENTZ)生物科技股份有限公司;高速冷冻离心机,安徽中科中佳(ZONKIA)科学仪器有限公司;C-LM4型肌肉嫩度仪,东北农业大学工程学院;XY300-2C型号电子天平,常州市幸运电子设备有限公司;L93-3温度自动记录仪,路格科技(杭州)有限公司。
1.3 试验方法
1.3.1 冻结处理
在无菌室中,将猪背最长肌((2.9±0.1) kg)表面多余的结缔组织以及脂肪剔除后,按照垂直于肌纤维的方向将其分切成规格相近似的肉块(质量:(150±5) g; 6 cm×5 cm×3.5 cm),采用自封袋(120 mm×170 mm)分装后,随机将其分成6组,每组5份样品,并任选一组作为鲜肉对照,直接测定其各项指标。剩余各组-18 ℃ 冷冻并冻藏24 h。
1.3.2 解冻处理
冻藏结束后,将样品组取出,并测定其中心温度(-18 ℃)。随后随机选取一组采用传统低温(4 ℃;经测定RH为65%~73%)方法解冻,其余各组放置于恒温恒湿培养箱中采用低温(4 ℃)不同湿度(RH80%、85%、90%、95%)解冻,直至到达解冻的终点(样品中心温度为2 ℃),表明解冻结束。
1.3.3 解冻时间的测定
参考THANONKAEW等[20]的方法,用尺子测量肉样表面到中心的最短距离,用钉子在最短距离的表面钉一个孔道,将数字温度记录仪的探头插入肉样的中心部位。记录样品中心温度随时间的变化,时刻观察猪肉的中心温度,以中心温度2 ℃为解冻终点。
1.3.4 汁液损失的测定
参考HONIKE[21]的方法进行测定。准确称取解冻前肉样的质量(W1),待解冻完全后,用吸水纸吸去肉样表面的水分并准确记录称量并得到解冻后肉样的质量(W2)。通过公式(1)计算:
(1)
1.3.5 蒸煮损失的测定
参照LI等[22]的方法。准确称取(10±0.5) g肉样(3 cm×3 cm×1 cm)并记录为W3,将温度计插入到肉样中心部位后,肉样放入自封袋中并扎紧袋口放入80 ℃恒温水浴锅中。待到样品中心温度达到70 ℃时取出并冷却到室温,吸去蒸煮后肉样表面的水分并称量记录为W4。计算公式如式(2):
(2)
1.3.6 色差的测定
参考夏秀芳等[23]的方法进行测定。使用CR-400色差计测定鲜肉和解冻肉样表面的L*、a*、b*值。测定前对色差计进行校准,白板L*、a*、b*值分别为97.22、-0.14、1.82。色差计的标准观察者:近似2°角;光源:C;孔径:8 mm。检测每个样品的5个位点,尽量使样品之间的测定位点一致,减小误差。
1.3.7 剪切力的测定
参考常海军等[24]的方法,将测完蒸煮损失的肉块沿肌肉纤维方向分割成1 cm×1 cm×2 cm的立方体,使用肌肉嫩度仪并沿垂直肌纤维方向剪切样品,并记录其剪切力值(N)。
1.3.8 脂质过氧化(TBARS)的测定
参考XIONG等[25]的方法并加以修改。具体操作如下:取10 g肉样,与50 mL 75 g/L三氯乙酸(TCA)混匀,振摇30 min,双层滤纸过滤2次后,加入5 mL 0.02 mol/L TBA溶液并沸水浴40 min,取出后冷却1 h,5 500 r/min离心25 min,保留上清。向上清液中加入5 mL氯仿,摇匀静置分层,取上清在532 nm处比色。计算公式如式(3):

(3)
其中:A532为待测液在532 nm下的吸光度值;Ws为肉样品的质量,g。
1.3.9 新鲜度的测定
本试验主要通过pH值、细菌菌落总数、挥发性盐基氮(TVB-N)和电导率4个指标综合评价解冻猪肉的新鲜度。pH值:检测前,使用pH 6.8、4.0的标准缓冲液校准pH计。参考GB 5009.237—2016[26]的方法进行测定。菌落总数:参考GB 4789.2—2016[27]测定菌落总数。TVB-N:参考GB 5009.228—2016半微量定氮法测定TVB-N值[28]。电导率的测定:参考杨秀娟等[29]的方法测定电导率。
1.3.10 动态流变学特性的测定
参考朱东阳等[30]的方法,利用流变仪测定样品的热动态流变性。
1.4 数据分析
所有处理重复5次,使用SPSS 18.0(SPSS Inc.,USA)进行数据的统计分析,并对试验数据采用单因素方差分析(ANOVA)进行分析。当P<0.05时,认为组间差异显著。
2 结果与分析
2.1 不同解冻方式下猪肉中心温度的变化
猪肉中心温度随解冻时间的变化代表了样品的解冻速率,从侧面反映出解冻的进程。由图1可知,高湿低温解冻的速率明显高于传统低温解冻,且随着相对湿度的增加而升高。以中心温度上升至2 ℃作为完全解冻的判定点。猪肉采用低温(4 ℃)RH80%、85%、90%、95%解冻所需时间平均分别为11、10、9、8 h,显著快于传统低温解冻(17 h),表明高湿低温解冻可有效缩短解冻时间,提高解冻效率。这主要是由于较低的环境温度下,热传递速率较慢,而增加空气湿度后,使得导热加快,促进冰晶融化[31]。

图1 低温不同湿度解冻条件下猪肉中心温度的变化曲线Fig.1 Changing curves in central temperature of pork samples under low temperature with different humidity thawing conditions
2.2 低温不同相对湿度解冻对猪肉汁液损失的影响
图2表明低温不同湿度解冻对汁液损失影响差异显著(P<0.05),其中RH90%、95%处理后汁液损失最低,传统低温解冻后汁液损失最高,可能是由于高湿度条件下,一方面缩短了解冻时间,减少干耗现象;另一方面有效地保护了肉样的蛋白水合面,降低表面水分蒸发[18]。目前有关解冻降低肉样保水能力原因的报道众多,有研究认为经解冻处理,蛋白质发生氧化变性,生成羰基和二硫键,导致肌肉蛋白结构改变,降低保水能力[32-33];夏秀芳等[23]则认为解冻后肌肉蛋白质的静电荷减少,导致蛋白分子聚集使得水分挤出而造成汁液流失;也有报道认为解冻后冷冻肉的肌纤维收缩,肌束空隙变大,破坏其致密结构,导致保水能力下降[34]。

图2 低温不同湿度解冻对猪肉汁液损失的影响Fig.2 Effect of different relative humidity thawing on thawing loss of pork注:标记有不同字母的数据间有显著性差异(P<0.05)。数据的表示形式为平均值±标准误差。
2.3 低温不同相对湿度解冻对猪肉蒸煮损失的影响
由图3可知,经不同解冻处理后肉样的蒸煮损失较鲜肉均呈现出显著变化(P<0.05),这主要是由于猪肉在冷冻过程中形成的冰晶对肌肉组织造成机械损伤所致[13]。其中传统低温解冻引起的蒸煮损失最高,因为猪肉在此方式下解冻时间最长。而低温高湿解冻的蒸煮损失均显著低于传统低温,且随着湿度增加至90%,蒸煮损失显著降低(P<0.05),而随着湿度继续增加,则无明显变化(P>0.05),这与汁液损失结果一致,表明低温高湿(4 ℃,RH≥90%)可有效提高解冻猪肉的保水能力。

图3 低温不同湿度解冻对猪肉蒸煮损失的影响Fig.3 Effect of different relative humidity thawing on cooking loss of pork注:标记有不同字母的数据间有显著性差异(P<0.05);数据的表示形式为平均值±标准误差。
2.4 低温不同相对湿度解冻对猪肉色泽的影响
猪肉色泽对于其外观有重要作用,直接影响消费者的可接受性。不同解冻处理对猪肉色泽的影响如表1所示,主要通过L*、a*和b*值来衡量。经低温RH85%、90%、95%解冻后,猪肉的L*、a*和b*值接近鲜肉水平(P>0.05),其中RH90%、95%解冻后,处理组的L*值和a*值显著高于传统低温解冻,b*值显著低于传统低温解冻(P<0.05),表明低温环境下,相对湿度达到90%以上解冻可有效缓解肉样色泽的改变。张昕等[15]发现高湿低温解冻可提高鸡肉的亮度值和红度值,邸静等[35]结果也表明高湿低温解冻可有效维持牛肉的L*值,与本试验结果相似。分析原因可能是由于高湿处理后,有效维持猪肉保水性的同时缩短了解冻时间,避免肉样与空气接触时间过长,从而抑制肌红蛋白的氧化变性(a*值下降的原因)和脂肪的氧化(b*值升高的原因)[36]。

表1 不同湿度解冻对猪肉色泽的影响Table 1 Effect of different relative humidity thawing on color of pork
注:同一行中标记有不同字母的数据间有显著性差异(P<0.05);数据的表示形式为平均值±标准误差。
2.5 低温不同相对湿度解冻对猪肉嫩度的影响
肌肉嫩度是决定消费者重复购买的重要品质属性,常用剪切力表示。由图4可知,与鲜肉相比(43.45 N),经不同解冻后猪肉的剪切力值均显著升高(P<0.05),原因是在冷冻结过程中,随着温度的降低和时间的延长样品中产生的冰晶也会增大,从而减小猪肉的可塑性[34]。不过相较于传统低温解冻,低温高湿解冻后猪肉的剪切力值显著降低(P<0.05),而且剪切力值随着湿度的升高逐渐减小,表明嫩度增加。当相对湿度达到85%后剪切力值无明显变化(P>0.05),表明高湿环境有利于维持猪肉的嫩度。

图4 低温不同湿度解冻对猪肉剪切力的影响Fig.4 Effect of different relative humidity thawing on shear force of pork注:标记有不同字母的数据间有显著性差异(P<0.05);数据的表示形式为平均值±标准误差。
2.6 低温不同相对湿度解冻对猪肉脂质过氧化(TBARS)的影响
低温不同相对湿度条件下解冻后测定了猪肉的TBARS值,结果如图5所示,其值越大代表脂肪氧化程度越大。与鲜肉相比,猪肉经传统低温解冻后TBARS值明显升高(P<0.05),可能是由于解冻时间过长所致[34]。而经过低温高湿解冻后猪肉的TBARS显著低于传统低温解冻(P<0.05),且随着湿度增加而逐渐降低。当相对湿度达到85%~95%时,猪肉的TBARS值接近鲜肉水平(P>0.05),表明低温RH≥85%解冻可有效抑制脂肪氧化程度。从TBARS和色泽的结果可看出猪肉黄度值变化与脂肪氧化程度一致[35]。

图5 低温不同湿度解冻对猪肉TBARS的影响Fig.5 Effect of different relative humidity thawing on TBARS of pork注:标记有不同字母的数据间有显著性差异(P<0.05);数据的表示形式为平均值±标准误差。
2.7 低温不同相对湿度解冻对猪肉新鲜度的影响
pH值的变化可使蛋白质分子间产生静电荷效应,从而显著影响肉的色泽、持水力和货架期[37]。由图6-A可知,低温高湿解冻和传统低温解冻处理对猪肉pH值无显著影响,与鲜肉值接近(P>0.05),与余力等的研究结论一致[34]。其中传统低温解冻的pH值(6.06)最高,原因可能是解冻时间最长,促使蛋白质在酶及微生物的活动下降解生成氨、胺等碱性物质所致[34]。随着解冻温度升高、解冻时间延长,容易造成微生物污染,促使猪肉成分和感官特性发生变化,导致有毒有害物质产生。如图6-B所示,经不同解冻处理后猪肉的菌落总数均显著高于鲜肉(P<0.05)。其中在低温环境下,RH95%解冻后样品的菌落总数(3.97 lg CFU/g)显著高于其他湿度条件下,而接近于传统低温解冻(P>0.05),分析原因可能是,随着解冻环境湿度增加,微生物活动增强,不过微生物数量仍未超标,可安心食用[13]。TVB-N值是衡量动物性食品蛋白质分解的重要指标。由图6-C可知,低温环境中,RH95%解冻和传统低温解冻处理后肉样的TVB-N值最高,这与菌落总数结果相一致,主要是由于腐败菌的滋生诱发TVB-N增加,预示着腐败程度增加。随着猪肉新鲜度的下降,其自身成分会发生变化,反应产物中出现大量导电性物质,导致电导率升高,因此电导率也成为检验猪肉新鲜度的重要指标[29]。如图6-D所示,经不同解冻处理后,猪肉的电导率均显著高于鲜肉(P<0.05),但都在1 370 μs/cm以下,属于一级鲜肉[29]。同样地,经不同湿度解冻处理后,电导率值的变化趋势基本与TVB-N和菌落总数相一致。
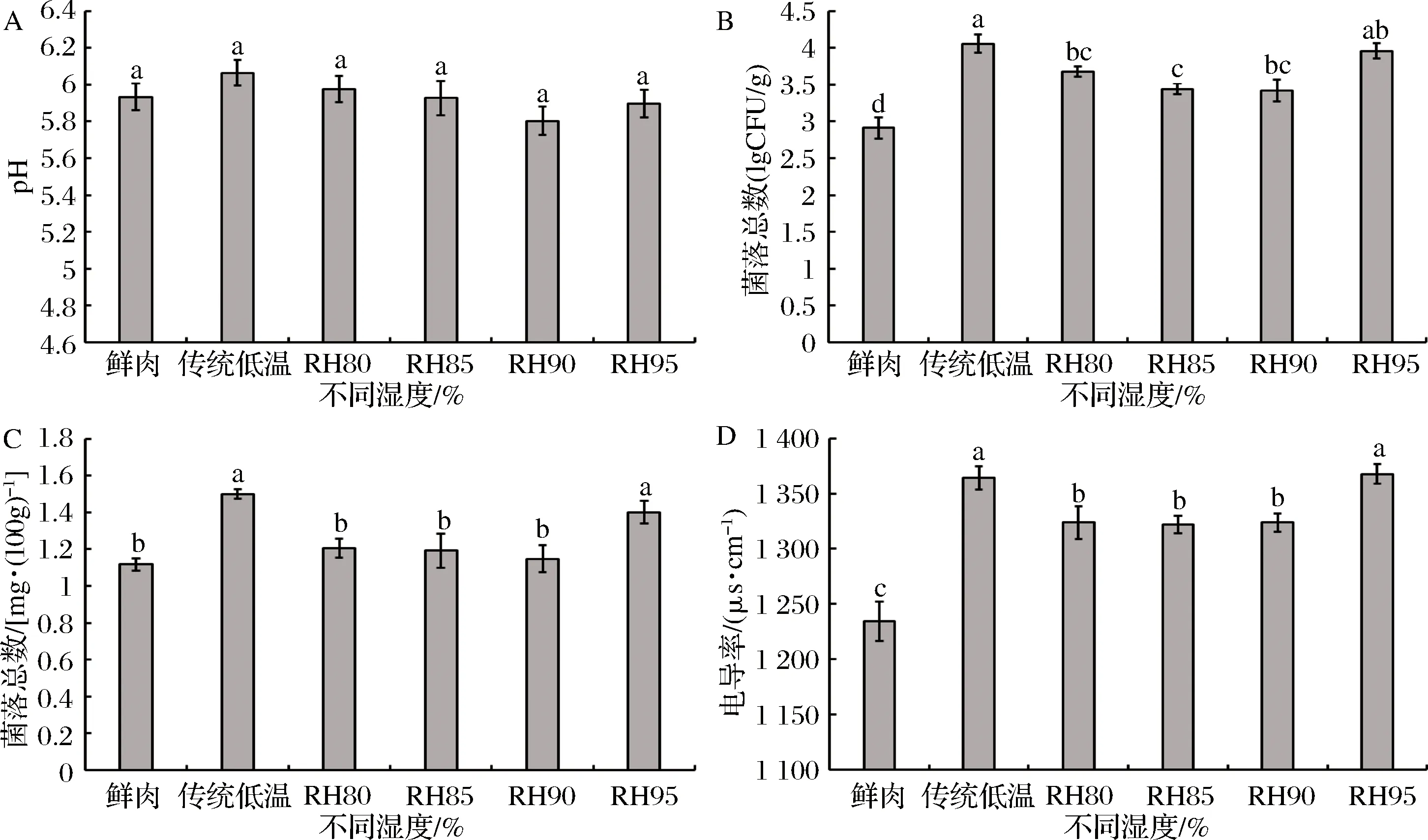
图6 低温不同湿度解冻对猪肉pH(A),菌落总数(B),TVB-N值(C)和电导率(D)的影响Fig.6 Effect of different relative humidity thawing on pH (A), total bacteria counts (B), TVB-N (C) and electrical conductivity (D) of pork注:标记有不同字母的数据间有显著性差异(P<0.05);数据的表示形式为平均值±标准误差。
2.8 低温不同相对湿度解冻对猪肉动态流变学特性的影响
近年来,动态流变试验常用来检测肌纤维蛋白的热诱导凝胶性,尤其是用G′来表示样品在剪切过程中的储能模量,可从侧面反映蛋白品质[38]。低温不同湿度解冻后猪肉样品G′值的变化如图7所示。于鲜肉而言,其G′值的变化与文献报道一致[39-40],大致分为4个阶段:20~44 ℃,G′有下降趋势,但不明显;45~51 ℃,因猪肉蛋白互作增强促使G′增加;52~56 ℃,G′因肉样中的肌球蛋白尾部发生变性而轻微下降;57~80 ℃,由于温度升高引发蛋白质聚集、交联,粘性胶体转变为有弹性的凝胶网络结构导致G′迅速升高。

图7 低温不同湿度解冻对猪肉储能模量(G′)的影响Fig.7 Effect of different relative humidity thawing on the dynamic storage modulus (G′) of pork
由图7可知,经不同解冻处理后,G′的变化趋势与鲜肉相似,但其值(80 ℃时为22.45~26.36 kPa)明显降低,表明凝胶结构遭到破坏,主要原因是解冻过程中蛋白质变性导致蛋白发生聚集,改变原有结构造成的[39]。其中传统低温解冻的G′值最低(80 ℃时为22.45 kPa),且峰形较弱;而经低温RH90%和95%解冻后,肉样的G′值较高(80 ℃时为26.36 kPa和25.78 kPa),且峰形较好,与鲜肉较为一致,表明低温RH90%和95%解冻可有效保持猪肉糜原有的蛋白结构特性,凝胶结构较好。
3 结论
本试验中,与传统低温解冻相比,采用低温高湿解冻可有效缩短解冻时间,提高解冻效率;使解冻汁液损失由6.56%降低至3.64%以下,蒸煮损失由26.32%降至23.8%以下,从而改善解冻猪肉的保水能力;能明显抑制脂肪氧化程度,降低剪切力值以提高猪肉嫩度(P<0.05)。在低温条件下,经RH90%和95%解冻,效率高于其他2组处理,而且解冻后肉样的G′值较高(80 ℃时为26.36 kPa和25.78 kPa),可保持猪肉糜原有的蛋白结构特性(P<0.05);但RH95%解冻后肉样的菌落总数(3.97 lg CFU/g)、TVB-N(1.4 mg/100 g)和电导率(1 367.67 μs/cm)显著升高(P<0.05),降低新鲜度。综合分析,4 ℃、RH90%解冻是最佳的解冻条件,可有效提高解冻效率,缓解蛋白变性,提高保水能力、嫩度,改善解冻猪肉品质。

