食源性桑叶生物碱在模拟胃肠消化过程中的抗氧化及抗蛋白、DNA氧化损伤
杨忠敏,王祖文,沈以红,丁晓雯,黄先智*
1(西南大学 食品科学学院,重庆市农产品加工重点实验室,重庆,400716) 2(西南大学 蚕学与系统生物学研究所,重庆,400716)
在机体内,抗氧化防御系统与活性氧始终处于动态平衡状态,一旦这个平衡被破坏,具有高反应活性的氧自由基基团就能直接造成机体生物膜系统的损伤,从而导致正常细胞裂解死亡[1]。过剩的氧自由基会诱导机体发生氧化应激,氧化机体蛋白质、脂质、DNA等生物大分子[2],导致多种疾病的发展或发生。因此,寻找活性高、副作用低且能改善机体生物大分子氧化损伤的天然抗氧化物质对维持机体健康具有重要意义。
桑叶是我国卫生部公认的“药食同源”植物资源,现已被广泛应用于食品生产领域[3-4]。而桑叶生物碱是其重要活性成分之一,具有降糖、降脂、抗病毒、抗肿瘤等功效[5-6]。目前国内外有关桑叶生物碱对生物大分子氧化应激作用影响的研究主要在改善脂质氧化方面[7],对DNA、蛋白质的氧化影响无相关报道。
生物活性成分的抗氧化活性在经过胃肠消化后可能会发生变化[8]。而生物活性物质在机体内的消化吸收、代谢过程都非常复杂,采用体外消化模拟方法能迅速、准确地评价生物活性物质的功能在机体中的变化,有研究技术简单、成本低等优点[9]。但目前尚无桑叶生物碱在模拟胃、肠消化体系中抗氧化应激能力的研究报道。本研究采用体外模拟胃、肠消化模型,评价桑叶生物碱在不同的消化阶段抗氧化应激能力的变化,以期为桑叶生物碱在生物体内抗氧化活性变化与机理研究提供参考,为桑叶在医药及保健食品的应用提供理论参考依据。
1 材料与方法
1.1 材料与试剂
桑叶粉末,品种为胜利大叶,重庆市蚕业科学技术研究院提供。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH),购自美国Sigma公司;Gene Green核酸染料,购自北京鼎国昌盛生物技术有限责任公司;FeCl3、FeSO4、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine, DNPH)、盐酸胍、乙酸乙酯,均购自Mackin Biochemical公司;猪胰酶、荧光素钠、β-胡萝卜素、亚油酸,购自Aladdin Industrial Corporation;胃蛋白酶、胆汁盐、2,4,6-三吡啶基三嗪(tripyridyltriazine, TPTZ)、水溶性VE(Trolox)、2,2-偶氮二异丁基脒二盐酸盐(2,2’-azobis (2-methylpropionamidine) dihydrochloride, AAPH)、牛血清蛋白、哌嗪-N,N’-双(2-乙磺酸)(piperazine-1,4-bisethanesulfonic acid,PIPES)、PUC-19质粒DNA、琼脂糖、10×Loading buffer、50×TAE电泳缓冲液,均购自Solarbio life sciences;三氯乙酸、醋酸钠、无水乙醇、HCl、冰乙酸、H2O2、NaH2PO4、Na2HPO4、三氯甲烷、吐温-80、乙二胺四乙酸(ethylene diaminetetraaceticacid, EDTA),抗坏血酸,均购自成都科龙试剂。以上试剂均为分析纯。
1.2 仪器与设备
Symergy H1酶标仪,基因有限公司;RE52CS-1旋转蒸发仪,上海亚荣生化仪器厂;SHZ-88恒温摇床,常州朗越仪器制造有限公司;811DK高速冷冻离心机,Eppendorf AG;DYY-6D DNA凝胶电泳仪,北京六一生物科技有限公司;GenoSens 1860凝胶成像系统,上海勤翔科学仪器有限公司;XW-80A 微型旋涡混合仪,上海泸西仪器厂仪器有限公司;KQ5200DB超声波清洗仪,昆山市超声仪器有限公司。
1.3 主要方法
1.3.1 桑叶生物碱制备
称取桑叶粉,按料液比1∶30(g∶mL),60 ℃,功率800 W,超声处理60 min,重复提取2次,合并滤液,减压浓缩;将浓缩液以2.1 BV/h流速过D101大孔树脂;再将过D101的纯化液以2.5 BV/h流速过732型阳离子树脂吸附,先用蒸馏水洗至中性,再用0.5 mol/L氨水洗涤,然后以2倍柱体积洗脱的氨水洗脱液清洗;再将氨水洗脱液以2.1 BV/h流速过AB-8大孔树脂,干燥得样品[10-11]。本实验所制得的桑叶生物碱中总生物碱含量为93.57%。
1.3.2 体外模拟胃、肠消化
1.3.2.1 体外模拟胃消化
据MILLER等[12]体外模拟消化法对桑叶生物碱进行模拟消化。取8.0 g桑叶生物碱,加入80 g生理盐水,沸水浴15 min。冷却后,采用去离子水将样品的悬浊液恒质量至88 g制得匀浆,用1 mol/L HCl溶液将pH调至2.0。
胃空白对照组(S0组):取20 g调节pH后的均浆液,加入0.25 mL的去离子水。
盐酸对照组(S1组):取20 g调节pH后的均浆液,加入0.25 mL 0.01 mol/L HCl溶液。
胃消化组(S2组):取20 g调节pH后的均浆液,加入0.25 mL的模拟胃液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L HCl溶液)。
3个实验组均避光并充入氮气,于37 ℃恒温水浴摇床中消化3 h。分别在反应0、0.5、1、2、3 h时取出一定质量的液体,4 ℃离心(12 000 r/min,15 min),取上清液于-20 ℃冻存,备用。
1.3.2.2 体外模拟肠消化
按照模拟胃液方法制备胃消化2 h的匀浆样品,然后用1 mol/L NaHCO3溶液调节pH至7.0。
肠空白对照组(G0组):取20 g调节pH后的匀浆样品,加入0.5 mL 0.1 mol/L NaHCO3缓冲溶液;
肠消化组(G1组):取20 g调节pH后的匀浆样品,加入0.5 mL模拟肠液(4 g胰酶、25 g胆汁盐溶于1 L 0.1 mol/L NaHCO3溶液)。
2个实验组避光并充入氮气,于37 ℃恒温水浴摇床里消化5 h。分别在胃消化0 h、肠消化0、0.5、1、2、3、4、5 h时取出一定质量的悬浊液,4 ℃离心(12 000 r/min, 15 min),取上清液于-20 ℃冻存,备用。
1.3.3 抗氧化活性测定
1.3.3.1 DPPH自由基清除能力测定

1.3.3.2 铁还原能力分析(FRAP值测定)
参照LU等[14]方法进行铁还原能力分析。结果用每g样品中μmol FeSO4当量表示,简写为“μmol/g”。
1.3.3.3 β-胡萝卜素-亚油酸体系抗氧化分析
根据SHONM等[15]方法略加修改。在96孔酶标板加入50 μL待测液、200 μL的β-胡萝卜素-亚油酸乳化液,摇床80 r/min混匀1 min,50 ℃孵育反应。于470 nm波长处测定初始反应的吸光度以及反应120 min后的吸光度,分别记为Α0和Α120,ΔA=Α0-Α120,ΔA越大表明β大胡萝卜素氧化程度越高、褪色越多,计算见公式(1)。
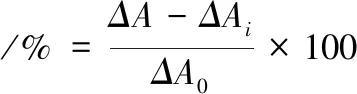
(1)
式中:ΔA0表示不加样品抑制时的褪色情况;ΔAi表示样品加入后产生抑制作用时的褪色情况。
1.3.3.4 ORAC值测定
参照HUANG等[16]方法进行测定,结果表示为μmol Trolox当量每10 g样品(μmol Trolox/10 g md)。
1.3.3.5 蛋白羰基测定
蛋白羰基含量的测定参照保健评价技术评价与规范修改稿测定[18]。
1.3.3.6 DNA保护潜力测定
根据ZHANG等[19]进行DNA保护潜力的测定。
1.4 数据处理
每个样品重复测定3次,结果以平均值±标准差(Mean±SD)表示;实验数据运用SPSS 19.0软件、Image Lab软件分析;图表采用Origin 9.0软件。
2 结果与分析
2.1 桑叶生物碱体外模拟胃肠消化中抗氧化活性
2.1.1 桑叶生物碱体外模拟胃肠消化中DPPH自由基的清除能力
桑叶生物碱模拟胃肠消化对DPPH清除能力结果如图1所示。
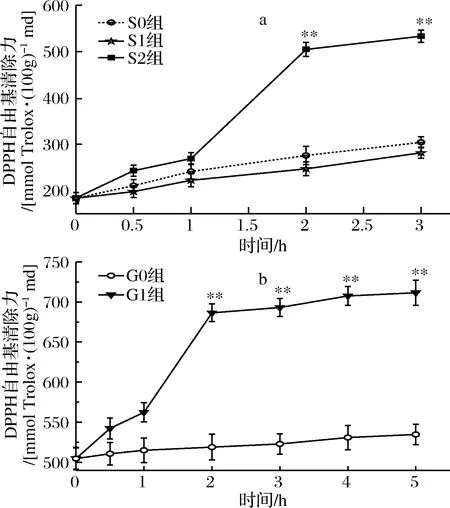
a-胃消化;b-肠消化图1 桑叶生物碱模拟胃肠消化的DPPH自由基清除能力Fig.1 DPPH radical scavenging effect capacity of mulberry leaf alkaloid during simulated gastrointestinal digestion注:*表示显著性差异(P<0.05),**表示极显著差异(P<0.01)。下同。
由图1-a可知,在胃消化中,S0、S1组对DPPH清除能力呈现缓慢增长,而S2在0~1 h增长缓慢增;1~2 h内,清除能力增长较为显著,从268.90 mmol Trolox /100 g md增长到 504.67 mmol Trolox /100 g md,增长率为88%,2~3 h增长又恢复平稳。在胃消化阶段,S0、S1组之间不存在显著性差异,当胃消化达2 h时,S2组与2个对照组存在极显著差异(P<0.01); S2组在3 h时对DPPH清除能力达最大值,较0 h时提高了2.9倍(P<0.01)。
由图1-b可知,在肠消化中,G0组对DPPH自由基的清除能力呈现缓慢增长趋势,而G1组在0~1 h平稳增长,1~2 h显著增长,从562.30 mmol Trolox /100 g md增长到 686.47 mmol Trolox /100 g md,增长率为22%,2~5 h增长恢复平稳。在整个肠消化阶段,G1组与G0组存在极显著差异(P<0.01);G1组在5 h时对DPPH自由基清除能力达最大值,是 0 h的1.46倍(P<0.01)。
2.1.2 桑叶生物碱模拟体外胃肠消化中铁还原能力分析
桑叶生物碱模拟胃肠消化FRAP结果如图2所示。
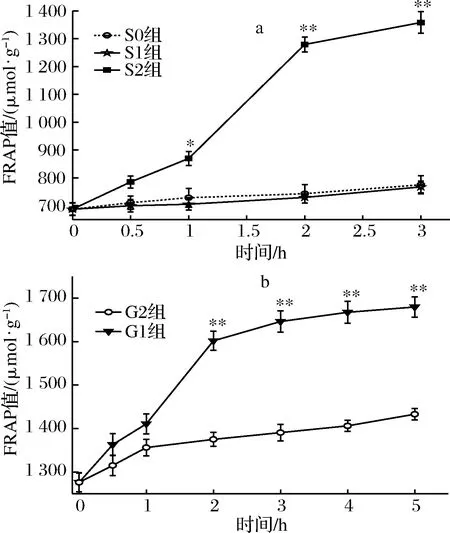
a-胃消化;b-肠消化图2 桑叶生物碱在模拟胃肠消化中的铁还原能力分析Fig.2 FRAP analysis of mulberry leaf alkaloid during simulated gastrointestinal digestion
由图2-a可知,在胃消化过程中,S0、S1组FRAP值均呈现平稳增长,S2组0~2 h FRAP值呈现快速增长,从687.33 μmol/g增长到869.56 μmol/g,增长率为27%,2~3 h增长相对平稳。在胃消化阶段,S0、S1组之间不存在显著性差异,消化达1 h,S2组与2对照组存在显著差异(P<0.05),消化达2 h时,存在极显著差异(P<0.01);S2组在3 h时FRAP值达最大,是0 h的1.98倍(P<0.01)。
由图2-b可知,在肠消化中,G0组FRAP值平稳增长。G1组的FRAP值在0~1 h平稳增长,1~2 h显著增长,从1 410.667 μmol/g增长到1 601.778 μmol/g,增长率为14%;2~5 h恢复增长平稳。在肠消化达 2 h 时,G1组与G0组存在极显著差异(P<0.01); G1组在5 h时的FRAP值达到最大,是0 h的1.32倍(P<0.01)。
2.1.3 桑叶生物碱体外模拟胃肠消化中β-胡萝卜素-亚油酸体系抗氧化分析
桑叶生物碱在模拟胃肠消化中β-胡萝卜素-亚油酸体系抗氧化分析结果如图3所示。
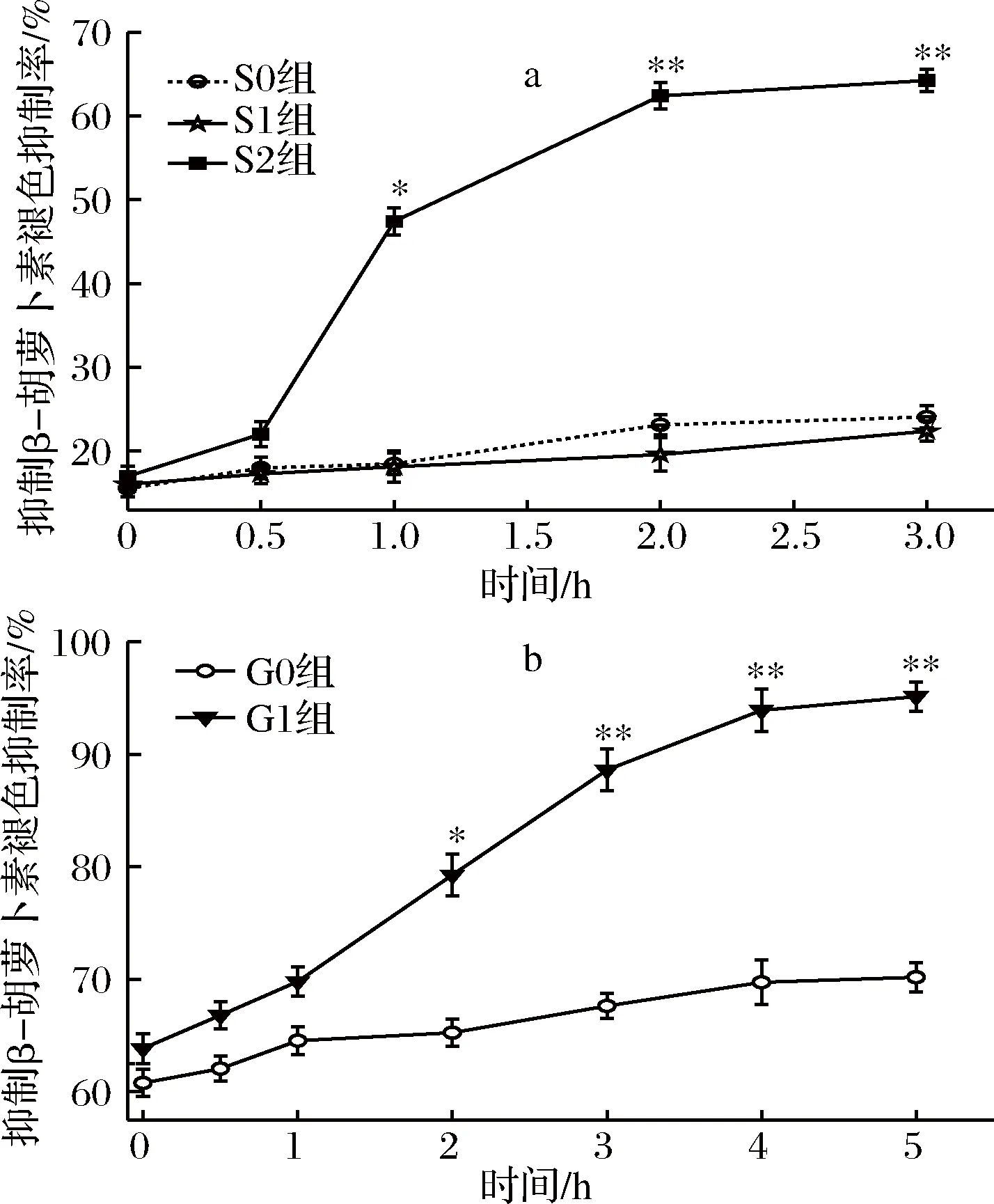
a-胃消化;b-肠消化图3 桑叶生物碱胃肠消化β-胡萝卜素-亚油酸体系抗氧化分析Fig.3 Antioxidant effect of mulberry leaf alkaloid during simulated gastrointestinal digestion on β-carotene-linoleic acid system
由图3-a可知,在胃消化中,S0、S1组对β-胡萝卜素的褪色抑制率呈现缓慢增长,其抑制率很低,表明桑叶生物碱在这2种环境下的抗氧化作用不强,而S2组0~0.5 h的抑制率缓慢增加;0.5~2 h,抑制率增加很快并达到峰值;2~3 h抑制率的平稳增加;S2组在3 h时抑制率达最大,是0 h的3.78倍(P<0.01);随着胃消化时间的延长,S2组逐渐降低H2O2对β-胡萝卜素的漂白作用,其抑制率为16.99%~64.23%。
由图3-b可知,在肠消化阶段,G0组对β-胡萝卜素褪色抑制率呈现缓慢增长;而G1组0~1 h内抑制率相对平稳增长,1~4 h其抑制率从69.80%增长到93.93%,增长迅速,4~5 h其抑制率又平稳增长,G1组在5 h时对β-胡萝卜素褪色的抑制率达到最大值,为95.14%,是0 h的1.49倍(P<0.01)。在肠消化时间阶段,桑叶生物碱对β-胡萝卜素褪色的抑制率为63.85%~95.14%,逐渐减缓H2O2对β-胡萝卜素的漂白作用。
2.1.4 桑叶生物碱体外模拟胃肠消化对ORAC值的影响
671 Application of systematic simulation training program in flexible ureteroscopy training
桑叶生物碱在模拟胃肠消化中对ORAC值的影响结果如图4所示。
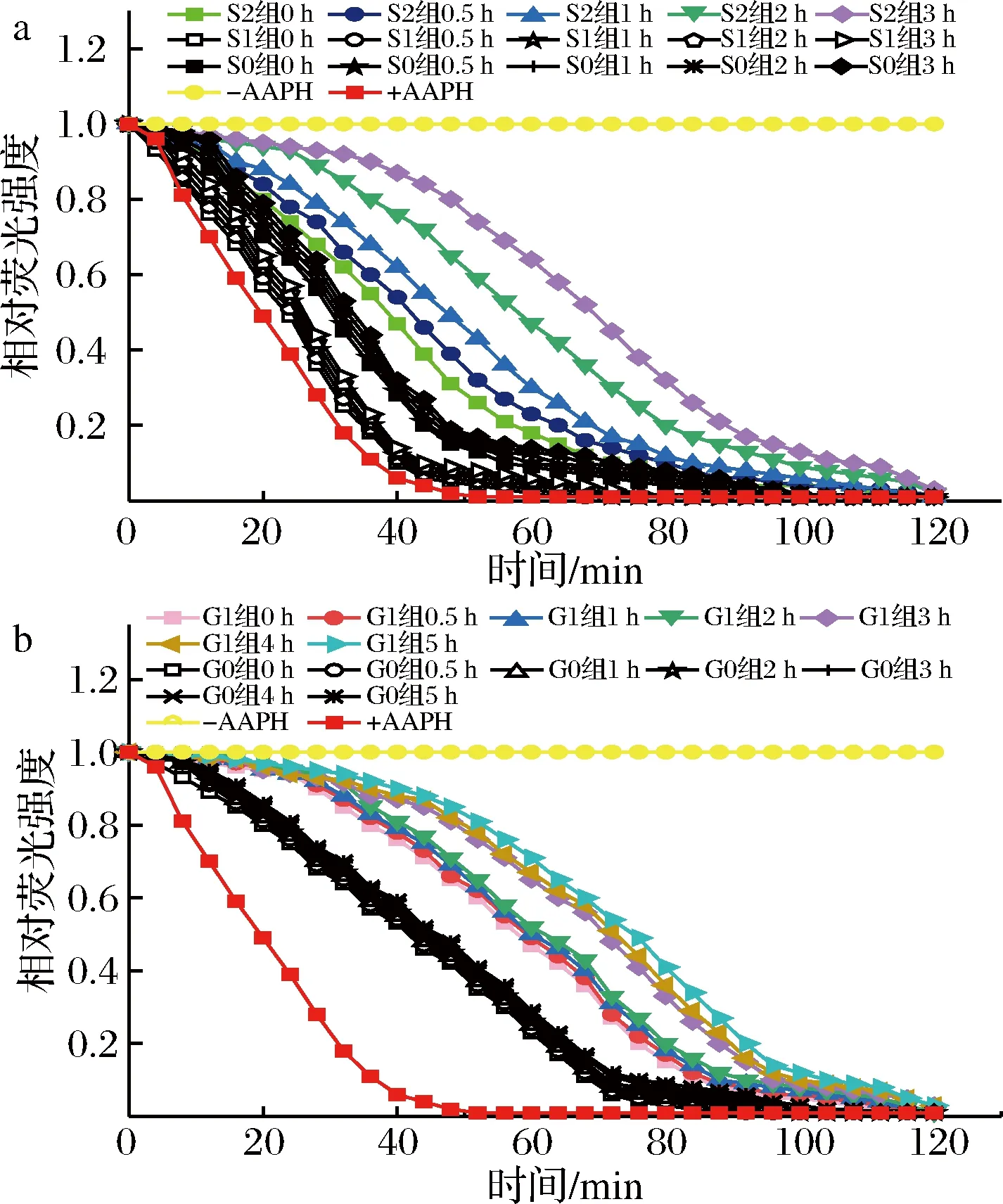
a-胃消化,b-肠消化图4 桑叶生物碱模拟胃肠液样品溶液荧光随时间衰减曲线Fig.4 The attenuation curve of fluorescence intensity of mulberry leaf alkaloid during simulated gastrointestinal digestion
由图4-a、图4-b可知,各实验组均能延缓荧光物质被活性氧自由基淬灭的速度,且顺序为S2组>S0组>S1组,G1组>G0组;同一实验组中随着消化时间的延长,荧光衰退越慢。对每个样品平行测定3次,通过Trolox标准曲线计算ORAC值,结果如图5所示。
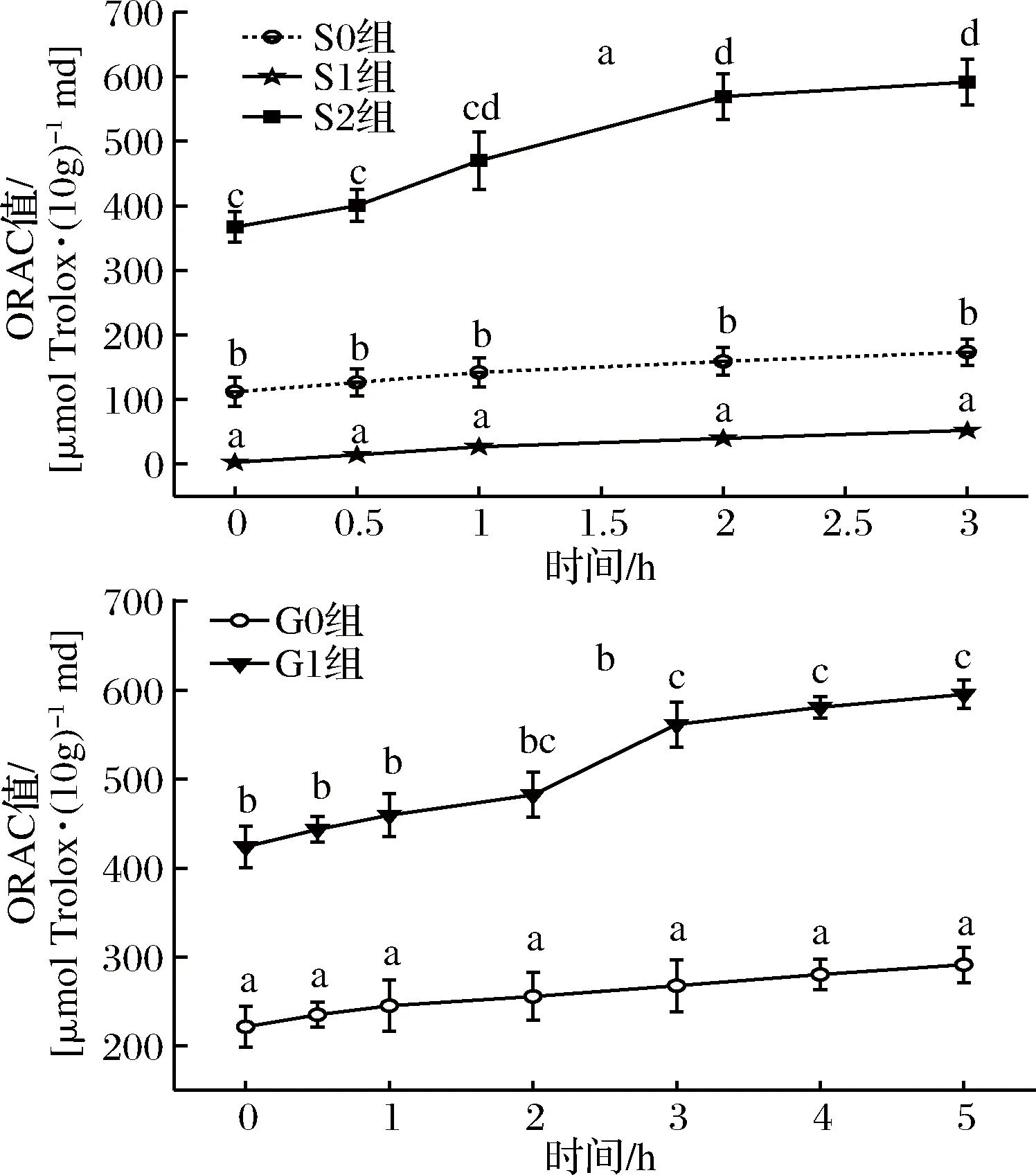
a-胃消化;b-肠消化图5 桑叶生物碱模拟胃肠消化ORAC值变化Fig.5 Changes ORAC of mulberry leaf alkaloid during simulated gastrointestinal digestion注:折线上不同字母表示显著性差异(P<0.05)。下同。
由图5-a可知,在胃消化阶段,各实验组的ORAC值均随着消化时间延长而呈现增加趋势;S0、S1组之间存在显著性差异(P<0.05),S2组与两对照组均存在显著差异(P<0.05),S2组的ORAC值在3 h时达最大,为0 h的1.61倍(P<0.05),是S0、S1组消化3 h时的3.41、11.34倍(P<0.05),表明桑叶生物碱在胃消化液中保持较好抗氧化活性,且随着消化时间的延长其抗氧化活性是增加的。
由图5-b可知,在肠消化阶段,G1组的ORAC值均显著高于G0组(P<0.05);G1组的ORAC值在5 h时达到最大,为肠消化0 h的1.45倍(P<0.05),是G0组5 h的2.04倍(P<0.05),同时也是胃消化0 h的1.67倍(P<0.05),表明经胃肠消化后的桑叶生物碱的抗氧化活性显著提高。
2.2 桑叶生物碱体外模拟胃肠消化对蛋白羰基的影响
桑叶生物碱在模拟胃肠消化对蛋白质羰基的影响结果如图6所示。
由图6-a可知,未氧化BSA羰基含量1.950 nmol/mg蛋白,氧化12 h后BSA羰基含量骤升到3.324 nmol/mg蛋白。在胃消化中,与氧化BSA对照组相比,S0、S1组与其不存在显著差异;当胃消化达1 h 时,S2组与氧化BSA、S0、S1组均存在显著性差异(P<0.05);随着消化时间的延长,S2组对BSA羰基含量的上升有显著抑制作用,抑制率为15.84%~65.84%。
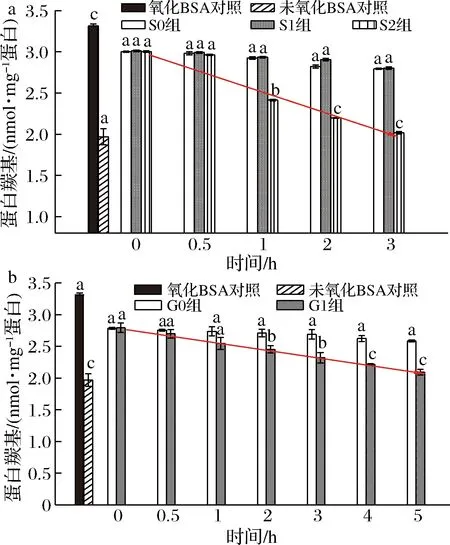
a-胃消化;b-肠消化图6 桑叶生物碱在模拟胃消化中对BSA羰基的影响Fig.6 Effect of mulberry leaf alkaloid during simulated stomach digestion on carbonyl content of BSA注:图中线条表示S2、G1组蛋白羰基含量的减少趋势线。
2.3 桑叶生物碱体外模拟胃肠消化中DNA保护潜力的测定
体外模拟胃肠消化桑叶生物碱进行DNA保护潜力(抗氧化能力)的测定结果见图7。

图7 体外模拟胃肠消化桑叶生物碱对DNA损伤保护Fig.7 The protection of DNA damage of mulberry leaf alkaloid during simulated gastrointestinal digestion注:a-空白组(不经处理的DNA); b-对照组(紫外10 min +体积分数30% H2O2处理);3~7-S2组(紫外10 min +各时间点的胃消化样+30% H2O2处理); 8~12-S1组(紫外10 min+各时间点的盐酸对照样+30% H2O2处理); 13~17-S0组(紫外10 min+各时间点的胃空白对照样+30% H2O2处理); c~i-G1组(紫外10 min +各时间点的肠消化样+30%H2O2处理); j~p-G0组(紫外10 min +各时间点的肠空白对照样+30% H2O2)。
由图7可知,PUC19质粒DNA在无抗氧化剂的保护作用下,经过紫外线、体积分数30%H2O2处理后,质粒DNA结构几乎完全降解成未知的DNA碎片或其他不同分子质量的分子(图7,泳道2、b);分别加入模拟的胃肠消化液后,DNA分子受到了不同程度的保护,其作用是G1组>S2组,S0、S1、G0组之间不存在明显差异,但明显低于G1、S2组。
为了进一步分析桑叶生物碱对DNA的保护潜力,根据软件Image Lab分析得出各泳道中分子质量条带所占百分比,结果见图8。
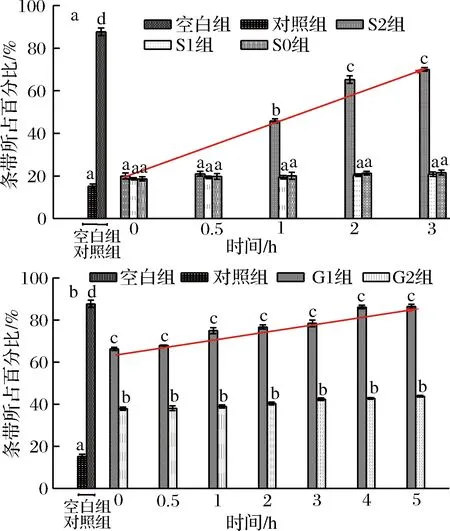
a-胃消化;b-肠消化图8 各实验组DNA条带所占百分比Fig.8 The percentage of DNA bands of each experimental group注:图中线条表示S2、G1组DNA条带占百分比的增长趋势线。
由图8可知,空白组质粒DNA百分比与对照组存在极显著差异(P<0.01),表明体积分数30%H2O2联合紫外线处对PUC质粒DNA具有较大的损伤作用;在胃消化中,S0、S1组与对照组对质粒DNA保护作用在整个胃消化时间范围内任意两两比较均不存在显著性差异(P>0.05);在0~0.5 h,S2组质粒DNA百分比与3个对照组间不存在显著性差异,消化达1 h时,与3个对照组存在显著性差异(P<0.05);随着胃消化时间的延长,S2组对质粒DNA的保护作用增加:其保护率为6.68%~75.67%。在肠消化的过程中,与对照组、G0组相比,G1组对质粒DNA保护作用与其均存在显著性差异(P<0.05);随着肠消化时间的延长,G1组有效保护质粒DNA的损伤:其保护率为70.50%~98.29%。在整个模拟胃肠消化的过程中,G1组对质粒DNA损伤的保护作用强于S2组,表明桑叶生物碱在肠消化清除自由基的作用强于在胃消化的过程。
3 讨论与结论
体外模拟胃肠消化系统是一种基于人体胃肠道生理机能进行模拟食物消化行为的生物系统,具有简单快速的特点[20]。而目前有关生物碱类化合物抗氧化活性研究只有在化学环境分析而获得的数据,均未考虑其在胃肠道中消化过程可能发生的变化。本研究采用桑叶生物碱通过体外模拟胃肠消化法,分析桑叶生物碱的抗氧化活性的变化规律,更加贴近人体对其的消化吸收情况,可为桑叶生物碱在体内的功能性质研究提供参考。
DPPH自由基结构中1个N原子上含有1个未成对的电子,若其含有抗氧化活性物质就会与其配对,深紫色的DPPH自由基就会被还原成黄色的非自由基形式[21]。FRAP分析不是反应对某种自由基的清除能力,而是抗氧化物质的总还原能力。本研究结果表明,桑叶生物碱在模拟胃肠消化的过程中对DPPH自由基的清除能力、FRAP值的变化趋势相同,在胃、肠消化1 h后,DPPH自由基的清除能力、FRAP值显著增加,肠消化2 h后均呈现平稳趋势,其中在肠消化的抗氧化能力强于胃消化。刘平怀等[22]的研究结果表明,样品中生物碱与DPPH清除率之间存在剂量效应关系,在1.6 mg/mL时,清除率可达91.59%。单虹宇等[23]研究显示玛咖生物碱具有较好还原三价铁离子能力。与其他生物碱化合物相同,桑叶生物碱经过胃肠消化后对DPPH自由基清除能力、还原三价铁离子能力均有较强作用。β-胡萝卜素-亚油酸体系中的亚油酸被氧化会产生漂白β-胡萝卜素的H2O2自由基,则向体系中加入抗氧化物质就会对自由基产生作用进而减轻β-胡萝卜素漂白情况[24]。本研究结果表明胃肠消化0.5、1 h后,桑叶生物碱抑制β-胡萝卜素褪色率均显著增加,分别到消化3、5 h后,达到2个消化阶段的最大值,分别为该阶段的3.78、1.58 倍,且随消化时间的增加,抑制率加强,表明桑叶生物碱经过胃肠消化后在油脂体系中仍具有较强清除自由基的作用。
ORAC方法具有稳定的自由基引发剂,所产生的自由基与食品、生命现象中的自由基具有高度一致性,且其反应机制是经典的氢转移反应,是目前体外评价抗氧化物质的主要方法之一[24]。已有研究表明,一些植物(翘果决明、米兰花等)中的生物碱可以通过与O2发生碰撞使自身获得能量,进而使1O2失去活性使其转变为3O2,是活性氧(ROS)的淬灭剂[25]。本研究结果表明,在模拟胃肠消化的过程中,随着消化时间的延长,ORAC逐渐增加,胃肠消化阶段的ORAC分别在366.952~591.528、423.877~613.230 μmol Trolox /10 gmd,且肠消化阶段的ORAC值大于胃消化阶段。推测其主要原因是其在胃、肠消化阶段其结构或者电性因素不同,当杂环中的N原子裸露在外时有利于与ROS相接触并与之反应,供电基团或者可以使N原子富有电子结构的因素也会增加其抗氧化作用[26]。
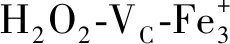
综上,桑叶生物碱经过胃肠消化后具有较强的体外抗氧化作用,且能有效保护DNA、蛋白损伤,其机制有可能是桑叶生物碱的自身立体结构或电性,具体的分子机理还需进一步深入研究。本研究的结果表明,桑叶生物碱可能具有较强的抗氧化作用,有望应用于保健食品领域。

