ID3过表达对肝细胞癌多柔比星化疗敏感性的影响及其机制
王海容,杜海燕
(1 盐城市第二人民医院,江苏盐城224002;2 盐城市第一人民医院)
原发性肝癌是临床常见的消化系统恶性肿瘤,其中85%~90%为肝细胞癌(HCC)[1]。手术切除是目前肿瘤治疗最有效的手段,但HCC早期症状隐匿、缺少特异性,多数患者就诊时已处于晚期,错过了最佳手术时机,化疗成为其重要治疗手段。多柔比星(DOX)是临床常用的广谱、高效抗肿瘤药物,是HCC的一线化疗药物。但大多数HCC患者在应用DOX过程中易产生耐药性[2],从而导致化疗失败,最终引起肿瘤进展[3~5]。因此,逆转HCC细胞对DOX的化疗耐药性,对改善患者预后具有重要意义。分化抑制因子3(ID3)是螺旋-环-螺旋(HLH)转录因子家族成员之一,是肿瘤发生、发展过程中的关键调节因子[6]。最近研究发现,ID3具有化疗增敏潜能,可逆转顺铂耐药A549细胞的多药耐药性[7]。但ID3与HCC DOX化疗敏感性的关系鲜有报道。2017年6月~2018年10月,我们观察了ID3过表达对HCC DOX化疗敏感性的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 人肝癌细胞系HepG2(以下称HepG2细胞),美国ATCC细胞库;人肝癌阿霉素(ADM)耐药细胞系HepG2(以下称HepG2/ADM细胞),广州吉妮欧生物科技有限公司。DOX、嘌呤霉素,美国Sigma公司。ID3过表达慢病毒质粒(oe-ID3)、阴性对照慢病毒质粒(oe-NC),由上海吉凯基因化学技术有限公司设计合成。所有引物由上海捷瑞生物工程有限公司设计合成。Mastercycler Ep Realplex实时荧光定量PCR仪,德国Eppendorf公司;Multiskan MK3型酶标仪,美国Thermo Fisher Scientific公司;荧光倒置显微镜,日本奥林巴斯株式会社;Mini-PROTEAN Tetra电泳仪,美国Bio-Rad公司。PrimeScriptTMRT Reagent Kit逆转录试剂盒、SYBR Premix Ex TaqTMqRT-PCR试剂盒,日本TaKaRa株式会社;MTS试剂、TUNEL细胞凋亡检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒,南京凯基生物科技发展有限公司。鼠抗人ID3一抗、鼠抗人pPI3K一抗,美国Abcam公司;鼠抗人pAKT一抗、鼠抗人GAPDH一抗、HRP标记的羊抗鼠二抗,美国Proteintech公司。
1.2 HepG2/ADM细胞与HepG2细胞ID3 mRNA表达检测 将HepG2/ADM细胞接种于含10% FBS的RPMI 1640培养基,HepG2细胞接种于含10% FBS的DMEM高糖培养基,均置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。当细胞融合90%左右时,收集细胞,采用TRIzol法提取细胞总RNA。按PrimeScriptTMRT Reagent Kit试剂盒说明将总RNA逆转录为cDNA,以cDNA为模板,按SYBR Premix Ex TaqTMqRT-PCR试剂盒说明进行PCR扩增。引物序列:ID3上游引物5′-GAGAGGCACTCAGCTTAGCC-3′,下游引物5′-TCCTTTTGTCGTTGGAGATGAC-3′;GAPDH上游引物5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物5′-GCCATCACGCCACAGTTTC-3′。PCR反应条件:95 ℃预变性5 s,95 ℃变性5 s、60 ℃退火30 s共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。
1.3 细胞分组转染 取对数生长期HepG2/ADM细胞,接种于含DMEM高糖培养基的6孔板,每孔1×105个,随机分为对照组和实验组,每组设3个复孔。然后将6孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。培养24 h,实验组加入oe-ID3和Lipofectamine2000转染试剂,对照组加入oe-NC和Lipofectamine2000转染试剂,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中转染8 h,更换新的DMEM高糖培养基,继续转染16 h。收集两组转染24 h细胞,按1.2中的方法,检测ID3 mRNA相对表达量。实验重复3次,取平均值。
1.4 两组DOX IC50值检测 收集两组转染24 h细胞,接种于含DMEM高糖培养基的96孔板,每孔4×103个。然后将96孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。当细胞融合30%左右时,每组分别加入0、6.25、12.5、25、50、100、200、400、800、1 600、3 200 μg/mL DOX,每个浓度设6个复孔。DOX反应72 h,加入MTS试剂30 μL,37 ℃孵育2 h。酶标仪于490 nm波长处检测各孔的吸光度(OD)值,计算细胞存活率。细胞存活率=(实验孔OD490值-空白孔OD490值/对照孔OD490值-空白孔OD490值)×100%。当细胞存活率为50%时所对应的DOX浓度,即为DOX的IC50值。实验重复3次,取平均值。
1.5 两组细胞凋亡率检测 ①TUNEL凋亡染色法:取传2代、对数生长期、生长状态良好的HepG2/ADM细胞,接种于6孔板(孔内含0.1 μg/mL DOX的DMEM高糖培养基),每孔1×106个,按1.3中的方法分组转染。转染24 h,收集细胞,4%多聚甲醛固定30~60 min,加入TUNEL染色液100 μL,37 ℃避光孵育1 h,然后滴加含DAPI的抗荧光淬灭封片剂50 μL,荧光倒置显微镜下观察。实验重复3次,取平均值。②流式细胞术:取传2代、对数生长期、生长状态良好的HepG2/ADM细胞,接种于6孔板(孔内含0.1 μg/mL DOX的DMEM高糖培养基),每孔1×106个,按1.3中的方法分组转染。转染24 h,收集细胞,用不含EDTA的胰酶消化,Binding Buffer 500 μL重悬,然后分别加入Annexin V-FITC 5 μL、PI 5 μL,充分混匀,37 ℃避光孵育30 min,上流式细胞仪检测。实验重复3次,取平均值。
1.6 两组PI3K/AKT信号通路相关蛋白表达检测 取传2代、对数生长期、生长状态良好的HepG2/ADM细胞,接种于6孔板(孔内含0.1 μg/mL DOX的DMEM高糖培养基),每孔1×106个,按1.3中的方法分组转染。转染24 h,收集细胞,胰酶消化,RIPA裂解液冰上充分裂解,4 ℃、14 000 r/min离心30 min,提取细胞总蛋白,经BCA法蛋白定量合格。然后加入5倍的上样缓冲液,煮沸变性。取变性蛋白50 μg,SDS-PAGE分离蛋白。电泳结束,采用湿转法将蛋白电泳产物转印至PVDF膜上。然后用5%脱脂牛奶室温封闭2 h,分别加入pPI3K(1∶500)、pAKT(1∶500)和Bcl-2(1∶1 000),4 ℃孵育过夜。次日,加入HRP标记的羊抗鼠二抗(1∶8 000),室温孵育2 h。ECL发光,暗室中曝光、显影。以GAPDH为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3次,取平均值。
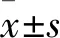
2 结果
2.1 HepG2/ADM细胞与HepG2细胞ID3 mRNA表达比较 HepG2/ADM细胞ID3 mRNA相对表达量为0.24±0.04,HepG2细胞为1.00±0.11,两者比较P<0.05。
2.2 两组ID3 mRNA表达比较 实验组ID3 mRNA相对表达量为13.54±2.33,对照组为1.00±0.00,两组比较P<0.05。
2.3 两组DOX的IC50值比较 0、6.25、12.5、25、50、100、200、400、800、1 600、3 200 μg/mL DOX作用72 h,对照组细胞存活率分别为(100.00±1.12)%、(97.34±5.61)%、(89.54±3.74)%、(80.95±6.83)%、(73.44±3.41)%、(69.59±5.49)%、(62.13±2.34)%、(42.32±7.69)%、(31.68±3.57)%、(20.93±2.32)%、(15.15±3.21)%,实验组分别为(100.00±1.54)%、(92.15±4.38)%、(84.69±6.80)%、(73.07±7.01)%、(65.12±5.98)%、(57.33±2.47)%、(40.32±4.18)%、(27.32±4.05)%、(17.21±3.11)%、(15.21±1.24)%、(15.01±1.01)%。经计算,对照组DOX的IC50值为(0.25±0.04)μg/mL,实验组DOX的IC50值为(0.12±0.03)μg/mL,两组比较P<0.05。
2.4 两组细胞凋亡率比较 ①TUNEL凋亡染色法:实验组细胞凋亡率为(22.34±0.24)%,对照组为(7.41±0.31)%,两组比较P<0.05;②流式细胞术:实验组细胞凋亡率为(19.57±0.29)%,对照组为(1.03±0.11)%,两组比较P<0.05。
2.5 两组PI3K/AKT信号通路相关蛋白表达比较 见表1。

表1 两组PI3K/AKT信号通路相关蛋白相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
HCC是临床常见的消化系统恶性肿瘤之一,全世界每年约有50万新发病例,我国占一半以上[8,9]。由于HCC早期症状隐匿且较早出现转移,大多数患者无法行根治性手术[10],化疗成为其重要治疗手段。DOX是HCC的一线化疗药物,可通过结合肿瘤细胞DNA,降低DNA聚合酶活性,抑制肿瘤细胞增殖;还可嵌入DNA碱基对,阻碍肿瘤细胞DNA复制、转录,诱导肿瘤细胞G2期阻滞。此外,DOX还能通过生成自由基、结合细胞膜等作用发挥抗肿瘤活性[11]。化疗耐药是HCC治疗失败的主要原因[2],同样DOX应用过程中也易产生耐药性,是造成患者预后不良的原因之一[12]。因此,逆转HCC细胞对DOX的化疗耐药,对改善患者预后具有重要意义。但HCC化疗耐药的机制非常复杂,至今仍未明确。
ID3基因编码含有HLH结构的蛋白质,能控制细胞周期中的多种基因,为负性转录调控因子[6]。已有研究证实,ID3与实体肿瘤的发生、发展密切相关。Antonangelo等[13]报道,在肺腺癌组织中ID3高表达,且其高表达与淋巴结转移和患者不良预后有关。在小鼠脾T细胞淋巴瘤的发生、发展过程中,ID3具有肿瘤抑制作用,ID2/ID3双敲除后淋巴瘤迅速进展[12]。最近研究发现,ID3可逆转顺铂耐药A549细胞的多药耐药性[13],且在黑色素瘤中ID3能够调控介导细胞迁移和耐药相关基因SOX10、MITF表达[14]。表明ID3可能与肿瘤化疗敏感性有关。但ID3与HCC DOX化疗敏感性的关系鲜有报道。
本研究首先观察了HepG2/ADM细胞与HepG2细胞ID3 mRNA表达,结果发现,HepG2/ADM细胞ID3 mRNA相对表达量明显低于HepG2细胞,提示ID3与HCC化疗耐药有关。采用瞬时转染技术使HepG2/ADM细胞ID3过表达,观察其DOX的IC50值,结果发现,实验组DOX的IC50值明显高于对照组,说明ID3过表达可增加HepG2/ADM细胞对DOX的化疗敏感性。肿瘤化疗耐药的机制非常复杂,涉及药物代谢和凋亡途径改变等。有研究表明,ID3可诱导暴露于紫外线的永生化人角质细胞凋亡[15];ID3以Elk-1/Caspase-8依赖途径介导皮肤癌A431细胞凋亡,并能与5-氟尿嘧啶、顺铂发挥协同作用[16]。本研究采用TUNEL凋亡染色法和流式细胞术检测两组在DOX的IC50时细胞凋亡率,结果发现,实验组细胞凋亡率明显高于对照组,表明ID3过表达能明显提高DOX处理的HepG2/ADM细胞凋亡。因此推测,ID3可能是通过调节细胞凋亡方式,促进HCC对DOX的化疗敏感性。PI3K/AKT信号通路在肿瘤的发生、发展过程中具有重要作用[17]。近年研究发现,PI3K/AKT信号通路还能调控多种肿瘤细胞化疗耐药所必需的蛋白表达[18,19]。PI3K/AKT信号通路可以磷酸化多种底物和下游效应分子,如Forkhead家族成员、Caspase家族、细胞周期蛋白家族和Bcl-2凋亡蛋白家族[20]。本研究观察了两组PI3K/AKT信号通路中pPI3K、pAKT蛋白及凋亡蛋白Bcl-2表达变化,结果发现,实验组pPI3K、pAKT、Bcl-2蛋白相对表达量均明显低于对照组。表明ID3过表达能够通过抑制PI3K/AKT信号通路中相关蛋白表达,提高HCC对DOX的化疗敏感性。
综上所述,ID3过表达可提高HCC对DOX的化疗敏感性,其机制与抑制PI3K/AKT信号通路相关蛋白表达有关。

