艾灸促进压力性损伤组织血管新生的机制研究
于杰,孙忠人,李洪玲,赵惠
压力性损伤(又称席疮、压疮)是由于局部组织长期受压,继而发生持续缺血、缺氧以及营养不良,致使组织发生溃烂、坏死的外科疾患。现代医学认为压力性损伤属于慢性、难愈性创面,具有缺乏微血管数量、组织低氧血症、缺乏相关修复因子及上皮化延迟等特点,压力性损伤一旦形成后将面临创面难以愈合的问题[1-5]。艾灸可以促进压力性损伤创面组织的愈合,疗效确切,但其作用机制还不完全清楚,因此探索艾灸治疗本病的作用机制尤为重要[1]。本课题组利用免疫组化技术从蛋白层面对RAS/RAF/ERK 信号通路中的关键信号分子进行检测,旨在为探讨艾灸促进压力性损伤愈合、血管新生的作用及可能存在的分子机制提供疗效保障,为皮肤压力性损伤乃至慢性损伤组织的机制研究、修复及愈合相关研究提供重要理论和实验依据[1-5]。
本文创新点:
(1)从祖国医学特色理论层面分析,艾灸治疗压力性损伤切中要害。艾灸治疗本病,不仅能够扶助正气,提高机体的免疫力,而且具有杀菌祛邪的作用。艾灸行气活血,通经活络,促进气血运行,气机通畅,营卫调和,故瘀结自散,其体现了鲜明的中医原创特色。(2)从现代医学研究前沿角度分析,血管内皮生长因子(VEGF)/血管内皮生长因子受体2(VEGFR2)信号通路是压力性损伤组织血管新生的重要理论成果与热点之一,其主要调控形成新生血管的血管内皮细胞的增殖和其通透性的改变等。通过国内外权威文献检索,发现迄今尚未有基于VEGF/VEGFR2 信号通路的艾灸促进压力性损伤组织血管新生的研究报道。(3)鉴于其学术重要性与临床指导意义,本课题以“艾灸促进压力性损伤组织血管新生”为切入点,以VEGF/VEGFR2信号通路为核心,运用祖国医学原创理论中的艾灸“行气活血,通经活络”治则,优化影响其疗效发挥的相关因素,采用经改良及优化的压力性损伤缺血-再灌注损伤大鼠模型,通过免疫组化从蛋白层面检测RAS/RAF/ERK 信号通路中关键信号分子的表达,深入研究艾灸促进压力性损伤组织血管新生的分子调控机制。
1 材料与方法
1.1 实验动物 2015 年12 月—2017 年3 月对120 只体质量为230~245 g 的清洁级健康雌性SD 大鼠(系黑龙江中医药大学动物实验中心)给予单笼喂养,自由饮水、进食并活动[1-3]。在40%~50%相对湿度、温度(19.0±2.1)℃、明暗周期12 h的环境中进行适应性喂养14 d 后选取85 只给予造模处理,另35 只作为空白组,对实验动物的处置符合动物实验伦理标准。
1.2 主要仪器及试剂 仪器:DHP-9082 型电热恒温培养箱(上海一恒科学仪器有限公司),RM2235 型切片机、EG1160 组织包埋机、DM4000B 显微镜、HI1220 烘片机(德国LEICA 公司),医用微波炉(青岛海尔)。包埋盒(世泰实验耗材有限公司),电动理发器(宁波真汉子电器有限公司),压力性损伤造模装置(规格厚度为1.5 cm 有机玻璃板、纯净水瓶底座、十字形托盘、不锈钢丝网、502 胶水、膨胀螺丝、帆布条、钢珠、塑料制尼龙扎带),非接触式电子温度计(广州市金鑫宝电子有限公司),电子天平(MP200A 型,上海精密仪器厂)。试剂:五年陈艾(有烟艾条,规格18 mm×200 mm,南阳药益宝艾草制品有限公司)、医用碘伏,敏感肌肤型薇婷牌脱毛膏(利洁时家化中国有限公司),医用酒精,医用棉签,0.9%氯化钠溶液,定性滤纸1001-6508,水合氯醛。磷酸盐缓冲液(PBS)(SLB-P1010-2、solarbio),苏木素染液(上海碧云天生物技术有限公司),无水乙醇、石蜡、二甲苯,BSA 封闭液(SLB-SW3015、solarbio),蒸馏 水,Anti-VEGFA 抗 体(VG-1) (ab1316、ABCAM),Phospho-p44/42 MAPK (ERK1/2) (Thr202/Tyr204) (D13.14.4E)XP ® Rabbit mAb(#4370、Cell Signaling Technology),KRAS Polyclonal Antibody(12063-1-AP、Proteintech) 以及抗鼠/兔通用型免疫组化检测试剂盒(Proteintech)。
1.3 压力性损伤动物模型的制备 分别用塑料制尼龙扎带将大鼠四个部位固定(腹部、双侧腋下、双侧踝部、双侧腹股沟内侧),充分暴露造模部位后备皮(备皮长宽均为20 mm),消毒待造模处及螺钉锥度侧。将造模装置固定于大鼠腿部近膝关节骨隆突处(即造模处),通过缺血-再灌注损伤循环周期模式制备压力性损伤动物模型。1 个循环=缺血期(120 min)+再灌注期(30 min),5 个循环/d,持续3 d。30 min 的再灌注期解压松绑大鼠,任其活动、饮水及进食。造模3 d 后,持续1 d 的观察期,用以评价模型制备的成功与否,并剔除制备失败的动物模型[2-3]。动物模型的评价参照2~3 期压力性损伤(即2016 年NPUAP 公布的最新指南)[6],并进行肉眼(创面颜色、形态及渗出物性质)及行为学(大鼠整体状态、性情、步态及二便等)的观察[7]。
1.4 实验分组及干预治疗 遵循先造模后随机的原则,进行压力性损伤缺血-再灌注模型制备。85 只大鼠中,造模过程中死亡9 只,造模失败6 只。将造模成功的70 只大鼠采用随机数字表法分为模型组和艾灸组,35 只/组;造模后至干预过程中模型组和艾灸组各有5 只大鼠脱落。另35 只大鼠作为空白组,其中5 只大鼠于备皮时出现负损伤而给予剔除。3 组动物捆绑方式均相同,即对大鼠腹部、双侧腋下、双侧踝部、双侧腹股沟内侧四个部位通过塑料制尼龙扎带捆绑固定于不锈钢丝网上。空白组不予造模,仅对模拟造模部位处进行碘伏处理。模型组仅对创面进行碘伏常规处理,艾灸组先对创面予碘伏处理,继予艾灸回旋灸操作,以压力性损伤创面为中心,10 mm 为半径,1 次/d,15 min/次。将艾条燃烧端及非接触式电子温度仪探头与压力性损伤创面的距离控制在30 mm左右,将艾灸温度控制在40~42℃,每30 s 测量1 次温度,全程施灸操作需注意对艾条燃烧过程中产生的灰烬及时处理,旨在达到艾灸疗效最佳化与负损伤最小化。
1.5 标本采集 分别将模型组和艾灸组大鼠于治疗第1、3、5、7、10 天进行标本采集,空白组大鼠随同以上两组于上述5 个时间点取材处理(3 组每个时间点各选6 只大鼠进行处理)。标本采集前测定所有大鼠体质量,根据体质量不同分别给予对应的水合氯醛进行腹腔注射麻醉,取材区域为以压力性损伤创面正中心为圆点、5 mm 为半径的皮肤全层组织。取材过程中注意勿将组织打卷,展平固定在滤纸中,置于包埋盒中,贮存在盛有10%的中性甲醛溶液,24 h 内进行包埋处理,标本采集后所有大鼠脱颈椎处死。
1.6 免疫组化操作步骤 (1)酒精梯度脱水:60%乙醇溶液浸泡30 min →80%乙醇溶液浸泡30 min →95%乙醇溶液浸泡30 min →100%乙醇Ⅰ浸泡30 min →100%乙醇Ⅱ浸泡30 min。(2)透明:在二甲苯与酒精等量混合溶液中浸泡15 min →二甲苯浸泡30 min。(3)浸蜡:在石蜡和二甲苯等量混合溶液中浸泡15 min→石蜡Ⅰ30min→石蜡Ⅱ 30 min。(4)包埋:将浸蜡后的皮肤组织依次包埋成块。(5)切片:切片厚度≤4 μm,烘烤60 min。(6)脱蜡及水化:二甲苯脱蜡处理,将切片置于二甲苯中浸泡10 min,共进行2 次→在无水乙醇中浸泡1 min,共进行3 次→在95%乙醇溶液中浸泡2 min →在85%乙醇溶液中浸泡2 min →在75%乙醇溶液中浸泡2 min →蒸馏水冲洗2 min,共进行3 次。(7)抗原修复:室温下进行3%过氧化氢灭活处理→蒸馏水冲洗2 min,共进行3 次→浸入枸橼酸盐缓冲液(pH 值为6.0)→微波炉加热98 ℃,至沸腾状态→自然冷却至室温20 min →PBS 冲洗1 min,共进行3 次→用油性笔画出加抗体的范围,一般超过组织3 mm。(8)封固:滴加5%BSA 封固液,在室温状态下封固60 min,将多余的液体甩掉,不洗。(9)孵育一抗:滴加经过稀释后的一抗,4 ℃恒温过夜→取出后于室温状态下复温20 min → PBS 冲洗2 min,共进行3 次。(10)孵育二抗:滴加经过稀释后的二抗→37 ℃孵育30 min →PBS 冲洗2 min,共进行3 次。(11)DAB 显色:DAB 显色1 min →室温显色→镜下观测显色结果,终止显色→蒸馏水冲洗。(12)复染:苏木素复染1 min →流水冲洗干净,冲反面→盐酸酒精分化3 s →流水冲洗返蓝10 min。(13)脱水、透明及封固:在75%乙醇溶液中浸泡2 min →在85%乙醇溶液中浸泡2 min →在95%乙醇溶液中浸泡2 min →在无水乙醇中浸泡1 min,共进行2 次→置于二甲苯中浸泡5 min,共进行2 次→给予中性树胶封固→显微镜下观察。
1.7 读片及结果判定 采用Image-Pro Plus 6.0 图像分析软件,设置图像采集系统在同一参数状态,于400 倍光学显微镜下进行拍摄切片,以胞质及细胞核出现棕黄色颗粒为阳性,每张切片随机选取5 个未重叠的视野,取均值。对血管内皮生长因子(VEGF)、RAS、磷酸化细胞外调节蛋白激酶(P-ERK1/2)的阳性表达进行半定量分析,标准化到每100μm2积分光密度值(IOD),即(IOD 值)/100 μm2。
1.8 统计学方法 采用SPSS 21.0 软件进行统计学分析。正态分布计量资料以(±s)表示,组间比较采用ANOVA 检验,多重比较采用LSD 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 光学显微镜下VEGF 表达情况 400 倍高倍镜下可见,VEGF 在压力性损伤皮肤组织中的阳性表达部位位于胞质中,在上皮细胞、巨噬细胞中均有表达。VEGF 在正常大鼠皮肤组织中呈弱阳性表达,于空白组各个时间点均呈弱阳性表达状态。当压力性损伤出现后,创面组织中VEGF 蛋白表达逐渐升高,而后降低,向正常皮肤组织表达水平回落。艾灸组与模型组两组组内VEGF蛋白均呈现先升高后降低的表达趋势,但两组组内表达高峰值存在区别,艾灸组组内高峰值出现在治疗3 d 后,而模型组组内高峰值出现在碘伏处理5 d 后(见图1)。
2.2 光学显微镜下RAS 表达情况 实验结果显示,400 倍高倍镜下可见,RAS 蛋白在压力性损伤皮肤组织中的阳性表达部位位于胞质中。当损伤出现后,创面组织中RAS 蛋白表达较正常组织呈现先降低,而后升高的表达状态。艾灸组与模型组两组组内RAS 蛋白均呈现逐渐升高趋势(见图2)。
2.3 光学显微镜下P-ERK1/2 表达情况 实验结果显示,400倍高倍镜下可见,P-ERK1/2 蛋白在压力性损伤皮肤组织中的阳性表达部位位于胞质中。当压力性损伤出现后,创面组织中P-ERK1/2 蛋白表达逐渐升高,再降低,向正常皮肤组织表达水平回落。艾灸组与模型组两组组内P-ERK1/2 蛋白均呈现先升高后降低的表达趋势,但两组组内表达高峰值存在区别,艾灸组组内高峰值出现在治疗3 d 后,而模型组组内高峰值出现在碘伏处理5d 后(见图3)。
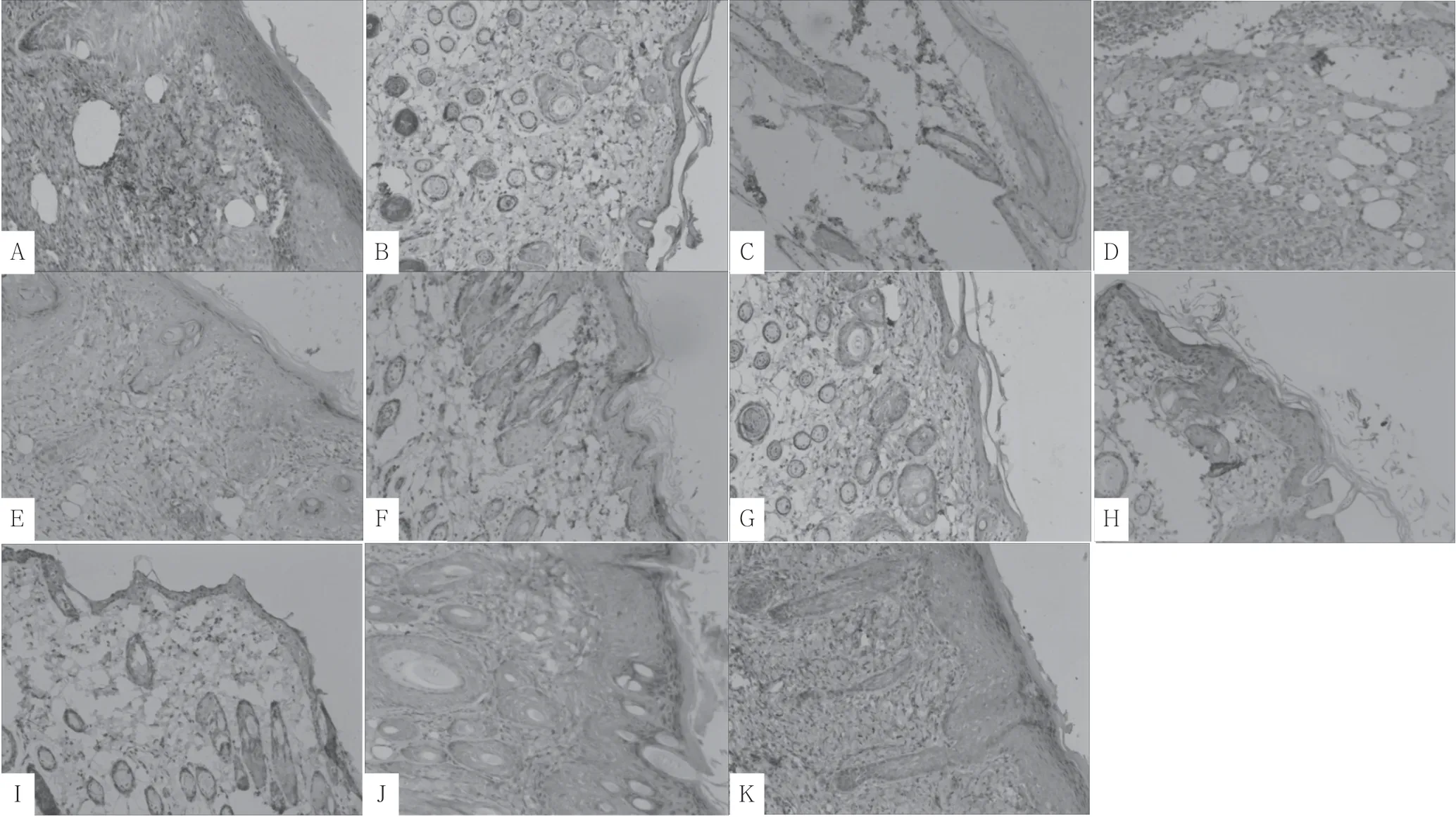
图13 组大鼠不同时间点压力性损伤创面组织中VEGF 表达情况(×400)Figure 1 Expression of VEGF protein on the wound surface in 3 groups of rats with pressure injuries at different time-points
2.4 VEGF 表达水平 第1、3、5、7、10 天模型组压力性损伤创面组织中VEGF 表达水平高于空白组,差异有统计学意义(P<0.05);第3、5 天艾灸组压力性损伤创面组织中VEGF 表达水平高于模型组,差异有统计学意义(P<0.05,见表1)。
2.5 RAS 表达水平 第1、3、5、7、10 天模型组压力性损伤创面组织中RAS 表达水平低于空白组,差异有统计学意义(P<0.05);第3、5、7、10 天艾灸组压力性损伤创面组织中RAS 表达水平高于模型组,差异有统计学意义(P<0.05,见表2)。
2.6 P-ERK1/2 表达水平 第3、5、7、10 天,模型组压力性损伤创面组织中P-ERK1/2 表达水平高于空白组,差异有统计学意义(P<0.05);第3、5 天艾灸组压力性损伤创面组织中P-ERK1/2 表达水平高于模型组,差异有统计学意义(P<0.05,见表3)。
表13 组大鼠不同时间点压力性损伤创面组织中VEGF 表达水平比较(±s,n=6)Table 1 Comparisons of expression levels of VEGF protein on the wound surface in 3 groups of rats with pressure injuries at different time-points

表13 组大鼠不同时间点压力性损伤创面组织中VEGF 表达水平比较(±s,n=6)Table 1 Comparisons of expression levels of VEGF protein on the wound surface in 3 groups of rats with pressure injuries at different time-points
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05
组别 第1 天 第3 天 第5 天 第7 天 第10 天空白组 9.53±1.44 8.37±0.80 9.20±1.08 8.83±1.10 9.61±0.99模型组 13.11±1.74a 29.17±3.24a 38.66±4.78a 35.37±5.39a 20.61±2.92a艾灸组 14.58±1.6466.42±7.86b 61.10±8.35b 34.96±4.5518.61±2.21
表23 组大鼠不同时间点压力性损伤创面组织中RAS 表达水平比较(±s,n=6)Table 2 Comparisons of expression levels of RAS protein on the wound surface in 3 groups of rats with pressure injuries at different time-points
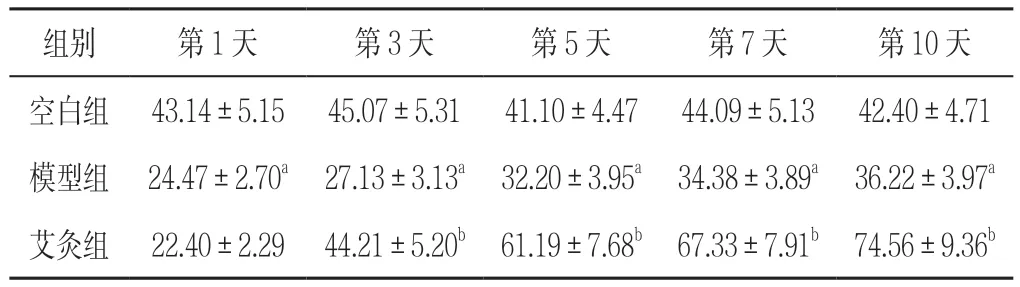
表23 组大鼠不同时间点压力性损伤创面组织中RAS 表达水平比较(±s,n=6)Table 2 Comparisons of expression levels of RAS protein on the wound surface in 3 groups of rats with pressure injuries at different time-points
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05
组别 第1 天 第3 天 第5 天 第7 天 第10 天空白组 43.14±5.1545.07±5.3141.10±4.4744.09±5.1342.40±4.71模型组 24.47±2.70a 27.13±3.13a 32.20±3.95a 34.38±3.89a 36.22±3.97a艾灸组 22.40±2.2944.21±5.20b 61.19±7.68b 67.33±7.91b 74.56±9.36b
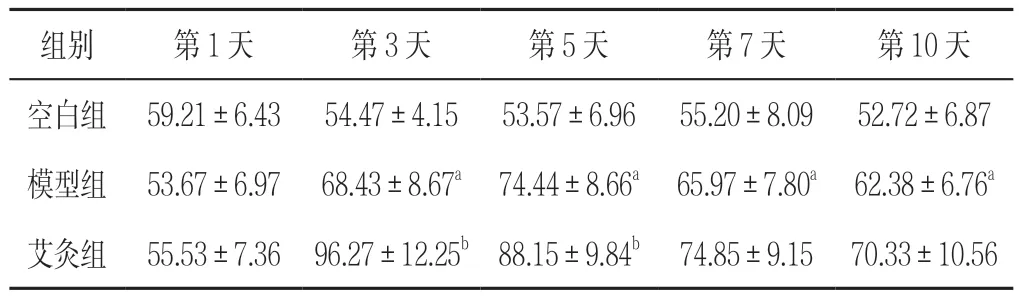
表33 组大鼠不同时间点压力性损伤创面组织中P-ERK1/2 表达水平比较(x±s,n=6)Table 3 Comparisons of expression levels of P-ERK1/2 protein on the wound surface in 3 groups of rats with pressure injuries at different timepoints

图23 组大鼠不同时间点压力性损伤创面组织中RAS 表达情况(×400)Figure 2 Expression of RAS protein on the wound surface in 3 groups of rats with pressure injuries at different time-points

图33 组大鼠不同时间点压力性损伤创面组织中P-ERK1/2 表达情况(×400)Figure 3 Expression of P-ERK1/2 protein on the wound surface in 3 groups of rats with pressure injuries at different time-points
3 讨论
《疡科心得集·疡证总论》[8]曾载:“夫病之来也……而其致病之由,又不越乎内因、外因二者。”压力性损伤通常继发于创伤截瘫、痿证、中风偏瘫等重大慢性疾病后,此类疾病的共性特点为因疾病限制活动,故丧失生活自理的能力并长期卧床。艾灸能够调畅气机,营卫自和,可消除久病所致的瘀血等病理产物。艾灸燃烧时利用其温热效应,可针对腧穴及所在经络发挥温经散寒及调节气血的作用,同时将艾绒的本身药效作用于其中,共奏行气活血,通经活络之功效[9]。另外,艾灸可以激发人体的正气,正气充实则足以抵御外来的邪气。研究表明,艾灸不仅能够明显抑制大肠埃希菌、绿脓杆菌及金黄色葡萄球菌,在改善血供方面兼具优势,其能够迅速加快肉芽组织的生长,炎症及其他渗出物亦由此得到有效的消散及吸收,继而使创面的愈合进程得到显著的加快,明显缩短创面修复所需时间[10-11]。
ERK 存在于诸多细胞中,具有稳定性较强的特点。杨忠华[12]认为电针也许通过激活RAS/RAF/MEK/ERK 信号通路发生级联反应后,发挥促进细胞增殖及分化的作用,由此保护了由于脑缺血致使的神经血管损伤。研究表明,VEGF 在损伤出现以后立即增高,3 d 达高峰,随后逐渐降低,对于这一现象考虑为自损伤出现至3 d 阶段,机体通过基因调控方式加快血管新生,3 d 后,由于其自身修复能力迅速下降故导致VEGF 低表达[13]。邵妍等[14]通过构建脑缺血-再灌注模型后,观察眼针运动疗法对脑缺血半暗带区VEGF 的影响,分别以基因和蛋白水平测定作为检测手段,发现正常组织中的VEGF表达不活跃,损伤出现后无论基因水平还是蛋白水平均呈过表达状态,继而加速侧支循环的建立,充分发挥脑保护的功能。另有研究曾报道,VEGF 及其受体的表达含量与局部缺血及缺氧的环境存在密切关系,后者会一定程度促进前者的表达,继而加速新生血管的形成[15]。根据上述研究结果可以推断,VEGF、VEGFR2 的表达状况可能与RAS/RAF/MEK/ERK 信号通路的启动及激活存在密切的关联。
本研究结果显示,VEGF 蛋白在正常皮肤组织中呈弱阳性表达,当压力性损伤出现后,其在创面组织中的表达呈先高后低趋势,其阳性表达部位在胞质中,表达于巨噬细胞及上皮细胞中。与空白组相比,模型组创面组织中VEGF 蛋白表达水平在各个时间点均显著升高。第1、3、5、7、10 天模型组压力性损伤创面组织中VEGF 表达水平高于空白组,第3、5 天艾灸组压力性损伤创面组织中VEGF 表达水平高于模型组。与正常组织相比,当压力性损伤出现后,其创面组织中RAS 蛋白表达先低后高的趋势,其阳性表达部位在胞质中。与空白组相比,模型组创面组织中RAS 蛋白表达水平在各个时间点显著下降,两组组内(即艾灸组和模型组)RAS 蛋白均呈逐渐增高的趋势。第1、3、5、7、10 天模型组压力性损伤创面组织中RAS 表达水平低于空白组,第3、5、7、10 天艾灸组压力性损伤创面组织中RAS 表达水平高于模型组。当压力性损伤出现后,创面组织中P-ERK1/2 蛋白表达较正常皮肤组织呈先高后低趋势,其阳性表达部位在胞质中,两组组内(艾灸组和模型组)P-ERK1/2 蛋白表达水平均呈先高后低趋势,但在表达峰值方面确有区别,前者峰值在治疗3 d 后,而后者峰值却在碘伏处理5 d 后。第3、5、7、10 天,模型组压力性损伤创面组织中P-ERK1/2 表达水平高于空白组,第3、5 天艾灸组压力性损伤创面组织中P-ERK1/2 表达水平明显高于模型组。
以上结果表明,压力性损伤出现后,创面组织中VEGF表达水平较正常组织呈高表达状态,考虑其属应激性增高状态,原因可能为损伤出现后创面局部处于缺血缺氧环境状态,致使VEGF 蛋白应激性升高,继而促进血管新生,用以满足对损伤部位的血供,但是随着上述创面局部缺血缺氧状态的改善,其创面自身修复的存在,肉芽组织随之呈逐渐增多趋势,继而VEGF 表达呈下降趋势。由此可以推断,当压力性损伤形成后,局部组织能够形成一种自身对外界的保护(即其能够通过促使VEGF 的分泌,使其成为高表达状态)。如若上述保护机制能够通过一种干预手段得到有效的延伸,换言之,寻求一种治疗手段能够促进压力性损伤创面组织VEGF 的表达和释放,就能够一定程度上缓解缺血-再灌注的进展,从而加速新生血管的生成,促进创面的愈合及修复。本研究结果恰揭示,艾灸干预能够分别从VEGF 表达水平及其表达时限两个方面兼具优势,即促进创面组织VEGF 表达水平的同时又提前其高峰值的表达时限,继而从整体上加速创面修复进程,缩短压力性损伤修复的所需时间,最终达到促进创面愈合的目的。压力性损伤形成后,创面组织中RAS 表达水平骤降,其在经过艾灸干预后发生显著变化而明显增加。RAS表达水平呈现的递增趋势说明RAS/RAF/ERK 信号通路可能参与了组织损伤的修复,艾灸干预促进压力性损伤创面组织VEGF 的释放后,呈瀑布式状态启动RAS/RAF/ERK 信号通路,并且对于这一通路中上游蛋白酶的激活需要刺激量的不断积累,当达到累积刺激阈值后方可激活相关的信号分子,因此艾灸干预可能通过激活RAS 蛋白启动上述信号通路。当压力性损伤出现后,P-ERK1/2 表达水平呈先高后低的趋势,模型组高峰值出现于碘伏处理5 d 后,而艾灸干预后将其表达高峰提前为治疗3 d 后。另外,艾灸干预在活性方面(即活化状态)促进ERK1/2 的磷酸化表达水平。由此推断,艾灸干预促进压力性损伤创面VEGF 的释放后,可能通过刺激量的累积阈值启动RAS/RAF/ERK 信号通路中的上游蛋白酶,并能够磷酸化通路中的下游蛋白ERK1/2,激活这一通路,将信号由细胞外转导至细胞内,促进调控细胞的增殖与迁移。鉴于免疫组化对于目的蛋白的检测手段在定量分析方面不够精准,尚属半定量分析,本课题组后续的研究中将着力于通过Western Blot法对靶蛋白进行定量分析,旨在最大程度上客观、精准地探讨艾灸促进压力性损伤组织血管新生的分子调控机制。
综上所述,艾灸干预从蛋白层面上调压力性损伤创面组织中VEGF 表达水平,其可能通过激活RAS/RAF/ERK 信号通路,上调RAS 蛋白表达水平、促进ERK1/2 蛋白的磷酸化水平,增强RAS/RAF/ERK 信号通路的活性,发挥促进血管内皮细胞增殖的作用。
作者贡献:于杰进行研究设计与实施、资料收集整理、撰写论文并对文章负责;李洪玲进行研究实施、评估、资料收集;于杰、赵惠进行论文的修订、英文的修订;孙忠人进行质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。

