胰腺基本病变——病理与影像
边云 蒋慧
1海军军医大学附属长海医院影像医学科,上海 200433;2海军军医大学附属长海医院病理科,上海 200433
【提要】 影像医学与病理学是胰腺疾病诊断中两门重要学科。病理学改变是影像学表现的基础,而影像学能为患者做到无创的治疗前判断,也能预测病理并为病理诊断提供参考。疾病在影像学上的每一个表现无不印证着病理学的每一个特征,准确的影像学诊断离不开坚实的病理学基础。
胰腺脏器位置深在,同时兼具内分泌和外分泌功能,是人体生命中重要的器官。但胰腺起源的疾病隐匿,进展快速,凶险难治,是目前医学界仍无明显进展的一大类疾病。影像医学与病理学是胰腺疾病诊断中两门重要学科。病理学强调的是直接观察,而影像学是间接的形态学观察;病理学观察的点比较局限,而影像学观察注重全面。病理学改变是影像学表现的基础,而影像学能为患者做到无创的治疗前判断,也能预测病理并为病理诊断提供参考。疾病在影像学上的每一个表现均印证着病理学的每一个特征,准确的影像学诊断离不开坚实的病理学基础。
一、位置
胰腺分为胰头、胰颈、胰体和胰尾。胰头位于肠系膜上静脉和门静脉汇合处的右侧缘,胰体位于肠系膜上静脉和门静脉汇合处至腹主动脉左缘,胰尾位于腹主动脉左缘至脾门[1]。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)、肿块型胰腺炎(mass-forming pancreatitis,MFP)和浆液性囊性肿瘤(serous cystadenoma,SCN)均以胰头部多见;分支型胰腺导管内乳头状黏液性肿瘤(branch duct intraductal papillary mucinous neoplasm,BD-IPMN)以胰头和钩突部多见;实性-假乳头状肿瘤(solid-pseudopapillary neoplasm,SPN)和黏液性囊性肿瘤(mucinous cystic neoplasm,MCN)多发生于胰体尾部[2]。
二、大小
肿块的部位、良恶性、有无功能均决定其发现时的大小。位于胰头部肿块,由于其生长空间狭小,较易引起胰胆管梗阻,发现时普遍较体尾部肿块体积小。恶性度较高的肿块(如PDAC),常引起腹痛、腰背部疼痛、体重下降以及CA19-9等肿瘤标志物的升高,发现时较良性或低度恶性肿瘤(如SCN、SPN、MCN)体积小。有功能的胰腺肿瘤,如功能性胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor,pNET)因肿瘤释放激素而致患者出现相应各自特异的临床症状,往往发现时体积较小。
三、形状和数量
胰腺肿块可以分为形状规则和不规则,肿块可以呈圆形、类圆形、分叶状。胰腺肿块基本以单发为主,多灶性肿块主要发生在pNET相关性综合征、分支型或混合型IPMN(图1A)、希-淋病(vonHippel-Lindau,VHL,图1B)、SPN(图1C)和胰腺转移瘤(图1D)。
四、包膜及边界
包膜分为真包膜和假包膜,真包膜是肿瘤本身固有的包膜,而假包膜是肿瘤缓慢生长并对周围组织进行性压迫,导致周围纤维增生而形成的包膜,虽然两者形成的机制不同,但两者成分相同,均是纤维包膜。真包膜较多发生于胰腺少见肿瘤,如胰腺神经鞘瘤、脂肪瘤、平滑肌肉瘤、孤立性纤维瘤、错构瘤和血管周上皮样肿瘤等,而假包膜多发生在pNET、SPN(图2),侵袭性强的肿块如PDAC、腺鳞癌往往无包膜。包膜的有无和是否完整,是肿块与周围胰腺分界是否清楚的病理基础[3]。包膜完整的肿瘤通常肿块与周围胰腺分界清楚,无包膜的肿瘤呈浸润性生长,与周围胰腺分界不清。包膜的变化也提示着疾病发展的病理过程,当原本完整的包膜出现不完整时提示肿瘤突破包膜呈浸润性生长,一定程度提示肿瘤有恶变倾向。
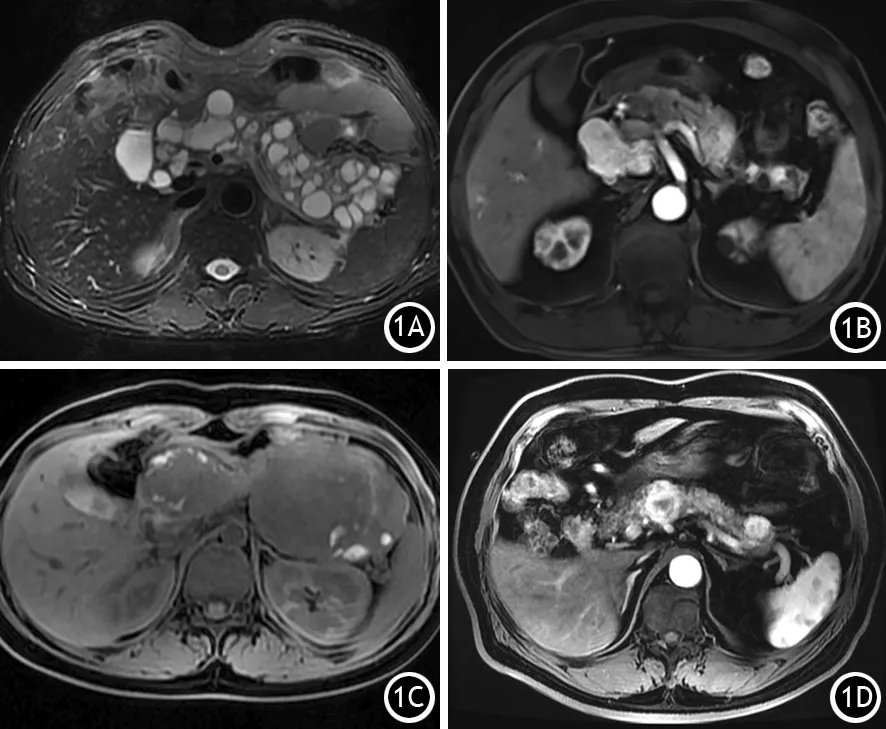
图1 混合型IPMN的FS-T2WI图(1A);多发神经内分泌肿瘤的FS-T1WI增强动脉期(1B);多发实性假乳头状肿瘤FS-T1WI图(1C);左肾透明细胞癌胰腺转移的FS-T1WI动脉期图(1D)
影像学上无论真包膜还是假包膜,由于是纤维包膜,因此CT平扫呈低密度,T1WI呈低信号,T2WI呈等高信号,增强后呈延迟强化(图2)。
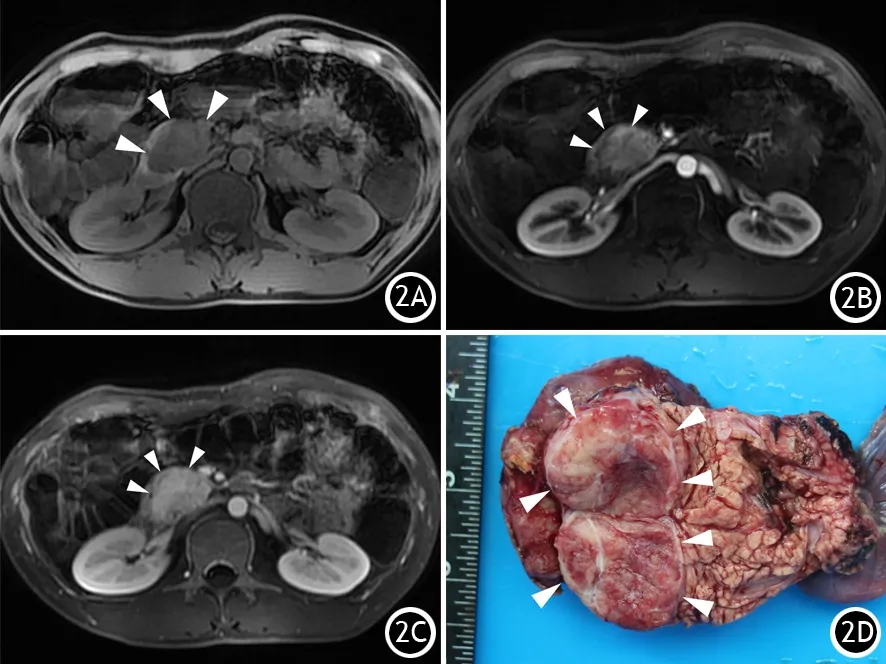
图2 有完整假包膜的G2无功能性胰腺神经内分泌肿瘤的FS-T1WI平扫(2A)、增强动脉期(2B)和延迟期(2C)图及大体标本(2D)
五、钙化或结石
胰腺疾病所致钙化属于营养不良性钙化,是指变性、坏死的组织或异物的钙盐沉积,较常见。在胰腺疾病中钙化或结石最常见的是慢性胰腺炎(CP,图3A),此外自身免疫性胰腺炎、pNET、SPN、SCN和MCN也可出现钙化。这些疾病的钙化表现特征均不相同。
CP的钙化或结石主要包括主胰管内结石(胰管结石,即真性结石)和分支胰管内结石(胰腺钙化,即假性结石)。热带性胰腺炎中真性结石多见,而酒精性胰腺炎多为假性结石。真性结石和假性结石的化学成分基本相同,主要由分布在表层的碳酸钙和位于中心的某些蛋白质、黏多糖构成,推测其形成机制相同,但形成机制尚未完全阐明。胰腺蛋白分泌减少、胰液中乳铁蛋白分泌增加、胰蛋白酶原早期沉积、骨桥蛋白过度表达以及钙浓度增高等都可能是胰管结石形成机制中的重要环节[4]。
胰腺非肿瘤性占位出现钙化以肿块型胰腺炎和胰腺假性囊肿(pancreatic pseudo cyst, PPC)最为多见。肿块型胰腺炎大多发生于CP基础上,所以肿块内部钙化常见。PPC的钙化更多发生在病史较长的CP中,其主要由成熟的肉芽组织及纤维结缔组织构成,病程较久,钙盐沉积,囊壁可发生钙化(图3B)。
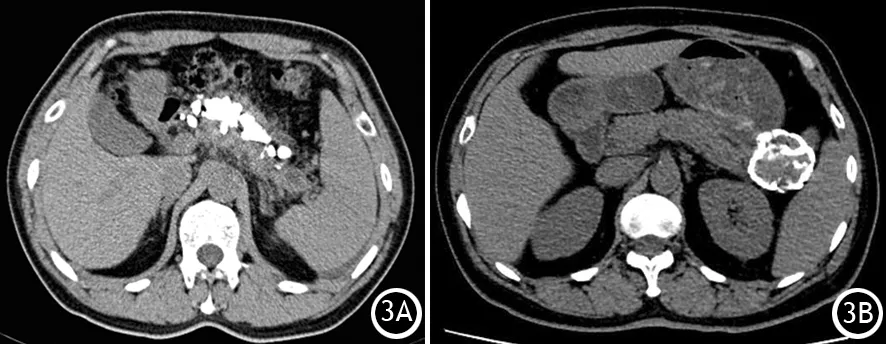
图3 慢性胰腺炎(3A)及胰腺假性囊肿(3B)的CT平扫图
肠型IPMN并发胶样癌时,肿瘤内部极其稠厚的胶冻样黏液易形成钙化(图4A、4B)。SPN内出血、坏死组织吸收不良可导致钙盐沉积出现钙化(图4C、4D)。pNET的钙化与SPN类似,也有可能与其内部激素分泌有关。
MCN钙化多见于囊壁和囊间分隔,表现为板层样钙化[5]。SCN钙化主要见于多囊型病灶,表现为中央呈“球形”的纤维瘢痕钙化,周围纤维分隔向中央聚集,与中央的纤维瘢痕相连,形成典型的“放射状”特征[6-7](图4E、4F)。
六、出血
炎症和肿瘤破坏血管或者肿瘤内部血管破裂即可出血。急性胰腺炎(AP)时大量炎症细胞浸润可以导致血管破裂并出血。肿瘤中最易出血的是SPN,SPN主要成分为肿瘤细胞和丰富的间质血管,肿瘤细胞围绕这些血管形成典型的“假乳头”样结构。当肿瘤细胞脱落,脆弱、薄壁的血管因缺乏有力的支架结构而破裂,瘤内发生出血(图5A、B)。大部分pNET都是以分化较好的肿瘤细胞和丰富的间质血管组成,且血管形成密集的毛细血管网,当肿瘤细胞破坏血管即可导致瘤内出血(5C、5D)。胰腺腺泡细胞癌(acinar cell carcinoma of pancreas,ACCP)间质内血管丰富,易发生出血[8]。PDAC因侵犯和阻塞胰管导致周围炎症,当炎症破坏周围血管时可导致瘤周出血。PDAC的罕见变异类型——未分化癌伴破骨细胞样巨细胞(undifferentiated carcinoma with osteoclast-like giant cell, UOC),因肿瘤由圆形或纺锤状、多形性肿瘤细胞和非肿瘤性的多核巨细胞构成,后者易导致肿瘤内部发生间质反应而出现坏死和出血[9]。SCN囊腔内以分泌清亮的浆液为特征,但部分SCN可见囊腔内有血性液体分泌。影像学上对出血检测最敏感的序列为MR的T1WI序列,表现为特征性的“高信号”。
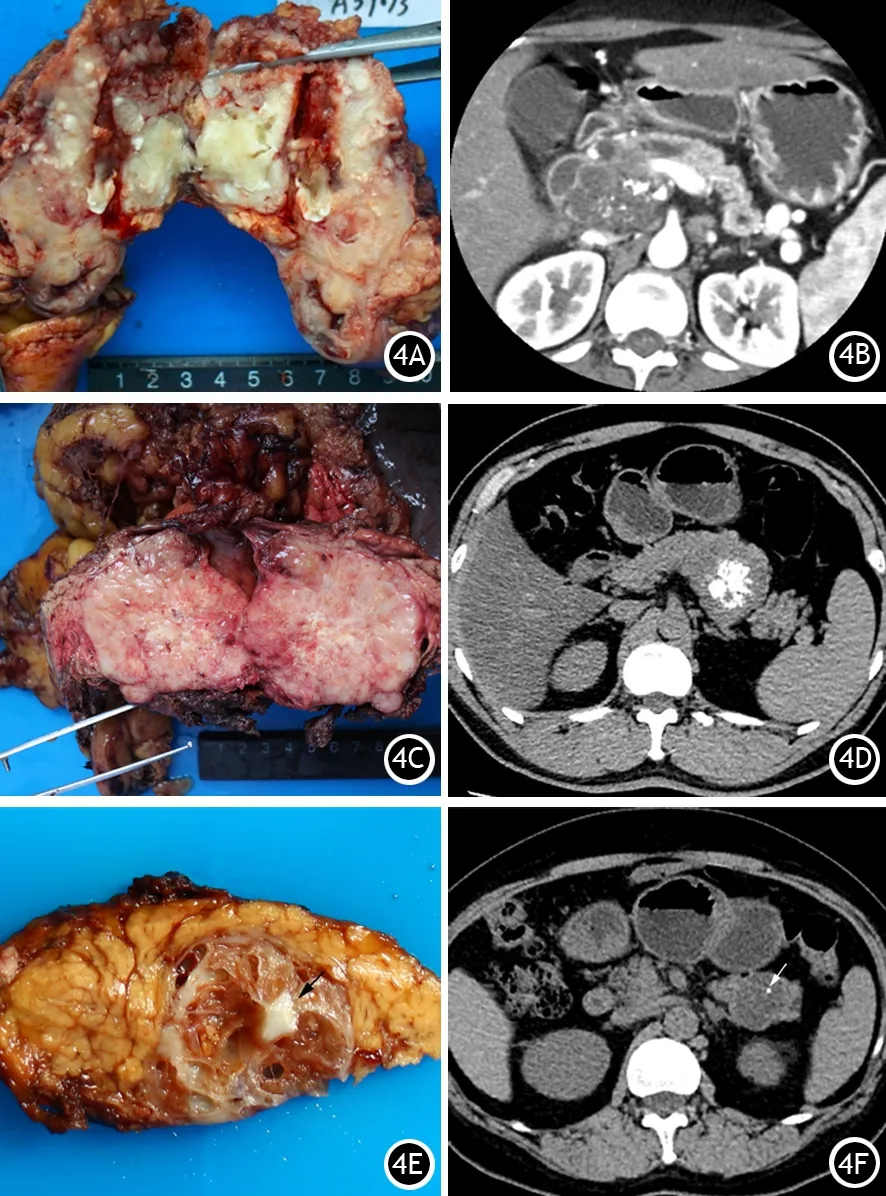
图4 胰腺导管内乳头状黏液性肿瘤并发胶样癌(4A、4B)、胰腺实性假乳头状肿瘤(4C、4D)和胰腺浆液性囊性肿瘤(4E、4F)的钙化病理标本及影像学表现
七、囊变
囊变可以与出血相关,如SPN和UOC。pNET的囊变可以由出血导致,但部分体积较小的pNET自发现即表现为囊性特征[10]。
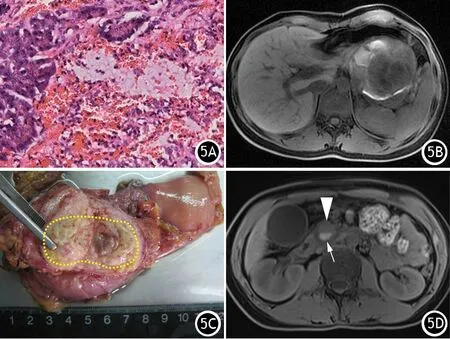
图5 胰腺实性假乳头状肿瘤典型的“假乳头”样结构,部分血管破裂出血(HE×40,5A),FS-T1WI见肿块内片状高信号(5B);胰腺神经内分泌肿瘤为胰头部的一枚灰黄色肿块(黄虚线),内部稍红色为出血(5C),FS-T1WI见肿瘤呈低信号(箭头),内部小片高信号(细白箭)即为瘤内出血区(5D)
囊变也可以由肿瘤内部坏死所致,最常见的为胰腺腺鳞癌(pancreatic adenosquamous carcinoma,PASC)。PASC的鳞癌和腺癌比例不同,影像学特征取决于肿瘤内部两者的比例、分布。鳞癌多呈实性巢状排列,中央乏血供,易发生退行性变而出现坏死而致囊变[11],CT呈低密度,T1WI呈低信号,T2WI呈高信号,增强后无强化(图6)。
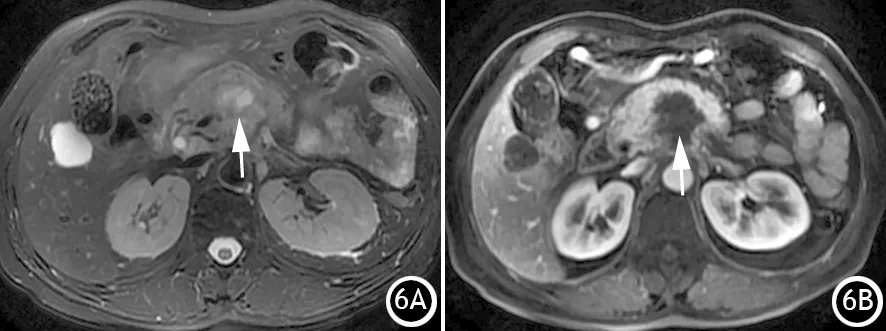
图6 胰腺腺鳞癌内部更高信号的囊变区(6A),增强门脉期无显著强化(细白箭,6B)
八、纤维化
纤维形成是人体组织愈合过程中的重要步骤,对于组织结构和功能的重建有重要意义,如果该生理过程出现了偏差,导致异常的或者病理性的纤维化,将会给受累的器官和组织带来严重的后果[12]。在胰腺病变中有两类疾病以异常明显的纤维化为其组织学特征,CP和PDAC。
CP早期阶段纤维化成分富含细胞,呈斑片状出现于小叶间。随着疾病进展,纤维化延伸入小叶内并相互融合,广泛纤维化形成瘢痕组织,其内细胞成分逐渐减少,胶原组织不断增多,即间质从细胞丰富型向胶原纤维为主型转变。PDAC可以是细胞为主,间质成分较少;也可以间质为主,而肿瘤细胞较少。
间质成分在影像学上表现为CT相对低密度,MRI上T1WI呈相对低信号,T2WI呈稍高信号或等高信号(图7)。
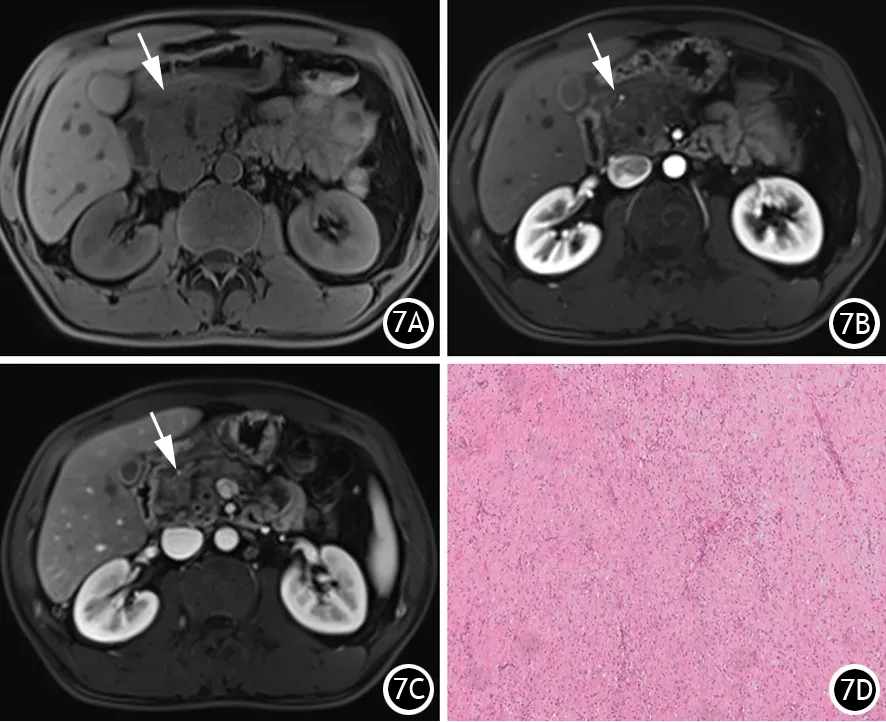
图7 重度CP的胰头部T1WI平扫呈低信号(7A),增强动脉期(7B)、门脉期(7C)不均匀轻度强化(细白箭),高倍镜下示肿块内间质以纤维成分为主(HE×40,7D)
九、胰管改变
胰管的改变取决于胰腺病变与胰管的关系。胰管外病变导致胰管的改变可以由炎症所致,也可以由肿瘤压迫和(或)侵犯胰管所致,表现为病变区域胰管狭窄或闭塞,上游胰管扩张。胰管内病变常导致病变区胰管扩张,或者病变与胰管相通,下游胰管扩张。MRCP或者沿着主胰管方向进行曲面重建的CT图像可以明确大部分胰腺肿块与胰管之间的关系。
CP由于炎症细胞对胰管的浸润、周围间质纤维化和胰管内结石,导致胰管不均匀狭窄与扩张,影像学表现为胰管扩张、狭窄,严重者呈“串珠样”改变。AIP由于IgG4细胞浸润胰管,导致胰管轻度狭窄,影像学表现为病变区胰管轻度狭窄,但不截断,上游胰管轻度扩张,称之为“胰管穿通”征[13]。低度恶性肿瘤(如pNET、SPN、SCN等)通常压迫病灶区的胰管,影像学表现为肿块处胰管狭窄或突然截断,并继发上游胰管扩张,但因肿块质地相对柔软、生长缓慢,上游胰管的扩张程度不如PDAC者显著(图8A、8B)。PDAC容易压迫或侵犯胰管,并有一定的围管性生长特点,影像学表现病灶区胰管突然狭窄或截断,继发上游胰管显著扩张,扩张的胰管多呈平滑状(图8C、8D),甚至还能显示扩张的分支胰管;早期小胰癌可以表现为无明显的肿块,仅仅有病灶区局限性胰管僵硬或稍狭窄,上游胰管轻度扩张,因此仔细观察胰管改变或S-MRCP后的细微变化有助于检出小胰癌。当胰头癌同时压迫或侵犯胆总管时合并存在软藤状扩张的胆总管,出现典型的“双管征”。
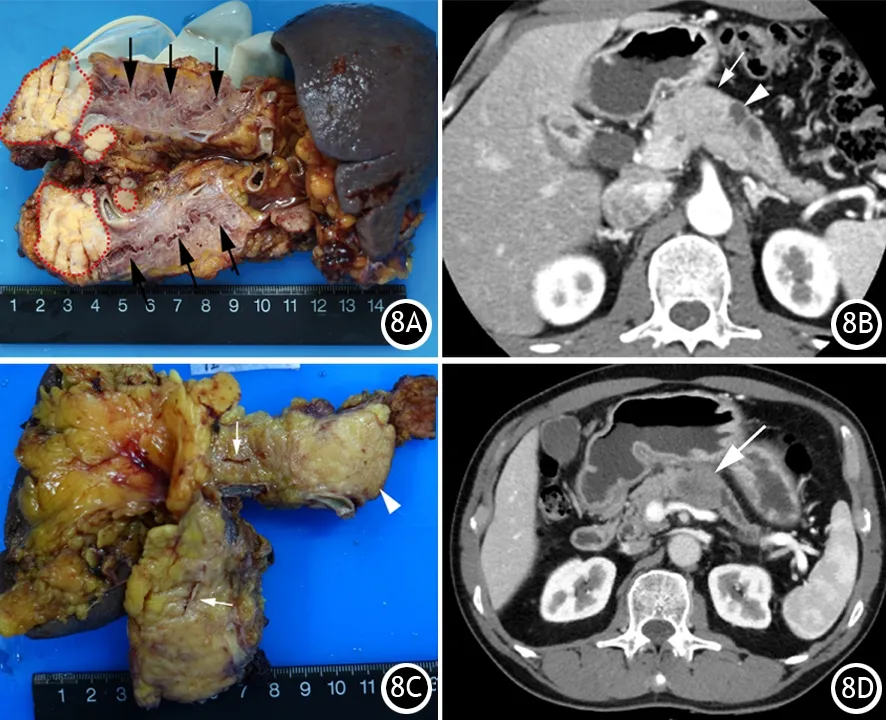
图8 胰腺神经内分泌肿瘤呈结节状,切面灰黄色(红虚线),周围淋巴结见肿瘤转移,上游胰腺明显萎缩,主胰管扩张(细黑箭,8A),CT增强动脉晚期肿块轻度强化的影(粗白箭),上游主胰管明显扩张(细白箭,8B);胰腺导管腺癌呈灰白色肿块(白箭头),肿块侵犯阻塞主胰管,导致上游主胰管扩张(细白箭)和胰腺实质萎缩(8C),CT增强门脉期肿块(白箭头)导致上游主胰管扩张(细白箭)和胰腺实质萎缩(8D)
与胰管相通的病变主要有IPMN、胰腺导管内管状乳头状肿瘤(intraductal tubulopapillary neoplasm,ITPN)和PPC,pNET罕见位于胰管内。IPMN按其形态分为分支胰管型、主胰管型和混合型,以前两者多见。分支胰管型表现为与胰管相通的“葡萄串状”的囊性病灶,常常伴有下游胰管的扩张;主胰管型表现为主胰管弥漫性或局段性扩张,胰管内可见壁结节;混合型则兼有二者表现。ITPN为生长在胰腺导管内产黏液较少的肿瘤,极罕见。PPC依据与胰管的关系分为与胰管相通和不相通两类,与胰管相通的PPC是由于胰管压力增高、胰管狭窄、结石和和蛋白栓阻塞导致胰管破裂[14]。
十、微血管与强化程度
胰腺动脉供血主要来自于腹腔动脉和胰十二指肠动脉的分支,这些分支行经小叶间结缔组织,沿途发出小叶支进入小叶内形成小叶内动脉供血外分泌腺体,其中有1~2支血管进入胰岛,形成有孔毛细血管网分布于胰岛细胞之间,然后汇成数条血管呈放射状离开胰岛,分布到周围的外分泌部,并再次形成包绕外分泌腺泡的毛细血管网,而后汇入小叶内静脉。由于出岛血管的前后两端均为毛细血管,故称胰岛-腺泡门脉系统[15]。胰腺小叶内毛细血管网丰富,当注入造影剂后,很快遍布整个胰腺,在动脉晚期或者门脉期显著强化,又因为胰腺内静脉引流网丰富,因此在延迟期造影剂很快退出。
当胰腺发生炎症或肿瘤时,其内的微血管状况与正常胰腺组织明显不同,因此增强后出现了多种强化方式。胰腺实体病变(炎症或肿瘤 )组织结构中的正常残留的胰腺组织、间质、肿瘤细胞的综合微血管面积决定了病灶的强化方式。
AP病变仅仅局限于间质,腺泡和导管基本正常,因此增强后水肿区胰腺组织因不同程度血管扩张、淤血,造影剂呈现“慢进慢出”的强化特征,胰腺实质往往强化正常或者轻度不均匀强化。当胰腺实质发生坏死时,由于坏死组织缺乏血供,增强后坏死区表现为无强化,因此增强检查是发现坏死灶和范围的有效方法。
CP主要成分为萎缩的胰腺小叶、扩张的胰管和不同程度的间质纤维化。残留的正常胰腺组织和间质纤维的比例及分布决定了CP的强化方式。CP早期以大量正常胰腺组织和轻度纤维化为其特征,影像上平扫很难发现,仅仅在动态增强出现轻度延迟强化。CP的中晚期正常胰腺组织逐渐被纤维化所取代,间质成分由细胞丰富型逐渐转变为乏细胞的胶原化纤维,影像上T1WI胰腺实质信号明显减低,T2WI呈稍高或等信号,增强后表现为明显的延迟强化。MRI显示优于CT,尤其对于早期CP的诊断。
大部分pNET由于间质内丰富的毛细血管网,表现为动脉期或门脉期的显著强化(明显超过正常胰腺组织,图9)。少数pNET的肿瘤细胞分化较差,间质纤维丰富,毛细血管减少,也可表现为轻度或延迟强化,此时较易被诊断为PC。
SPN间质内虽然血管丰富,但基本上是厚壁粗大的血管,这些血管通常有透明样变性和胶原化,因此即使肿瘤全部为实性,造影剂也只能缓慢经厚壁血管进入肿瘤组织。肿块增强后表现为动脉期轻度强化,延迟后渐进性充填强化,强化程度低于周围正常胰腺实质。
PDAC强化程度主要取决于肿瘤内微血管面积[16-17]。肿瘤间质、炎症间质和正常胰腺组织的微血管有效面积决定某一例PDAC的强化程度。镜下显示PDAC的肿瘤细胞和间质比例不同,炎症程度和范围也有不同;肿瘤内可以完全缺少正常胰腺组织,也可以残留较多的胰腺组织,而且范围分布不同,这些病理改变的差异表现是影像上PDAC不同强化程度和方式的机制(图10)。
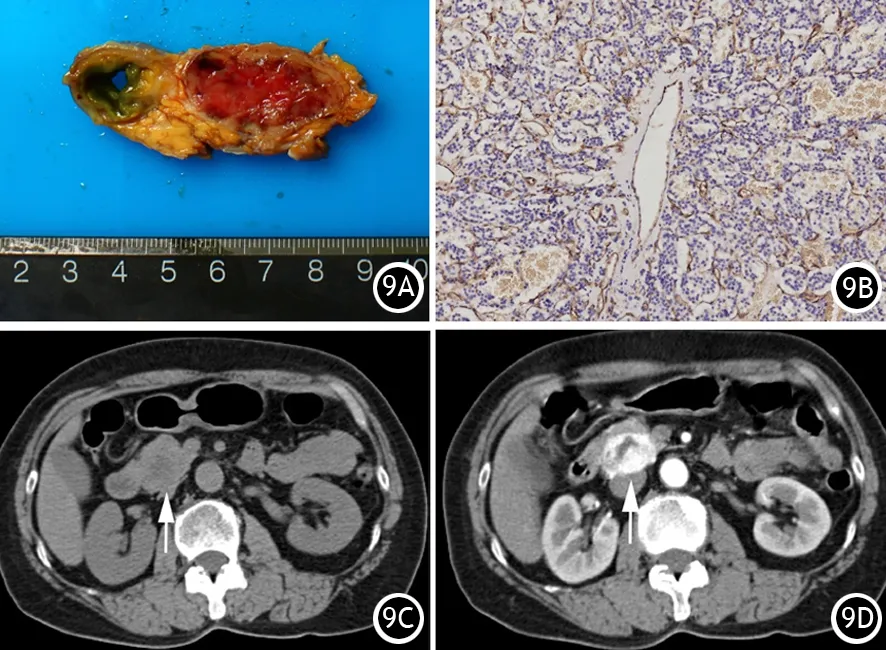
图9 无功能性胰腺神经内分泌肿瘤切面呈灰红色,实性,质中(9A),镜下见肿瘤间质血管丰富,少数管腔较大(IHC×100,9B),CT平扫示钩突部类圆形低密度肿块(粗白箭,9C),增强动脉期肿块显著不均匀强化,中心仍呈低密度(粗白箭,9D)
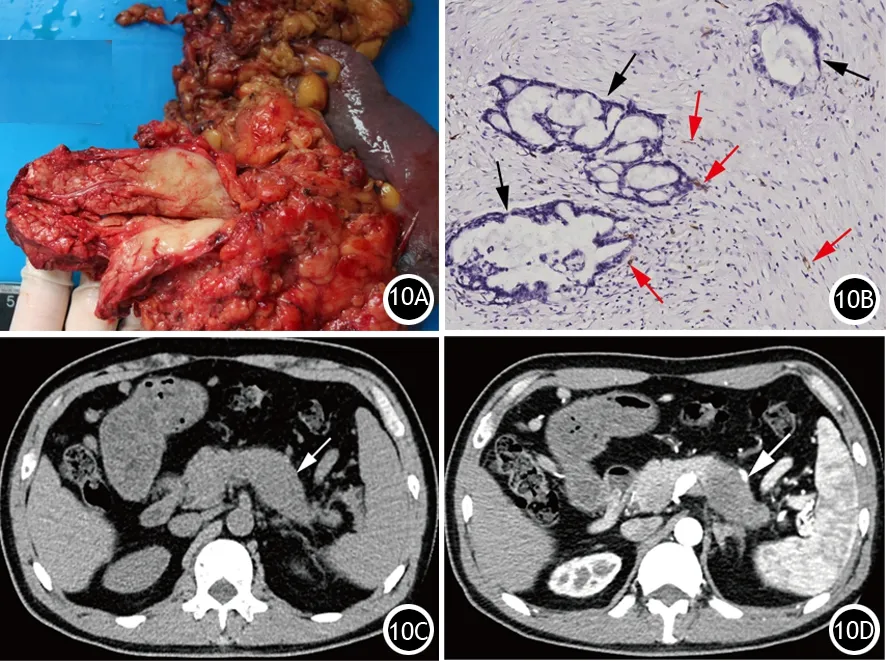
图10 胰腺导管腺癌呈灰白色(10A),CD34染色可见肿瘤间质内分布极少呈细线状血管(细黑箭,IHC×100,10B),CT平扫为类圆形、低密度肿块影(粗白箭,10C),增强见肿瘤呈低密度,无明显强化(粗白箭,10D)
SCN和MCN增强后强化的病理基础为上皮下间质内的毛细血管网,尤其在多囊多分隔的SCN常常会表现为动脉期显著强化,当囊腔较小、纤维分隔明显时易被误诊为pNET,MRI上的T2WI和MRCP的高亮信号(含液囊灶)有助于鉴别诊断[18-19]。此外,胰腺囊性肿块中实性成分如IPMN和SCN中的乳头因含有微血管成分,增强后会出现强化。
总之,胰腺疾病从单学科探索到多学科协作诊治,经历了几十年的发展历程。影像医学与病理学在胰腺疾病诊断中一个术前,一个术后;一个宏观,一个微观;一个无创,一个有创;一个雾里看花,一个镜下直观。随着影像设备的高端化,影像图像的精准化,特别是分子病理学的飞速发展,对影像科医师、病理科医师乃至胰腺疾病诊治涉及学科的每一位成员,既是机遇也是挑战。笔者所在的长海医院影像医学中心联合长海医院胰腺外科、病理科开展了胰腺疾病的高分辨CT和MRI扫描、大切片取材、结构化影像和病理报告,建立从宏观到微观、从术前到术后的紧密联系,不仅能够认识胰腺各类疾病的影像学表现,而且基于病理认识影像,并通过影像预测病理,帮助涉及胰腺疾病诊治的多学科成员深刻理解和掌握胰腺疾病的本质特征。
利益冲突作者声明不存在利益冲突

