人参白虎汤证发热大鼠模型的实验研究*
张序晴,王志琪,李 赛,周志华,彭 兰,李耀伟,蒲科婷,丛梦静
(1.湖南中医药大学研究生院,湖南 长沙 410208;2.湖南中医药大学药学院,湖南 长沙 410208;3.湖南省中药饮片标准化及功能工程中心,湖南 长沙 410208)
人参白虎汤出自《伤寒论》,主治症见“伤寒,若吐若下后,……,表里俱热,……,大渴,……,欲饮水数升者”,即阳明里热兼有气津两伤。虽人参白虎汤解热作用已被临床实践证实,然关于其解热作用机制研究的报道较少。课题组在前期通过网络药理学方法测算了人参促白虎汤解热作用的可能的免疫学机制[1],若要开展后续的实验验证则需使用相应的动物模型。
中医学认为苦寒中药能够损阴伤津,灌胃苦寒中药造模符合中医“下”法致虚的理论[2-3]。目前发热动物模型中,研究解热药物的作用及机制常用腹腔注射LPS复制的大鼠模型[4],课题组前期研究也发现,大鼠经灌胃大黄芒硝水煎液后再腹腔注射LPS可成功建立腹泻高热模型,且大鼠发热的具体情况与大黄芒硝水煎液的灌胃天数有关[5]。因此本次实验使用大鼠灌胃 0、1、3、5、7 d的大黄芒硝汤并结合腹腔注射 LPS的方法复制发热的大鼠模型,并对该模型大鼠的免疫功能进行评价,以期为人参白虎汤证发热动物模型的研究提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 动物 Wistar大鼠,SPF级,雄性,25只,体质量170~200 g。由北京维通利华实验动物技术有限公司提供,动物合格证号:1100111911002984,许可证号为SCXK(京)2016-0005。本实验的环境与设施条件符合中国国家标准《实验动物环境及设施》,动物实验单位的许可证编号为SYXK(湘)2013-0005。正式实验前,大鼠于温度基本恒定(22±2)℃,相对湿度不发生较大改变(55±2)%的实验环境中适应性饲养3 d(每只大鼠每天喂食1次,每次喂食15 g大鼠饲料,并提供水源)。
1.1.2 药物 大黄(饮片,湖南横岳中药饮片有限公司,批号:19100103);芒硝(饮片,湖南省宏华中药饮片有限公司,批号:181204);LPS(sigma 公司,批号:L-2880)。
1.2 药液的制备 大黄芒硝汤制备[6]:大黄与芒硝按照4∶3的比例配伍,制备时首先称取适量大黄放置于1 000 mL圆底烧瓶中,随后加入10倍量蒸馏水,浸泡30 min。再使用电热套加热的冷凝回流装置,将浸泡过的大黄加热,至溶液沸腾后并保持微沸状态15 min。随后将所制得水煎药液用纱布(两层)趁热过滤,取滤液,并将其趁热加入装有已称好芒硝的烧杯中,边加热边搅拌使芒硝充分溶解。随即在减压旋转蒸发仪中将大黄芒硝水煎药液进行浓缩,浓缩后所得的药液中每1 mL应含生药1.30 g。
LPS溶液制备[7]:将LPS用0.9%氯化钠注射液进行稀释,最终配置成 100 μg/mL的LPS溶液。LPS溶液于临用前新鲜配制。
1.3 动物的分组与造模 经过适应性饲养的Wistar大鼠按体质量分层随机分为5组,分别为灌胃0 d组、灌胃1 d组、灌胃3 d组、灌胃5 d组、灌胃7 d组,每组5只。各组动物于正式实验第1天起,每天2次,连续 7 d 定时(早上 8∶30 和晚上 18∶30)进行体温测定以及灌胃大黄芒硝汤(按照1 mL/100 g体积给药)。灌胃0 d组连续7 d按上述方法灌胃给予提药用的超纯水;灌胃1 d组按上述方法连续6 d灌胃给予蒸馏水,在实验第7天灌胃大黄芒硝汤;其余各组以此类推进行灌胃操作。实验动物于正式实验第7天前6 h进行禁食,最后一次灌胃大黄芒硝汤后观察大鼠是否有腹泻情况产生,出现腹泻后行腹腔注射LPS溶液1次,给药剂量为100 μg/kg。
1.4 样本采集与指标检测
1.4.1 大鼠的一般状态 观察灌胃给药大黄芒硝汤后各组大鼠的活动以及呼吸频率、精神状态、皮毛色泽、粪便稀软程度等情况。
1.4.2 大鼠体温的变化 体温测量方法:将欧姆龙电子体温计(MC-347)涂上甘油插入大鼠肛门约2 cm处。于正式实验第7天,在大鼠灌胃给药大黄芒硝汤的末次,以出现明显腹泻为提示,之后每隔30 min测定大鼠体温1次,共计测定体温3次,并作为基础体温。随后注射LPS,每隔1 h测定1次体温,共测定体温11次。将注射LPS前后体温进行统计学对比。
1.4.3 生物样本采集 于正式实验第7天,末次灌胃后大鼠出现明显腹泻时分别收集各组粪便,随后进行第1次眼眶血样采集。再注射LPS,待测完最后一次体温,麻醉大鼠,通过腹主动脉进行第2次采血,并摘取大鼠脾脏。
1.4.4 相关指标检测 将所采集的大鼠粪便进行称重,放入烘箱烘干后,再称重,粪便含水量%=(烘干前质量-烘干后质量)/烘干前重量×100%;将大鼠脾脏称重并计算脾脏指数:脾脏指数=脾脏质量/大鼠体重×10;采用全自动血液分析仪将两次采集的血样进行血细胞计数。
1.4.5 统计学方法 实验数据采用SPSS21.0统计软件处理,计量数据均以均数±标准差(±s)表示,多组数据均采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠的一般状态 通过观察发现,随着灌胃天数的增加,灌胃1、3、5、7 d组大鼠较灌胃0 d组大鼠活动活跃程度出现明显降低,且饮水量表现出明显增高。灌胃1、3、5、7 d组大鼠的皮毛较灌胃0 d组大鼠明显失去光泽,产生粪便明显更加稀软。其中灌胃5 d组大鼠产生粪便的稀软程度较灌胃0、1、3、7 d组更加明显。
2.2 大鼠各项指标的变化
2.2.1 体温变化 注射LPS后大鼠的体温变化见表1。注射LPS 5 h后各组大鼠体温呈现出明显升高,随后继续升高。直到7 h左右体温升高达到峰值,且较基础体温有显著的统计学差异(*P<0.05),7 h后各组大鼠体温开始有下降趋势。其中灌胃5 d组较灌胃0、1 d组最早出现体温升高且体温极值最大,较灌胃0、1、3、7 d组体温最先升高到极值。
表 1 注射 LPS后 1~10 h各组大鼠体温(±s,n=5,℃)
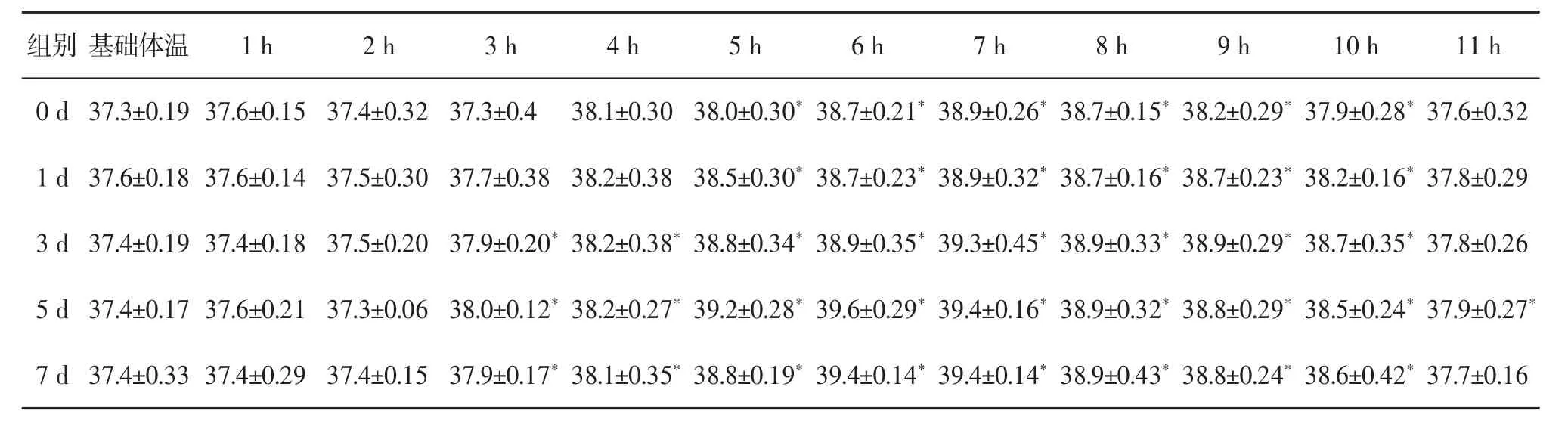
表 1 注射 LPS后 1~10 h各组大鼠体温(±s,n=5,℃)
注:与基础体温比较,*P<0.05
组别0 d基础体温 1 h 2 h 3 h 4 h 5 h 6 h 7 h 8 h 9 h 10 h 11 h 37.3±0.19 37.6±0.15 37.4±0.32 37.3±0.4 38.1±0.30 38.0±0.30*38.7±0.21*38.9±0.26*38.7±0.15*38.2±0.29*37.9±0.28*37.6±0.32 1 d 37.6±0.18 37.6±0.14 37.5±0.30 37.7±0.38 38.2±0.38 38.5±0.30*38.7±0.23*38.9±0.32*38.7±0.16*38.7±0.23*38.2±0.16*37.8±0.29 3 d 37.4±0.19 37.4±0.18 37.5±0.20 37.9±0.20*38.2±0.38*38.8±0.34*38.9±0.35*39.3±0.45*38.9±0.33*38.9±0.29*38.7±0.35*37.8±0.26 5 d 37.4±0.17 37.6±0.21 37.3±0.06 38.0±0.12*38.2±0.27*39.2±0.28*39.6±0.29*39.4±0.16*38.9±0.32*38.8±0.29*38.5±0.24*37.9±0.27*7 d 37.4±0.33 37.4±0.29 37.4±0.15 37.9±0.17*38.1±0.35*38.8±0.19*39.4±0.14*39.4±0.14*38.9±0.43*38.8±0.24*38.6±0.42*37.7±0.16
2.2.2 脾脏指数、粪便含水量和血细胞计数 灌胃天数对大鼠脾脏指数以及粪便含水量的影响见表2。与灌胃0 d组比较,灌胃1、3、5、7 d组的脾脏指数均出现明显下降,粪便含水量均出现升高。其中灌胃5 d组较灌胃0 d组脾脏指数的变化显著,较其他灌胃组的粪便含水量有明显升高。
灌胃天数对大鼠血液中各类细胞数目的影响见表3。通过比较注射LPS前后的数据可以发现各组大鼠的白细胞及中性粒细胞数均有增加,淋巴细胞数有所减少。且其中灌胃5 d组的白细胞和中性粒细胞数较灌胃1、3、7 d组明显增多,而淋巴细胞的数目较灌胃0 d组有明显减少。
表2 灌胃天数对大鼠脾脏指数以及粪便含水量的影响(±s,n=5)
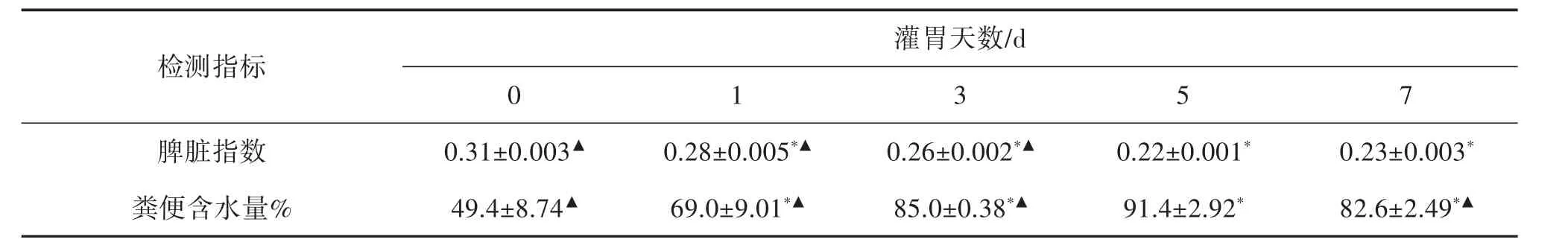
表2 灌胃天数对大鼠脾脏指数以及粪便含水量的影响(±s,n=5)
注:与灌胃0天组比较,*P<0.05;与灌胃5天组比较,▲P<0.05
灌胃天数/d检测指标0 1 3 5 7脾脏指数 0.31±0.003▲ 0.28±0.005*▲ 0.26±0.002*▲ 0.22±0.001* 0.23±0.003*粪便含水量%49.4±8.74▲ 69.0±9.01*▲ 85.0±0.38*▲ 91.4±2.92* 82.6±2.49*▲
表3 灌胃天数对大鼠血液中各类细胞数目的影响(±s,n=5)
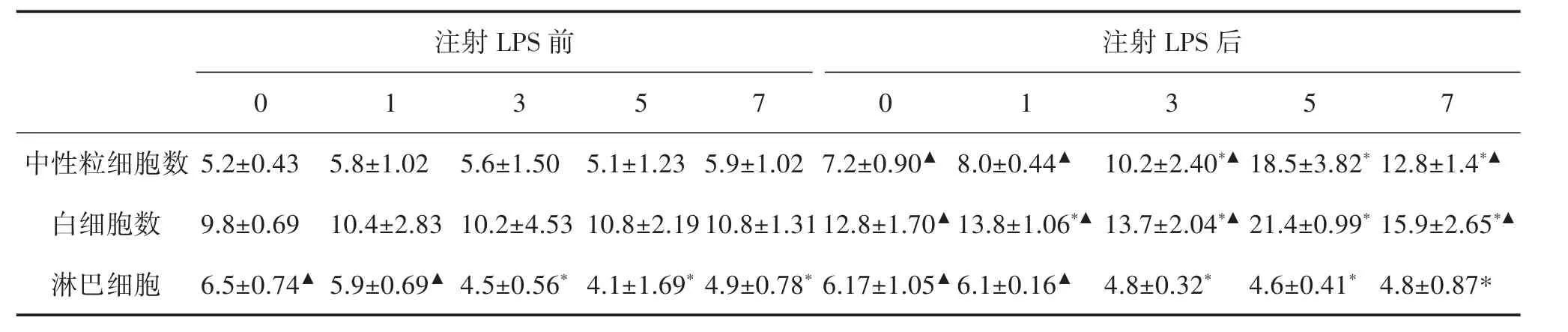
表3 灌胃天数对大鼠血液中各类细胞数目的影响(±s,n=5)
注:与灌胃0天组比较,*P<0.05;与灌胃5天组比较,▲P<0.05
注射LPS前注射LPS后0 1 3 5 7 0 1 3 5 7中性粒细胞数 5.2±0.43 5.8±1.02 5.6±1.50 5.1±1.23 5.9±1.02 7.2±0.90▲ 8.0±0.44▲ 10.2±2.40*▲ 18.5±3.82*12.8±1.4*▲白细胞数淋巴细胞9.8±0.69 10.4±2.83 10.2±4.53 10.8±2.1910.8±1.3112.8±1.70▲ 13.8±1.06*▲ 13.7±2.04*▲ 21.4±0.99*15.9±2.65*▲6.5±0.74▲ 5.9±0.69▲ 4.5±0.56*4.1±1.69*4.9±0.78*6.17±1.05▲ 6.1±0.16▲ 4.8±0.32* 4.6±0.41*4.8±0.87*
分析以上数据发现,灌胃5 d组大鼠注射LPS后升温潜伏期最短,且升温达到极值时间最短,体温极值最大,其粪便含水量最高。在血液中的各类细胞的数目中灌胃5 d组大鼠较其他灌胃组的白细胞和中性粒细胞明显增加,淋巴细胞的数目同灌胃0 d组相比明显减少。
3 讨论
高热是多种临床疾病中常见的表现形式,并且由高热所致的体征(如体温调节紊乱、体质减弱等)变化,往往对应着不同的发热机理[8]。现有关于解热药物的治疗机理研究以及发热大鼠模型的建立大多基于现代医学理论,基于中医药理论对解热药机理的研究,及针对中医热证的模型并不多见[9]。已有虚热证动物模型的造模往往采用给大鼠灌胃热性中药(多为复方)合并腹腔注射致热药物和激素类药物或高强度运动的方法,致使大鼠阴液大损[10-12]。
人参白虎汤证属中医气分热证之阳明病,系体内阴阳调节紊乱,热气盛盈,邪热未被完全从体内清除,表现为气阴大伤,治疗宜清热、滋阴,补益[13]。《伤寒论》中关于人参白虎汤的原文为“伤寒,若吐若下后,七八日不解,热结在里,表里俱热,时时恶风,大渴,舌上干燥而烦,欲饮水数升者,白虎加人参汤主之”,提示如应用中医的“下”法引起体虚再结合LPS复制发热动物模型很可能符合人参白虎汤证。中医认为苦寒中药能够损阴伤津,灌胃苦寒中药造模符合中医“下”法致虚的理论。现大多数研究使用的腹腔注射LPS致热也是制备发热模型的经典方法。气血津液亏损导致的体虚与免疫有着高度相关性[14],发热与天然免疫及炎症反应密切相关[15-16],故炎症和免疫功能的相关指标可作为评价体虚高热模型的指标之一。
在炎症发生的过程中,中性粒细胞会通过一系列联级反应来对抗人体中出现的炎症,从而起到维持人体的机体稳态平衡。而白细胞在抑制炎症方面起着至关重要的调节解作用。因此当炎症反应发生时,中性粒细胞的数目与白细胞数目均会有所提升[17-18]。淋巴细胞则是免疫系统中重要的细胞,可以起到对免疫的调节作用,当免疫功能急剧减弱时会出现淋巴细胞的减少[19]。同样在免疫功能中起着重要作用的还有脾脏这一脏器,当免疫功能低下的时候脾脏指数也会随之下降[20-21]。
实验的体温变化与粪便含水量数据显示,灌胃大黄芒硝汤的天数对发热及腹泻程度有影响,且灌胃5 d组的腹泻发热效果最好。实验结果也表明白细胞与中性粒细胞的数目同腹腔注射LPS所致的发热密切相关,具体表现为腹腔注射LPS后白细胞和中性粒细胞的数目增加;而脾脏指数与淋巴细胞的数目则同灌胃大黄芒硝汤后所致的体虚有关,且灌胃大黄芒硝汤天数不同,脾脏指数和淋巴细胞的减少也有所不同。其中灌胃5 d组白细胞与中性粒细胞数以及脾脏指数和淋巴细胞数的变化均是最为显著的,且具有统计学意义。
中医药实验研究中,复制方证动物模型是难点之一。本次实验研究发现,灌胃苦寒性泻下中药大黄芒硝汤结合注射LPS可以成功建立体虚高热模型,其脾脏指数与各类血细胞计数是体虚高热动物模型免疫功能的评价的重要指标。从统计学差异比较中可以得出灌胃5 d组可以建立出更为理想的体虚高热大鼠模型,也更符合人参白虎汤证。该模型的建立可为人参白虎汤解热机理的实验研究提供基础。

