解没食子酸链球菌代谢产物对结肠癌细胞生长的调控作用及其机制研究
任建峰 张其胜 王 慧 陆颖影 靖大道#
上海交通大学附属第一人民医院消化科1(200080) 上海市第四人民医院消化科2
背景:解没食子酸链球菌(SG)可能通过其代谢产物改变结肠微环境,使人体转变为倾向肿瘤形成的高危状态。目的:探讨SG代谢产物(SGM)对结肠癌细胞生长的调控作用及其机制。方法:常规培养人结肠癌细胞株SW620,并分为空白组(A组)、健康人肠道菌群组(B组)、双歧杆菌代谢产物组(C组)、SGM组(D组)和双歧杆菌代谢产物+SGM组(E组)。采用CCK-8法检测细胞增殖能力,细胞划痕实验检测细胞迁移能力,蛋白质印迹法检测β-catenin蛋白表达,实时PCR法检测c-myc mRNA表达。结果:与A组、B组、C组相比,D组、E组细胞增殖活力显著升高(P<0.05),细胞迁移能力显著升高(P<0.05),β-catenin蛋白表达显著升高(P<0.05),c-myc mRNA表达显著升高(P<0.05);而D组与E组上述指标相比无明显差异(P>0.05)。结论:SG可通过其代谢产物增强结肠癌细胞的增殖、迁移能力,该作用可能是通过激活Wnt/β-catenin信号通路而实现的。而联合双歧杆菌代谢产物并不能抑制SGM对结肠癌细胞增殖和迁移的促进作用。
结直肠癌是人类第三大癌症,也是导致癌症相关死亡的第四大常见原因[1]。结直肠癌的发病是一个多因素、多步骤、多途径的过程,涉及进行性分子遗传学改变和相关的组织形态学改变。其发生、发展的原因尚不清楚,可能是遗传与环境因素共同作用的结果[2]。人类肠道环境复杂,细菌、真菌与病毒共存,数量高达100万亿,是人类细胞的10倍。生理情况下,肠道细菌参与人体多种基本生理活动,如促进肠道发育成熟、调节人体对营养物质的消化和吸收、抵抗病原体的入侵等[3]。肠道菌群的稳态一旦被破坏,可导致种疾病,甚至某些肠道菌群可能通过信号通路机制参与结直肠癌的发生、发展。
近年来,已有越来越多的研究结果证实牛链球菌(Streptococcusbovis)感染与结直肠癌的发生有关[4-6],其在肿瘤微环境中具有增殖优势,而在健康肠道中的感染能力较弱,但具体的致癌机制目前尚未完全清楚。解没食子酸链球菌(Streptococcusgallolyticus, SG)属牛链球菌,与其他种类相比,SG更有可能参与结直肠癌的发生、发展[7]。本研究通过观察解没食子酸链球菌代谢产物(Streptococcusgallolyticusmetabolites, SGM)对人结肠癌细胞株SW620生长、迁移的影响,旨在探讨其与结肠癌发生、发展的关系及其可能的作用机制。
材料与方法
一、主要材料与仪器
SG由上海生物科学研究院惠赠,从树袋熊的排泄物中分离,由Micro Scan Auto SCAN4微生物分析仪鉴定结果为SG(概率:99%);双歧杆菌(CICC-6071)购于北京中科质检生物技术有限公司,置于BHI培养基中培养。人结肠癌细胞株SW620购自上海信裕生物科技有限公司;CCK-8检测试剂盒购自北京鼎国生物昌盛技术有限责任公司;β-actin抗体(工作浓度为1∶500)、β-catenin抗体 (工作浓度为1∶1 000)、IgG二抗(工作浓度为1∶500)购自美国Santa Cruz公司。
Step One Plus荧光实时定量PCR扩增仪(Applied Biosystems); VM-10 WiseMix VM 涡旋振荡器;SDS-PAGE电泳仪、Universal hood Ⅱ化学发光成像仪(Bio-Rad)。
二、方法
1. 细菌培养和代谢产物提取
①健康人肠道菌群的分离培养:将1 g健康志愿者(否认家族性遗传疾病史,完善内镜、生化等各项检查,结果均正常)粪便接种至庖肉培养基中,37 ℃培养3~5 d。无菌纱布过滤, 14 000 r/min离心15 min,去上清。称取1 g细菌备用,剩余细菌以无菌纯甘油重悬后-80 ℃保存待测。
②细菌代谢产物的提取:将1 g细菌接种于200 mL DMEM/F12培养基中,37 ℃培养3 d;14 000 r/min 离心15 min,取上清,-80 ℃保存待测。
2. 细胞培养和分组:人结肠癌细胞株SW620常规传代培养。取对数生长期细胞,制备成细胞悬液,并分为空白组(A组)、健康人肠道菌群组(B组)、双歧杆菌代谢产物组(C组)、SGM组(D组)和双歧杆菌代谢产物+SGM组(E组),A组仅加入培养基,B、C、D组分别按体积比加入相应的5%细菌代谢产物,E组加入各5%的双歧杆菌代谢产物和SGM。
3. 结肠癌细胞增殖的检测:取各组对数生长期细胞1×105个/mL,接种于96孔培养板上,每孔100 μL,每组设15复孔。37 ℃ 5% CO2培养箱继续培养。待细胞完全贴壁后,每孔加入10 μL CCK-8试剂,继续培养24、48、72 h,上酶标仪检测450 nm波长处的吸光度(A)值,绘制细胞生长曲线。
4. 结肠癌细胞迁移的检测:在6孔板背后均匀划横线,间隔0.5 cm,每孔至少穿过5条线。取各组对数生长期细胞5×106个/mL,制备成细胞悬液,接种于6孔板上,每孔100 μL,培养24 h。PBS洗3次,去除划下的细胞,加入无血清培养基,37 ℃ 5% CO2培养24 h后取样,拍照,观察细胞迁移情况。
5. 蛋白质印迹法检测β-catenin蛋白表达:取各组对数生长期细胞,制备成细胞悬液,RIPA裂解液裂解细胞,提取总蛋白,Lowry法测定蛋白浓度。取总蛋白40 μg上样,30~50 mA恒流进行电泳跑胶。使用湿转法将分离胶上的蛋白转到硝酸纤维素膜上,100 V恒压90 min后转膜。5%脱脂奶粉封闭1 h,洗涤,加入β-catenin抗体、β-actin抗体4 ℃孵育过夜;PBST洗膜5 min×3次,加入IgG二抗室温孵育约1 h,PBST洗膜5 min×3次。ECL法显色。计算目的蛋白的相对表达量。
6. 实时定量PCR法检测c-myc mRNA表达:行预实验检测引物扩增的Ct值和融解曲线。取各组细胞RNA,逆转录合成cDNA,行PCR反应。c-myc引物上游:5’-TCA GAG AAG CTG GCC TCC TA-3’,下游:5’-TCC AGC AGA AGG TGA TCC AGA-3;以β-actin作为内参,引物上游:5’-TTC GAG CAG GAA TCT GAC ACA T-3’,下游:5’-CAA TGA TGG CTG GAA GAG GAC-3’。PCR反应体积共20 μL,内含SYBR®Green Realtime PCR Master Mix(2x)10 μL、10 μmol/L上、下游引物各1 μL、模板cDNA 2 μL、RNase Free ddH2O 6 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火30 s,70 ℃延伸1 min,共40个循环;60~95 ℃缓慢升温,融解曲线信号检测30 min。采用2-ΔΔCt法计算目的基因的mRNA相对表达量。
三、统计学分析
结 果
一、细胞增殖情况
CCK-8法显示,培养48 h、72 h后,D组细胞增殖活力均显著高于A组、B组和C组(P<0.05),说明SGM具有更强的促进SW620细胞增殖的能力。E组细胞增殖活力均显著高于A组、B组和C组(P<0.05),而B组、C组细胞增殖活力与A组相比无明显差异(P>0.05),D组与E组相比亦无明显差异(图1、表1)。提示联合双歧杆菌代谢产物并不能降低或抑制SGM的促细胞增殖能力。
二、细胞迁移情况
细胞划痕实验显示,SW620细胞培养24 h后,D组细胞迁移距离显著高于A组、B组和C组(P<0.05),提示SGM具有更强的促进SW620细胞迁移的能力。同时,E组细胞迁移距离显著高于A组、B组、C组(P<0.05),而B组、C组细胞迁移距离与A组相比无明显差异(P>0.05);D组与E组之间细胞迁移距离相比亦无明显差异(P>0.05)(图2、表2)。提示联合双歧杆菌代谢产物并不能降低或抑制SGM促进SW620细胞迁移的能力。
三、β-catenin蛋白表达情况
蛋白质印迹法结果显示,D组β-catenin蛋白表达显著高于A组、B组和C组(P<0.05), 提示SGM可能通过激活Wnt信号通路,进一步调控下游肿瘤相关基因的表达。同时,E组β-catenin蛋白表达显著高于A组、B组和C组(P<0.05),而B组、C组β-catenin蛋白表达与A组相比无明显差异(P>0.05);D组与E组之间β-catenin蛋白表达亦无明显差异(P>0.05)(图3、表2)。提示联合双歧杆菌代谢产物并不能降低或抑制SGM激活Wnt信号通路的能力。

图1 不同代谢产物对SW620细胞增殖活力的影响

组别24 h48 h72 hA组0.14±0.060.25±0.020.51±0.17B组0.10±0.020.27±0.070.65±0.28C组0.12±0.030.30±0.070.59±0.27D组0.26±0.080.76±0.17∗1.25±0.10∗E组0.28±0.100.74±0.10∗1.19±0.05∗
*与相应时间点的A、B、C组比较,P<0.05

图2 不同代谢产物对SW620细胞迁移能力的影响(细胞划痕实验)
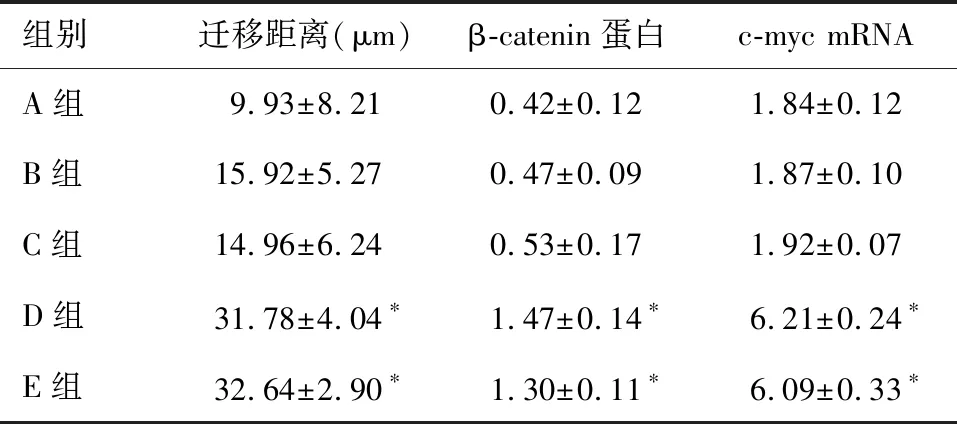
组别迁移距离(μm)β-catenin蛋白c-myc mRNAA组9.93±8.210.42±0.121.84±0.12B组15.92±5.270.47±0.091.87±0.10C组14.96±6.240.53±0.171.92±0.07D组31.78±4.04∗1.47±0.14∗6.21±0.24∗E组32.64±2.90∗1.30±0.11∗6.09±0.33∗
*与A、B、C组比较,P<0.05
四、c-myc mRNA表达情况
定量PCR法结果显示,D组c-myc mRNA表达显著高于A组、B组和C组(P<0.05),提示SGM可促进Wnt信号通路下游肿瘤相关靶基因c-myc mRNA表达。同时,E组c-myc mRNA表达亦显著高于A组、B组和C组(P<0.05),而B组、C组c-myc mRNA表达与A组相比无明显差异(P>0.05);D组与E组之间c-myc mRNA表达水平亦无明显差异(P>0.05)(图4、表2)。提示联合双歧杆菌代谢产物并不能降低或抑制SGM促进c-myc mRNA表达的能力。

图3 不同细菌代谢产物对SW620细胞中β-catenin蛋白表达的影响(蛋白质印迹法)

图4 各组SW620细胞中c-myc mRNA表达情况(定量PCR法)
讨 论
肠道微生态与结直肠癌的发生、发展有密切关系,肠道菌群在生理条件下一般保持动态平衡,一旦该平衡被打破,可能会引起各种肠道疾病的发生、发展。肠道菌群及其代谢产物作为环境因子,通过调控相关基因的表达,在结直肠癌中发挥重要作用[8],可直接或间接促进结直肠癌的发生、发展[9]。牛链球菌是第一个被发现与结肠癌发生相关的细菌,McCoy等于1951年报道了第一例与牛链球菌感染性心内膜炎相关的结直肠癌[10]。牛链球菌包括许多亚种,其中SG与结直肠癌的相关性最强,相关研究显示,SG感染患者结直肠癌、腺瘤的发生风险升高,是引起结肠癌的主要细菌之一[11-16]。
SG感染患者的结肠直肠癌和腺瘤的发生风险显著升高,提示SG在肿瘤的发展过程中发挥积极作用,但其作用机制目前尚不清楚。Kumar等[17]将SG与不同细胞株共培养,发现SG可能通过β-catenin对一些结肠癌细胞起促进生长和增殖的能力,且SG可促进小鼠结直肠癌模型肿瘤的生长。该研究认为SG感染促进人结肠癌细胞增殖的方式取决于细胞环境、细菌生长阶段和细菌与结肠癌细胞之间的直接接触。本研究应用SGM处理人结肠癌SW620细胞,结果显示细胞增殖能力显著高于空白组、健康人肠道菌群和双歧杆菌代谢产物组,提示SG可通过其代谢产物促进结肠癌细胞增殖,而无需与细胞直接接触。此外,本研究还发现,SGM组细胞增殖与双歧杆菌代谢产物+SGM组相比无明显差异,提示SGM促进细胞增殖的作用并未被双歧杆菌代谢产物所抑制。
肠道微生物构成的变化可诱导炎症微环境的形成,其代谢产物可能促进结肠癌的发生和转移。癌症的重要特征之一是细胞恶性增殖和转移,表现为细胞运动能力的提高。本研究发现,SGM具有更强的促进细胞迁移的能力,且双歧杆菌代谢产物并不能抑制这种作用,提示SG可能在结肠癌转移过程中也起有促进作用。
Wnt/β-catenin信号通路具有调节细胞增殖、极性、胚胎发育过程和组织内稳态的作用,其异常激活可导致包括肿瘤在内的多种疾病的发生[18-19]。β-catenin、c-myc是Wnt/β-catenin信号通路核心的下游靶基因,其过表达可增强DNA复制能力,促进DNA增殖[20]。本研究结果显示,SGM组和双歧杆菌代谢产物+SGM组β-catenin蛋白表达、c-myc mRNA表达均明显高于其余三个组别,提示SGM可激活Wnt信号通路,且双歧杆菌代谢产物并不能抑制这种激活,并可能进一步调控下游肿瘤相关基因的表达。
综上所述,本研究从细胞增殖、Wnt信号通路的关键蛋白β-catenin蛋白表达以及下游分子c-myc mRNA表达上阐述了SGM对人结肠癌SW620细胞增殖、迁移的调控作用,为肠道微生物与结肠癌发生、发展机制的研究奠定了一定的实验基础。下一步应从肿瘤组织标本中进一步探讨SG与结肠癌发生、发展的关系,以期为结肠癌的防治探索一种新的生物靶点。

