微创食管癌手术的治疗体会
张元松,魏 琪,秘泰云,彭传亮
(1.庆云县人民医院,山东 德州,253700;2.山东大学第二医院)
传统食管癌开胸手术由于胸壁、膈肌的完整性遭到破坏,其围手术期发病率、死亡率较高[1],这主要是由于手术创伤、术中失血造成的。随着腔镜技术的发展,微创食管癌切除术在食管癌治疗中的应用越来越广泛[2-3],其特点是减少手术创伤及失血,降低术后疼痛及镇痛要求,减轻呼吸、心脏功能损害,使患者迅速恢复。微创技术逐渐应用于食管恶性肿瘤的治疗[4]。胸、腹腔镜联合食管癌切除术需要在胸腔镜下游离食管、腹腔镜下游离胃,并于颈部吻合,由于技术难度大、操作复杂,在国内应用有限,主要在地市级以上医院开展,部分县级医院目前也正逐步开展[5-7]。本研究中,我们对胸、腹腔镜联合食管癌切除术治疗食管癌的效果进行了综合评价,以探讨与传统开胸手术相比此技术的安全性、有效性。
1 资料与方法
1.1 临床资料 2014年3月至2016年12月我院胸外科与山东大学第二医院胸外科联合,收集了98例接受手术治疗的食管癌患者,术前均未接受化疗或放疗。其中常规开胸手术53例(开胸组),胸、腹腔镜联合食管癌切除术45例(微创组)。患者临床表现主要为进行性吞咽困难、胸骨后不适、疼痛等。术前行CT扫描、上消化道钡餐检查、胃镜检查、血液及肺功能检查,并获得病理学诊断。患者CT扫描均无明显外侵,纵隔淋巴结未见明显肿大,钡餐检查均为食管上、中、下段病变,长1~4 cm。胃镜下活检病理均为鳞状细胞癌,未发现明显手术禁忌证。术后病理也均为鳞状细胞癌,其中6例为T1N0M0,21例为T1N1M0,35例为T2N0M0,17例为T2N1M0,19例为T3N0M0。术前两组患者临床资料具有可比性,见表1。
1.2 手术方法 采用全身静脉复合麻醉。开胸组按传统三孔法施术,即上腹、右胸、颈部切口。患者先取左侧卧位,经右胸切口完成胸段食管、肿瘤的游离,纵隔淋巴结的清扫;然后改平卧位,先开腹游离胃组织并清扫腹腔淋巴结,完成管胃的制作,再在左颈部做切口,游离颈段食管,将管胃上提进行吻合[8]。微创组患者先取左侧卧位,身体前倾30°;观察孔位于腋中线第7肋间,腋中线偏后第4肋间为主操作孔,副操作孔位于肩胛下线第6、9肋间(图1)。用电凝钩、超声刀游离胸段食管,并清扫食管旁、左右喉返神经旁、左右肺门、隆突下等处淋巴结(图2),术毕放置纵隔引流管与胸引流管。患者改为平卧位,头高脚低并向右侧倾斜30°。先于左颈部做切口,游离颈段食管,放置吻合器钉砧,切断食管并用丝线相连;腹部观察孔位于脐上1 cm偏左侧,主操作孔位于右锁骨中线肋缘下与两孔中点处,副操作孔位于剑突下方、左侧主操作孔相对应的位置(图1)。首先沿胃小弯侧游离,清扫胃左血管旁淋巴结,再沿大弯侧游离,清扫贲门旁、肝动脉旁、脾门旁淋巴结(图2)。将食管拖至腹腔;上腹部做5 cm小切口,提出胃组织制作管胃,宽度3 cm,然后上提至颈部后行器械吻合。
1.3 观察指标 详细记录两组患者术中、术后相关指标,包括术中出血量、每日胸引管引流量与总量、术后镇痛药物的使用频率、术后住院时间、切除淋巴结情况、术后并发症等。术后随访,对比两组肿瘤复发率、无肿瘤生存率及总生存率。
1.4 统计学处理 采用SPSS 13.0软件进行数据分析,定量资料以均数±标准差表示,组间比较采用t检验;分类数据采用频率描述,并通过Pearson卡方检验或Fisher精确概率法进行分析。制定Kaplan-Meier生存曲线,使用log-rank统计对生存曲线进行比较。P<0.05为差异有统计学意义。
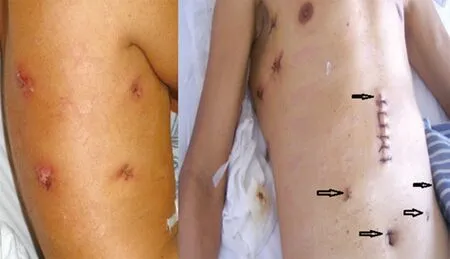
图1 胸部4孔与腹部5孔+小切口
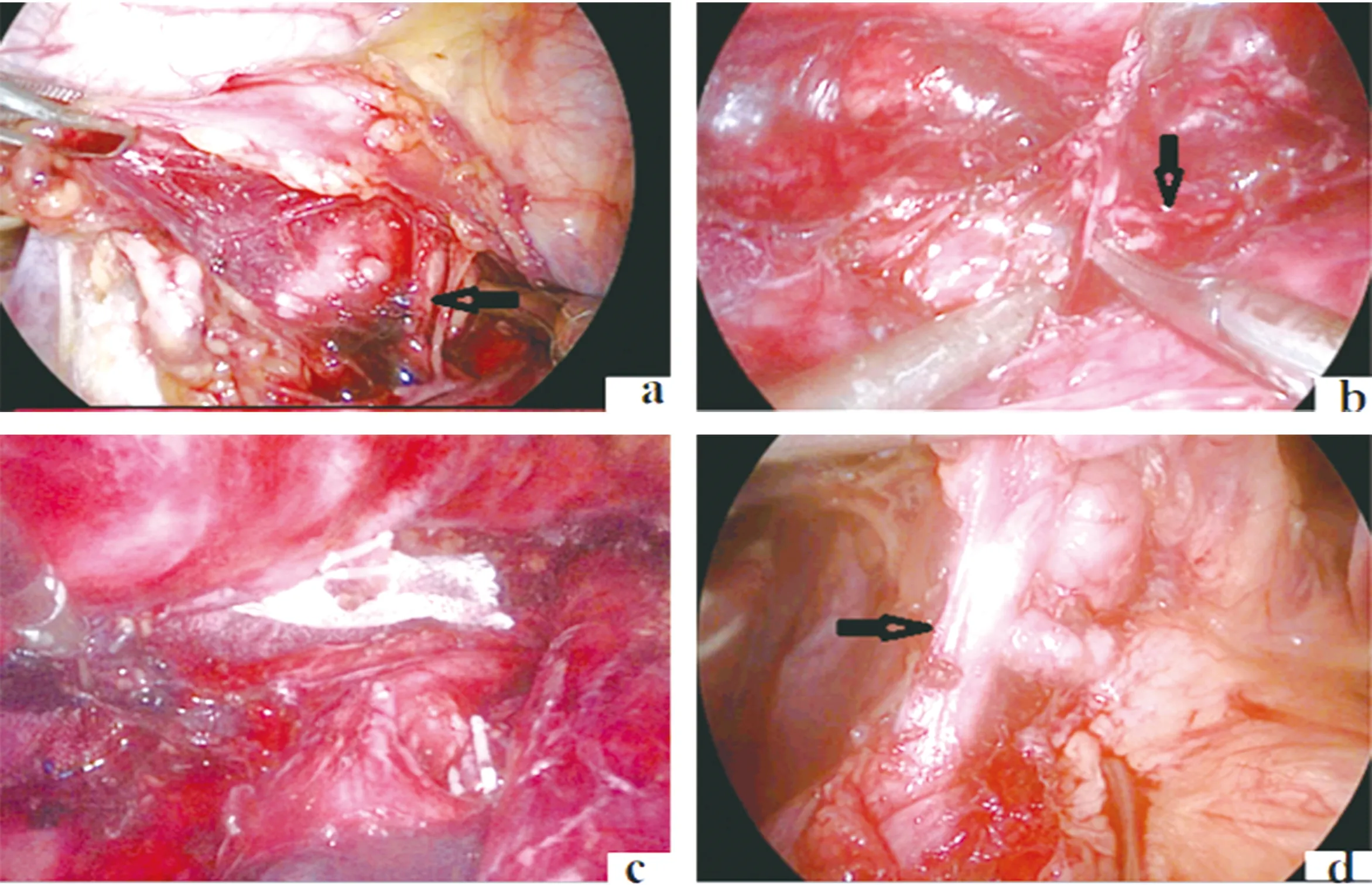
图2 a:右侧喉返神经(箭头处)旁淋巴结;b:左侧喉返神经(箭头处)旁淋巴结;c:隆突下淋巴结;d:胃左动脉(箭头处)旁淋巴结
2 结 果
微创组围术期无死亡病例,1例因中转开胸剔除,中转率为2.22%(1/45)。开胸组中,1例于术后第20天因呼吸衰竭死亡,死亡率为1.89%。微创组术中失血量、术后镇痛管理、胸引管留置时间、术后住院时间优于开胸组(P<0.05);两组手术时间、淋巴结清扫数量与站数、预后差异无统计学意义(P>0.05)。微创组中1例患者出现吻合口漏,经积极治疗后治愈;1例发生喉返神经损伤;并发症发生率为4.55%。开胸组发生2例吻合口漏、1例喉返神经损伤、7例肺部感染,并发症发生率为18.9%。微创组术后并发症发生率(4.55% vs.18.9%)低于开胸组(P<0.05)。见表2。
术后均对两组患者进行随访。微创组随访1~34个月,随访率为88.6%(39/44),2例患者分别于术后第10个月、第11个月出现纵隔淋巴结转移,3例患者分别在术后第14个月、第19个月、第22个月出现远处转移;第11个月、24个月的无瘤生存率分别为95%与78.8%;随访期间4例患者死亡。开胸组随访1~42个月,随访率86.5%(45/52),6例患者分别在术后第8、10、17、25、34、37个月出现纵隔淋巴结转移;7例患者分别在术后第12、16、21、24、28、41个月出现远处转移;第11、24个月无瘤生存率分别为95.5%与80.8%;随访期间7例患者死亡。两组预后指标差异无统计学意义(图3,log-rank test,χ2=0.007,P=0.936)。
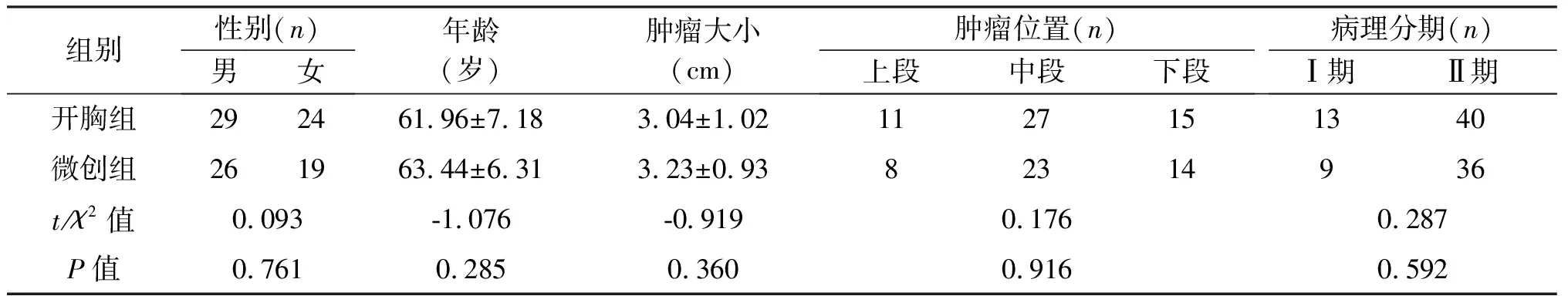
组别性别(n)男女年龄(岁)肿瘤大小(cm)肿瘤位置(n)上段中段下段病理分期(n)Ⅰ期Ⅱ期开胸组292461.96±7.183.04±1.021127151340微创组261963.44±6.313.23±0.9382314936t/χ2值0.093-1.076-0.9190.1760.287P值0.7610.2850.3600.9160.592
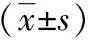
组别淋巴结站数(n)淋巴结数量(n)术后引流量(mL)第1天第2天第3天总量开胸组7.16±1.1317.6±4.85402.27±168.23258.21±114.04188.84±108.531 645.86±543.21微创组7.22±0.8719.3±4.55331.79±134.61222.61±105.48135.85±82.711 179.54±603.17t/χ2值0.2901.7895.0343.2233.2576.186P值0.7770.077<0.00010.0020.002<0.0001
续表2
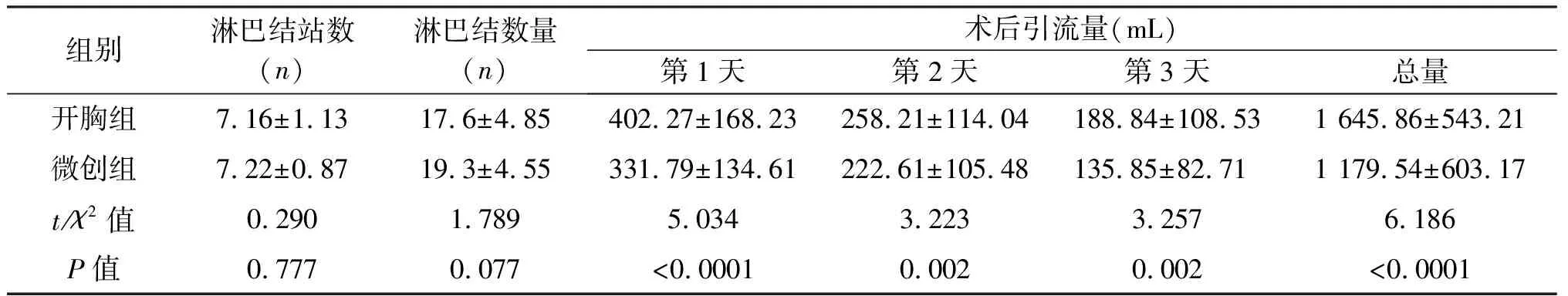
组别手术时间(min)出血量(mL)带管时间(d)镇痛药物频率(次/人)术后住院时间(d)并发症(n)开胸组287.17±24.61154.73±26.855.1±2.33.38±3.1914.46±4.3410微创组279.23±39.45110.58±31.424.2±1.81.20±1.0710.20±3.912t/χ2值1.2146.8415.0696.2147.2414.712P值0.228<0.0001<0.0001<0.0001<0.00010.030
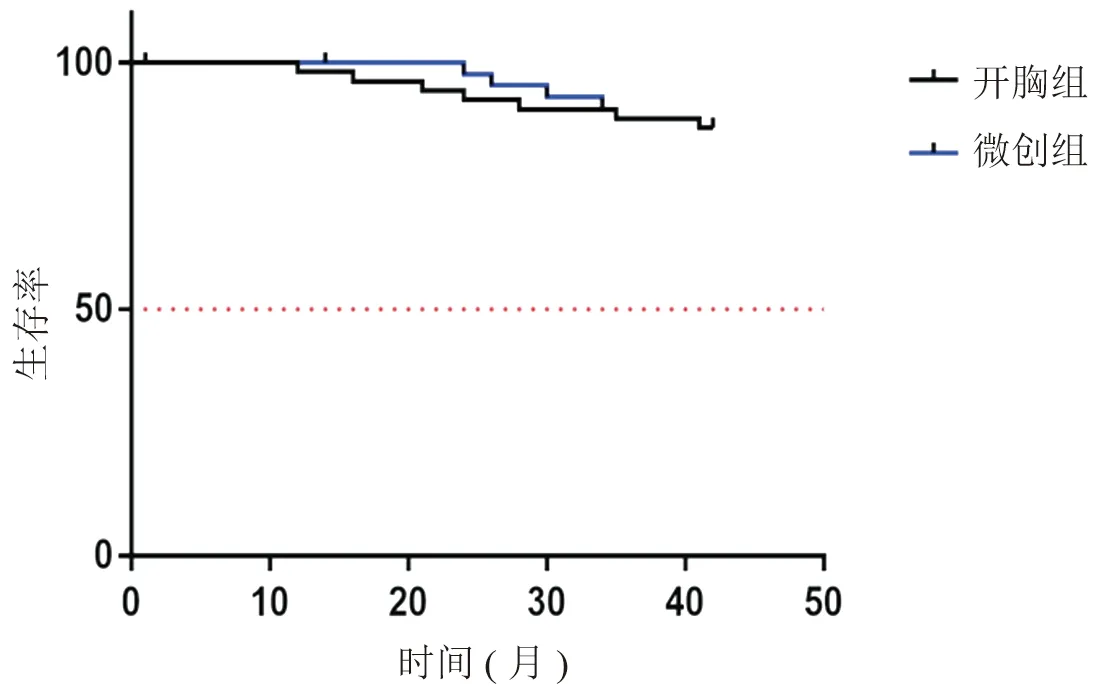
图3 两组患者生存率对比分析
3 讨 论
食管癌目前是国内较常见的消化道恶性肿瘤之一,5年生存率仅17%[9]。手术是首选治疗方法,包括肿瘤切除、淋巴结清扫及消化道重建。传统开胸手术创伤较大,术后死亡率也较高。为减少手术创伤及术后并发症,胸、腹腔镜联合切除术为代表的微创手术是目前较好的选择,手术方式包括胸腔镜游离食管、腹腔镜游离胃并于颈部吻合[10],其优势在于患者康复快、术后并发症发生率与死亡率低[11]。目前,此术式由于操作复杂,仅局限于地市级医院开展,而且还存有一定争议[12-14]。但近年食管微创技术发展较快,越来越被胸外科医生所接受。
食管癌的腔镜手术对手术器械、胸腔镜设备要求较高,因此开展初期,手术时间较长、出血较多是在所难免的,只有跨过学习曲线达到一定的熟练程度才能体现出微创的优越性。本研究中手术组医师均能熟练地进行镜下操作,并形成了自己的手术模式。首先是手术的模块化,胸部操作时我们遵循清扫右喉返神经旁淋巴结-断奇静脉-游离食管-清扫隆突下淋巴结-清扫左侧喉返神经旁淋巴结的模式,腹部遵循游离胃左血管-建立“隧道”-游离大网膜-游离贲门的模式。其次是电钩、超声刀的使用,在喉返神经、气管膜部附近必须注意避免能量损伤。开展初期,我们多次出现喉返神经损伤、膜部瘘的问题,延长了患者的住院时间。再者,腹部操作能真正反映团队的配合,视野的暴露尤为重要,最上方的几支胃短血管游离较困难,根据我们的经验,由胃小弯侧向脾脏方向游离建立“隧道”较有效,但必须紧贴大弯侧缘,否则会游离至脾门处导致不必要的损伤。
我们还发现,虽然两组手术时间、淋巴结清扫情况及预后差异无统计学意义,但微创手术具有明显优势,如术后并发症少、带管时间短等。微创手术能保证胸壁、膈肌的完整性,减少肺组织的物理性损伤,最大限度地保护肺功能,大部分患者术后能主动咳嗽咳痰,大大减少了肺部并发症的发生。小切口避免了肋骨撑开,术后胸痛情况明显减轻,提高了患者的术后生活质量[15]。微创组引流量少、带管时间短,得益于镜下的精细操作,胸腔镜的放大效应可清楚地显示细小血管、神经及淋巴结,做到精细解剖,神经完全可脉络化,且止血彻底,术后渗出也明显减少,这在开放手术中是很难做到的。术后镇痛药物的使用频率明显低于传统开胸组,患者多于术后第2天下床活动,恢复速度快于传统开胸患者[16]。
肠内营养已在临床上广泛应用。术后第一天我们即为患者开始肠内营养支持,营养液可根据患者的经济情况选择营养制剂或普通食物。营养制剂因高渗性特点,可导致患者出现腹泻等不适症状,提前应用缓泻剂可明显减轻腹泻程度。微创组患者创伤小,并发症少,康复快,优势明显;但也引发了新的并发症,如胃瘘、残胃支气管瘘等,这是传统手术中很少见的,因此相应的应对措施很有必要。首先是引流通畅,纵隔引流非常重要。纵隔引流管可缩短渗出物在胸腔内的行走距离,及时引出因瘘产生的消化液,从而减少对支气管膜部的侵蚀;发现颈部切口皮下气肿或引流混浊时应及时敞开,以减少脓性分泌物的积存。由于管状胃的制作,胃液分泌大大减少,因此即使出现瘘,患者也少有全身中毒症状,甚至有出院后才发现瘘的情况。因此患者进食前应行上消化道造影检查,及时发现小的瘘口,适当延长进食时间。
本研究中我们发现,胸、腹腔镜联合食管癌切除术具有以下优点:(1)解剖结构清晰,食管、胃及周围组织结构显露清晰,术中可直接看到奇静脉、胃左动脉、支气管动脉等,做到完全裸化切断。(2)创伤小,康复快,减少胸腹部的切换时间,术中使用超声刀,一定程度上减少了失血[17]。(3)胸壁、腹壁无牵拉,可减少术后疼痛及对肺功能的影响。当然,目前尚存有争议,如胃管的作用、胸引管是否保留等,尤其是在目前要求快速康复的前提下,循证医学与传统经验医学发生了碰撞,这需要多中心、大宗病例的进一步临床研究。
综上所述,微创手术治疗食管癌具有明显优势,值得临床推广应用。

