腹腔镜射频消融术与腹腔镜肝切除术治疗小肝癌的疗效对比研究
周善学,陈云杰,尹小斌,应福明,冯雪峰
(1.宁波大学医学院附属医院,浙江 宁波,315020;2.宁波市第二医院)
我国肝细胞癌发病率居恶性肿瘤第4位[1],死亡率居第3位[2]。肝癌外科手术要求完整切除肿瘤,同时最大限度地保留正常肝组织。同样射频消融要求完整消融肿瘤组织,同时消融肿瘤周围0.5~1 cm的正常组织,这种类似于手术切除的原则能提高消融率、减少局部复发[3]。腹腔镜手术具有局部创伤小、全身反应轻、术后康复快等优势,符合精准外科、微创外科的趋势。随着设备的更新、技术的进步,小肝癌行腹腔镜切除或射频消融的优势逐渐被肯定,手术量逐年上升。本研究选择2011年1月至2015年5月宁波大学医学院附属医院与宁波市第二医院收治的87例小肝癌患者,对比分析腹腔镜射频消融术与腹腔镜手术的治疗效果,现将结果报道如下。
1 资料与方法
1.1 临床资料 纳入标准(参考2017年版原发性肝癌诊疗规范制定的原发性肝癌射频消融适应证):首次确诊的原发性肝癌;单发肿瘤直径≤5 cm;或肿瘤数量不超过3个、最大肿瘤直径≤3 cm;无血管、胆管、邻近器官侵犯及远处转移。根据治疗方法分为两组,射频组(n=42)行腹腔镜射频消融术,其中男33例,女9例;41~84岁;肿瘤单发31例,多发11例,其中10例为2枚病灶,1例为3枚病灶,共54枚瘤体;隆起于肝被膜14枚,靠近肝门部3枚,靠近膈肌16枚,靠近胆囊床9枚,靠近胃肠或心包12枚。切除组(n=45)行腹腔镜肝癌切除术,其中男35例,女10例,42~80岁;肿瘤单发35例,多发10例,均为2枚病灶,共55枚瘤体;单发肿瘤9例位于左肝外叶(Ⅱ、Ⅲ段),13例位于左肝内叶(Ⅳ段),5例位于右肝前叶下段(Ⅴ段),8例位于右肝后叶下段(Ⅵ段);多发肿瘤7例均位于左半肝,1例均位于Ⅴ段,2例均位于Ⅵ段。两组患者性别、肿瘤数量、肝功能Child-Pugh分级、年龄差异无统计学意义(P>0.05),见表1。
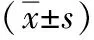

组别性别(n)男女年龄(岁)肝功能分级(n)AB 肿瘤数量(n)单发多发射频组33958.3±10.727153111切除组351059.5±10.431143510t/χ2值0.008-0.5300.2070.187P值0.9290.5980.6490.666
1.2 手术方法
1.2.1 切除组 行腹腔镜肝癌切除术,患者取平卧位,采用气管插管全麻,选择脐周切口建立气腹。置入腹腔镜探查,上腹部合适部位建立3~4个操作孔(图1)。游离肝脏、肝十二指肠韧带并留置阻断带,根据术中出血情况决定是否阻断第一肝门。根据位置、肝硬化程度行解剖性肝叶、肝段或局部肿瘤切除术,放置腹腔引流管(图2)。其中左外叶切除9例,左半肝切除11例,Ⅴ段切除1例,Ⅵ段切除2例,局部切除22例(左肝9例、右肝13例)。
1.2.2 消融组 采用腹腔镜射频消融术,患者取平卧位,采用气管插管全麻,自脐周切口建立气腹。腹腔镜B超探查全肝,并定位肿瘤(图3、图4)。使用操作器械将肿瘤与邻近脏器隔离。连接美国RITA射频消融设备,温度设定为105℃,功率250 W。B超监控下射频消融针尖经过肿瘤中心置入肿瘤远端,逐步推进内套针,展开顶端伞状分布的细针并包绕肿瘤。消融范围需根据肿瘤大小设定,3 cm以内肿瘤,需包含肿瘤及周围1~2 cm正常组织,3~5 cm肿瘤需多点叠加消融或交叉消融(图5)。通电达靶温度后开始消融,消融结束后智能评估温度达70℃。B超观察凝固坏死范围,覆盖并超过肿瘤范围后收针(图6)。边退针边针道消融,直至退出皮肤。
1.3 观察指标 记录两组术后至出院前并发症情况,包括高热、胆道损伤、出血、腹腔感染等;记录两组术前与术后5 d ALT及AST,记录两组术前、术后2个月甲胎蛋白(alpha fetal protein,AFP);随访术后1年、3年无瘤生存率及总生存率。局部复发:消融区或切除区周围肝组织内有新发病灶。肝内转移:肝内其他部位存在新发病灶。远处转移:肝外新病灶。无瘤生存以影像学检查发现上述复发或转移病灶为事件终点,肿瘤残留再次消融不作为事件终点。以患者死亡为总生存率事件终点。
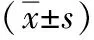

图1 腹腔镜探查全肝并定位Ⅳ段肿瘤 图2 Ⅳ段肿瘤局部切除后检查创面

图3 腹腔镜B超探查肝脏 图4 腹腔镜B超定位肿瘤并测量直径

图5 射频消融针消融肿瘤 图6 消融结束B超评估消融效果
2 结 果
2.1 两组手术并发症情况的比较 患者均顺利完成手术,无一例中转开腹。射频组术后住院时间短于切除组,两组差异有统计学意义(P<0.05),术后并发症发生率(14.3%)低于切除组(37.8%),两组差异有统计学意义(P<0.05),见表2。射频组6例出现术后并发症,其中3例术后1个月复查增强CT发现,肿瘤边缘消融不彻底,经皮B超定位再次射频消融。高热1例,腹腔感染1例,肝脓肿1例,均予以抗生素治疗后好转。切除组17例出现术后并发症,其中高热8例,腹腔感染5例,肝脓肿1例,予以更换抗生素后,11例好转,3例腹腔感染患者出现腹腔包裹性积液,行B超定位腹腔穿刺置管引流术。1例术后第1天出现腹腔大出血,急诊再次腹腔镜探查,行肝断面血管结扎止血。胆道损伤2例,均为肝断面小胆管胆汁渗漏,因术中放置引流管,引流通畅,延长置管时间。患者均顺利出院。
2.2 两组肝功能的比较 两组术前血清ALT与AST水平差异无统计学意义(P>0.05),射频组术后5 d血清ALT、AST水平低于切除组,差异有统计学意义(P<0.05)。提示腹腔镜射频消融术对肝功能的损害更小。见表3。
2.3 两组AFP的比较 射频组术前AFP升高27例,切除组升高33例,术后2个月复查,AFP浓度均降至正常水平。两组同期相比差异无统计学意义(P>0.05)。见表4。
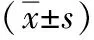

组别术后住院时间(d)并发症[n(%)]高热(>39.0℃)胆道损伤腹腔出血腹腔感染肿瘤残留肝脓肿总发生率射频组6.7±1.11(2.4)001(2.4)3(7.1)1(2.4)6(14.3)切除组8.2±1.28(17.8)2(4.4)1(2.2)5(11.1)01(2.2)17(37.8)t/χ2值-6.146.165P值<0.0010.013


组别ALT术前术后第5天AST术前术后第5天射频组52.5±18.056.7±15.853.6±22.957.1±17.2切除组48.5±17.4100.0±38.248.2±18.7105.0±41.5t值1.046-6.9721.217-7.1P值0.298<0.0010.227<0.001


组别术前术后2个月射频组484.2±195.117.6±8.0切除组561.2±211.515.8±7.7t值-1.4510.904P值0.1520.37
2.4 两组无瘤生存率与总生存率的比较 两组治疗后随访发现,射频组1年、3年无瘤生存率分别为76.19%与41.90%,1年、3年总生存率分别95.23%与59.01%。切除组1年、3年无瘤生存率分别为77.78%与45.47%,1年、3年总生存率分别为93.33%与61.11%;两组相比差异均无统计学意义(P>0.05),见表5。两组患者无瘤生存率与总生存率曲线图见图7、图8。
表5 两组患者术后1年、3年无瘤生存率、总生存率的比较(%)

组别无瘤生存率1年3年总生存率1年3年射频组76.1941.9095.2359.01切除组77.7845.4793.3361.11χ2值0.0810.1730.1220.107P值0.7750.6670.7270.744

图7 两组患者无瘤生存率曲线图 图8 两组患者总生存率曲线图
3 讨 论
近年,随着射频消融技术的蓬勃发展,射频消融治疗小肝癌的地位明显提高,被认为是小肝癌的根治性治疗手段之一[4]。射频消融的优势在于能原位治疗肿瘤,使组织凝固性坏死;消融范围精确,对正常肝组织影响小,可反复应用;无肝脏切除创面,出血少;同时能激活机体细胞免疫与体液免疫[5-6];尤其适合高龄、基础疾病多、肝硬化明显、瘤体位置不理想等失去手术切除机会的患者。
我们利用腹腔镜手术的优势,针对特殊部位肝癌采用不同辅助消融技巧,如邻近膈肌、心包、胃肠等部位的肿瘤,腹腔镜下游离肝周韧带与组织,通过牵拉、按压、抬举肝脏或周围组织等方法防止消融时损伤邻近脏器;胆囊床附近的肝癌,3例行胆囊切除,6例游离部分胆囊床后再选择消融,避免了胆囊穿孔;位于肝表面的肿瘤,通过腹腔镜直视下选择进针点,同时观察肿瘤的消融效果。结果显示,腹腔镜射频消融组术后住院时间、ALT、AST及并发症发生率均低于腹腔镜手术切除组;两组术前AFP明显升高患者,术后2个月均降至正常。表明腹腔镜射频消融术具有独特优势,既弥补了经皮肝穿刺射频消融治疗特殊部位肝癌的不足,又避免了因肝脏切除对机体的创伤,降低术后胆漏、出血、感染、肝衰等严重并发症的发生风险[7]。
然而射频消融与手术切除孰优孰劣至今仍是热门话题。许多专家认为,虽然射频消融较手术切除更安全,但肿瘤复发率、局部病灶进展率却高于手术切除[8],外科根治性手术切除仍是肝癌的首选治疗方案[9]。这些报道主要集中在经皮射频消融与开腹手术切除治疗小肝癌的疗效对比[10-11]。Machi等[12]认为,多种因素可影响肝癌射频消融的疗效,如:(1)肿瘤较大,有效的射频杀伤范围难以完全覆盖肿瘤;(2)定位不准确,遗留肿瘤边缘区,达不到消融范围超过肿瘤边缘0.5~1 cm的要求;(3)肿瘤靠近主要大血管,血流降温作用使射频疗效降低;(4)肿瘤已侵犯大血管或癌栓已达肿瘤外区域的血管。
目前国际上公认的最适合射频消融的肝脏肿瘤大小为:(1)单个直径≤3.0 cm;(2)数量≤3个,最大直径≤3.0 cm[13]。于涛等[14]为102枚直径≤3 cm的肝癌病灶行腹腔镜联合经皮B超射频消融,术后1个月复查,仅6枚肿瘤残留,效果满意。王建国等[15]对比分析了经皮射频消融及手术治疗直径<3 cm的原发性小肝癌,射频组治疗后1、2、3年总生存率分别为95.56%、86.67%、60.00%,与手术组的93.88%、79.60%、59.20%相比,差异均无统计学意义;两组患者1、2、3年肿瘤复发率差异亦无统计学意义。
关于射频消融治疗直径<3 cm与3~5 cm的原发性肝癌患者的总生存率与无瘤生存率意见并不一致,Bu等[16]认为,两组差异无统计学意义(P>0.05)。而部分学者指出,射频消融的治疗效果受肝脏恶性肿瘤体积的影响十分明显,随着肿瘤的增大,射频消融完整消融率亦随之降低。射频消融可能仅对瘤体直径<3 cm的病灶效果良好,对于直径>3 cm的病灶无法保证完全坏死[17]。王鹤等[18]发现,射频消融治疗原发性小肝癌患者,病灶残留率、5年复发率略高于手术患者,而5年生存率低于手术患者,原因可能与部分肿瘤直径超过3 cm有关。本研究中,手术组术后随访无一例肿瘤残留。而消融组术后1个月复查,3例有肿瘤残留,均为肿瘤直径超过3 cm的患者,考虑与瘤体较大且形态不规则、消融范围未完全覆盖瘤体有关。提示肿瘤超过3 cm可能降低完整消融率,但经过再次消融仍能达到无肿瘤残留。两组患者1年、3年生存率及无瘤生存率差异均无统计学意义。我们认为,针对直径超过3 cm的肿瘤,以下方法有助于提高消融效果:如B超发现滋养动脉,先消融滋养动脉,再消融整个肿瘤;需重叠消融时,采取先深部后表浅、先外周后中心的原则。
笔者认为,通过腹腔镜B超精准定位并实时引导消融针穿刺路径,较大肿瘤使用伞状扩展的多极套针多点消融或交叉消融以保证足够的消融边界等方法,腹腔镜射频消融治疗直径5 cm以内小肝癌的无瘤生存率与总体生存率能达到与腹腔镜手术相近的水平,并具有创伤小、肝功能损害轻、并发症少、康复快等优点。而腹腔镜手术需解剖肝内或肝外血管、胆管,手术难度及并发症相对增多,取出标本需扩大手术切口。两种微创方法相比,腹腔镜射频消融治疗小肝癌更具优势。

