云南省医疗器械严重不良事件报告质量评估与影响因素
李雪燕,杜娟
云南省食品药品监督管理局药品评价中心 (云南昆明 650000)
医疗器械不良事件监测是对医疗器械上市后安全性的监测和评价,是国际通行的对医疗器械安全性监管的重要手段[1]。近年来,我国医疗器械不良事件监测报告数量持续增长,2017 年已突破37万份,同时报告整体质量不断提升。不良事件报告的质量是进行风险分析评价的基础,只有获得高质量的、有价值的信息并进行科学的处理分析,才能判断可疑医疗器械与不良事件的因果关系,从而有效提取医疗器械安全风险信号并及时采取适当的措施[2]。现通过对2017年云南省食品药品监督管理局药品评价中心(以下简称“省中心”)收到的869份医疗器械严重不良事件报告质量进行评估,结合基层报告单位工作现状,提出影响报告质量的主要因素,为医疗器械不良事件监测机构提高报告质量、及时发现器械风险提供参考。
1 资料与方法
1.1 资料
收集2017年云南省食品药品监督管理局药品评价中心收到的869份医疗器械严重不良事件报告表。
1.2 临床评价
按照国家药品不良反应监测中心《(可疑医疗器械不良事件报告表)质量评估计分标准》对报告的真实性、时效性、完整性和准确性(包括报告时限、报告来源、患者信息、不良事件情况、器械信息、评估处理情况6类)进行评分,总分为100分[3]。其中内容描述等级分为准确完整、较准确完整、错误/空缺,3个等级对应不同的评分系数1、0.5、0。报告质量等级根据总分分为优(90~100分)、良(75~89分)、合格(60~74分)、不合格(60分以下)[4]。如发现虚假报告一律评价为0分,剔除重复报告。
1.3 统计学处理
使用Excel建立数据库对869份报告逐一进行评分,经双人录入比较后,使用SPSS 11.5统计软件分析,分值使用描述性分析统计量(均值、标准差、最大值、最小值、中位数)表述。
2 报告质量评估结果
2.1 总体评估情况
869份严重不良事件报告中无虚假、重复报告,总分53~100分,平均(90.74±8.15)分。其中报告质量等级为优572份(65.82%),质量等级为良256份(29.46%),质量等级为合格35份(4.03%),质量等级为不合格6份(0.69%)。
2.2 各项目评估情况
2.2.1 报告时限
分值为5分,平均(3.83±2.12)分,有203份(23.36%)未在报告时限内上报。见表1。
2.2.2 报告来源
包括报告人/报告单位、报告人类别、联系电话、报告日期4项,分值为4分,有745份(85.73%)报告全部填写完整。见表1。
2.2.3 患者信息
包括患者姓名、年龄、性别、预期治疗疾病或作用4项,分值为7分,有779份(89.64%)报告全部填写完整。见表1。
2.2.4 不良事件情况
包括12项,总分值为46分,平均(42.44±4.11)分,有277份(31.88%)器械故障未填写;59份(6.79%)主要伤害未填写;11份(1.27%)发生日期未填写;14份(1.61%)发现或知悉日期未填写;56份(6.44%)使用场所未填写。其中事件陈述包括不良事件情况、器械使用时间、对受害人员的影响、采取治疗措施、器械联合使用情况5项,总分值为22分,平均(20.90±2.46)分,有228份(26.24%)报告未能完整准确填写。见表1。
2.2.5 器械信息
包括9项,总分值为32分,平均(29.49±3.75)分,有437份(50.29%)报告填写不完整。见表1。
2.2.6 评价处理
包括事件原因分析和事件处理措施2项,总分值为6分,平均(4.50±1.61)分,有153份(17.61%)报告未填写事件原因分析,有12份(1.38%)未填写事件处理措施。见表1。
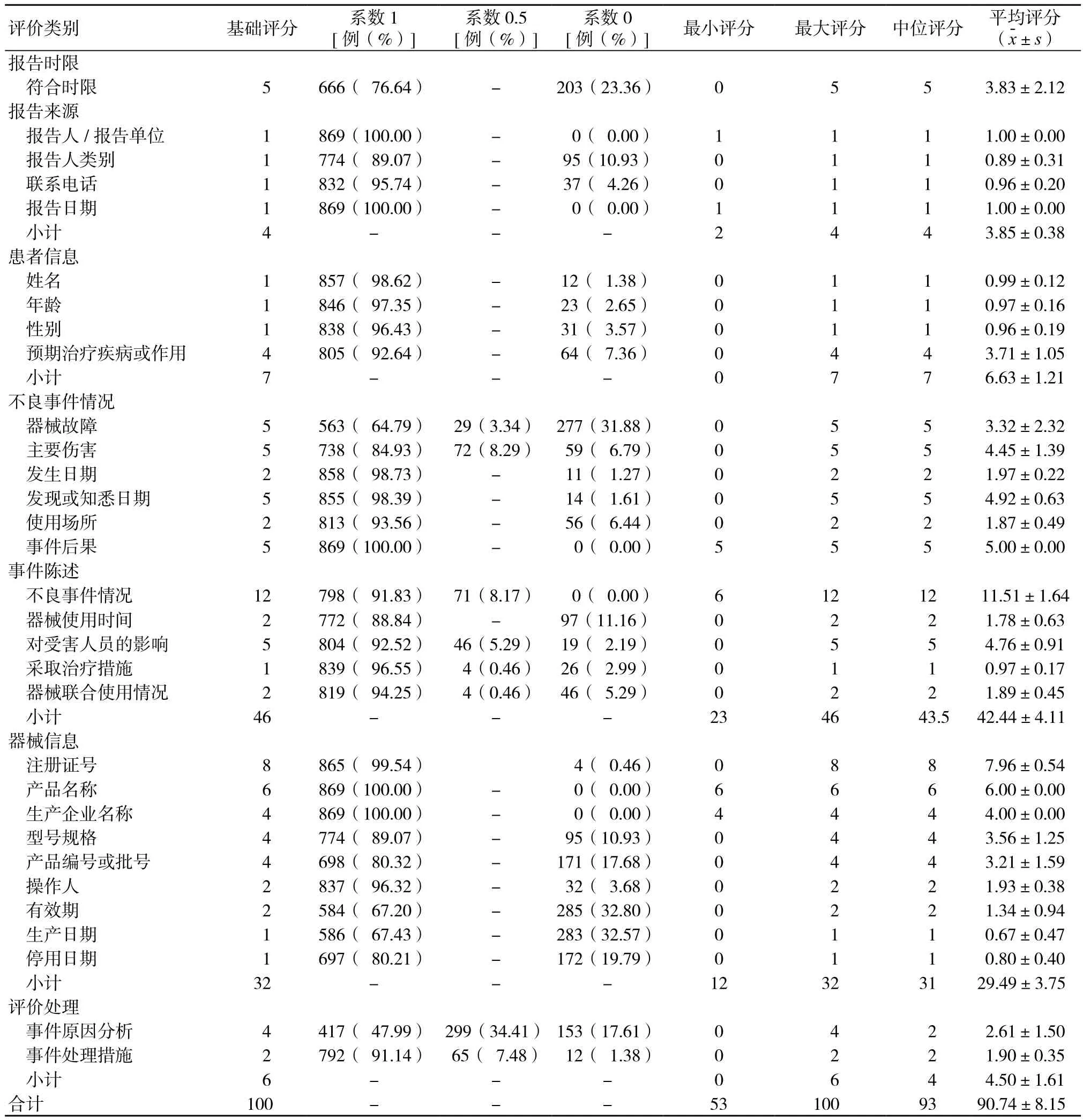
表1 各项目评估情况
3 影响报告质量的主要因素
报告单位内监测员的职业素养和工作任务量的多少会影响报告的真实性和及时性。在869份严重不良事件报告表中未发现有重复或虚假的报告表,但有23.36%的报告表未在报告时限内上报,主要原因是大部分报告单位仅有一名监测员,而且身兼数职,工作任务繁重,影响了报告上报的时效性。
报告单位内监测员的业务水平参差不齐,影响报告表填写的完整性与准确性。我国医疗器械不良事件的报告原则为“可疑即报”,即所报告的事件可以是与使用的医疗器械有关的事件,也可以是不能除外与医疗器械无关的事件。基层报告单位监测员业务水平参差不齐,接受医疗器械不良事件监测业务培训程度不一,且人员更换频繁,加之报告单位内不良反应/事件领导小组的构建情况、重视程度以及病例信息的公开程度等,极大影响了报告表的填写质量。
医疗器械不良事件报告质量情况,也反映了监测机构的工作水平和能力[5]。各级医疗器械不良事件监测机构在履行监测技术职能、分析评价医疗器械不良事件时,必须采取有效措施,对收集报告表的真实性、完整性和准确性进行评判,并制定相应措施加以控制。近年来由于机构改革,基层监测机构人员变动频繁,监测人员数量严重不足,对报告单位的培训指导不够,影响了报告表的填写质量。
4 讨论与建议
高质量的报告是开展安全性监测与评价的基础,是及时发现风险、进行风险评估,从而形成科学结论、进行风险控制的重要依据[5]。评估发现,省中心收集到的医疗器械严重不良事件整体质量较好,无虚假、重复报告,质量等级以优和良为主。评估中失分较多的项目主要包括“有效期”“生产日期”“器械故障”“符合时限”“停用日期”等,说明这些信息是报告人员在填写时普遍存在的容易忽视的问题。通过本次评估,省中心初步了解了医疗器械严重不良事件报告的质量状况,发现了报告质量中常见的一些问题,也对影响报告质量的相关因素进行了探讨。为进一步提高报告质量,提出以下建议。
第一,监测机构需继续加大对基层报告单位的培训指导力度,全面提升监测人员的综合业务能力;加强沟通协调,促使相关单位领导充分认识药械安全性监测工作的重要性和必要性,保证监测人员的稳定性;逐步完善科学、合理、操作性强的报告质量评估制度,优化报告来源,提高严重报告比例,充分发挥医疗器械不良事件监测的科学预警作用[6]。
第二,监测机构开展报告质量评估工作时尽可能让下级监测中心和相关使用单位监测员参与,这既能使评估工作客观准确,又能达到培训基层监测员的目的;同时应做好痕迹管理工作,切实做到病例报告评估工作有案可查,将评估工作的所有材料进行整理、汇总后,存入《医疗器械不良事件病例报告质量评估》档案库进行管理[7]。
第三,监测机构对辖区内上报的可能存在较大风险的报告应及时进行现场核查,这不仅能使监测员了解所涉及医疗器械的相关情况,对报告表进行相应的补充,又能发现一些潜在的风险(如产品说明书、使用培训、有效使用期限以及维护保养等方面存在的问题),进一步提高报告的利用价值[8-9]。

