青蒿琥酯通过诱导抗氧化酶活性抑制PC12细胞氧化损伤
沈先敏,刘 恒
(襄阳市中心医院药学部,湖北文理学院附属医院,襄阳 441021)
随着全球人口老龄化的加重,帕金森病、阿尔茨海默症等神经退行性疾病的发生风险升高。研究认为,线粒体功能障碍[1]、细胞凋亡[2]、内质网应激[3]、氧化损伤[4-5]均介导了神经退行性疾病的发生发展,然而,其中氧化应激在该类疾病发生中关系最为密切。活性氧(ROS)为引起细胞内氧化损伤的主要因素之一,包含超氧离子、羟自由基等[6]。ROS可通过氧化损伤脱氧核糖核酸(DNA)、膜脂及蛋白质多种生物分子,引起细胞功能异常;而过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)等抗氧化酶可以清除氧自由基,起到保护细胞氧化损伤的作用[7-8]。青蒿琥酯与青蒿素一样对疟疾的治疗效果较显著,而且还具有抗炎、免疫调节及抗氧化应激的作用[9]。因此,本研究利用过氧化氢(H2O2)诱导神经元细胞系PC12细胞氧化损伤模型,检测青蒿琥酯对PC12细胞的保护作用并初步分析其作用机制。
1 材料及方法
1.1 肾上腺嗜铬细胞瘤 PC12细胞由上海名劲生物科技有限公司提供(来源于美国ATCC细胞库)。
1.2 试剂及仪器 青蒿琥酯(百灵威科技有限公司,批号:88495-63-0,≥98%),达尔伯克改良伊格尔(DMEM)培养基及胎牛血清均购自美国Gibco公司,胰蛋白酶购自美国Thermo scientific公司(批号:R001100),CCK8试剂盒购自北京智杰方远科技有限公司(批号:CK04),H2O2溶液(分析纯)购自北京斯百汇生物科技有限责任公司,乳酸脱氢酶(LDH)、SOD、丙二醛(MDA)、CAT、GSH-PX 测定试剂盒均购自南京建成生物有限公司,2,7-二氯荧光素二乙酸酯(DCFH-DA)购自英国Abcam公司。BIORAD-550型酶标仪(美国伯乐公司),BBS-V800型单人超净台(山东鑫贝西公司),SPX-250型细胞培养箱(美国Thermo公司),IN Cell Analyzer 2000高内涵活细胞成像系统购自美国TFS公司。
1.3 PC12细胞培养 采用完全DMEM培养基培养,培养箱条件为37℃、5%CO2浓度,待细胞长满至95%左右时用磷酸缓冲盐溶液(PBS)清洗后加入胰酶消化,显微镜下观察待细胞变圆后加入培养基终止消化,分装于3个培养瓶进行传代培养。
1.4 青蒿琥酯对PC12细胞相对存活率的影响 取对数生长期细胞消化、离心、重悬后,以每毫升1×105个的细胞浓度接种于96孔板,每孔加入200 μL的细胞悬液,每组设置5个复孔。培养过夜待细胞贴壁后,每孔加入200 μL青蒿琥酯溶液,使其终浓度分别为 0.1、0.2、0.4、0.8、1.2、1.6 mmol/L,继续培养24 h,吸去旧培养液,每孔加入10 μL CCK8试剂,孵育1 h后采用酶标仪450 nm波长下测定OD值。实验重复3次,细胞相对存活率(%)=(实验组平均OD值/对照组平均OD值)×100%。
1.5 CCK8法检测青蒿琥酯对PC12细胞的保护 按照“1.4”项下接种细胞,细胞培养过夜后用于后续实验。实验分为6组:正常对照组、H2O2(200 μmol/L)诱导组、青蒿琥酯保护组(0.2、0.4、0.8、1.2 mmol/L),首先在保护组中加入相应浓度青蒿琥酯溶液,2 h后再加入H2O2。培养24 h,吸去旧培养液,每孔加入10 μL CCK8试剂,孵育1 h后采用酶标仪450 nm波长下测定OD值。实验重复3次,计算细胞相对存活率。
1.6 LDH法检测青蒿琥酯对PC12细胞的保护 取对数生长期细胞消化、离心、重悬后,以每毫升1×106个的细胞浓度接种于6孔板,每孔加入2 mL的细胞悬液。按照“1.5”项分组处理细胞后,收集各组细胞上清用于LDH含量测定,其操作步骤严格按照说明书进行。
1.7 PC12细胞内ROS及MDA水平检测 按对数生长期细胞以每毫升1×105个浓度接种于经多聚赖氨酸处理过的96孔板中,细胞分为正常对照组、H2O2(200 μmol/L)诱导组、青蒿琥酯保护组(0.2、0.4、0.8、1.2 mmol/L),细胞经上述处理 24 h 后除去旧培养液,用无菌PBS清洗3次,加入1 mg/L的Hoechst33342避光染色30 min后,再加入10 μmol/L的DCFH-DA溶液继续染色30 min。经PBS清洗3次后,采用高内涵活细胞成像系统在激发光为485 nm和发射光为525 nm的条件下检测荧光值。另按“1.6”项培养并处理细胞后,收集细胞超声破碎后按照MDA试剂盒步骤在530 nm波长下测定OD值,并计算含量,实验重复3次。
1.8 PC12细胞中SOD、CAT及GSH-PX活力测定按“1.6”项培养并处理细胞后,收集细胞超声破碎后离心,吸取上清分别在550、240、412 nm波长下测定SOD、CAT及GSH-PX的OD值,并计算活力,实验重复3次。
1.9 统计学方法 采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 不同浓度青蒿琥酯对PC12细胞相对存活率的影响 青蒿琥酯对PC12细胞相对存活率影响结果见图1,提示青蒿琥酯在0.1~1.6 mmol/L浓度范围内对PC12细胞相对存活率没有明显影响,虽然细胞的相对存活率稍有变化,但与对照组相比差异没有统计学意义(P>0.05)。

图1 青蒿琥酯对PC12细胞活力的影响(n=6)Fig.1 Effects of artesunate on the vitality of PC12 cells(n=6)
2.2 CCK8法检测青蒿琥酯对H2O2诱导PC12细胞损伤的保护作用 结果见图2。与对照组相比,H2O2诱导组PC12细胞相对存活率显著降低(P<0.05);而经过不同剂量青蒿琥酯干预后,细胞相对存活率显著升高,与H2O2诱导组相比差异具有统计学意义(P<0.05),并且表现出浓度依赖性。

图2 青蒿琥酯对H2O2诱导PC12细胞相对存活率的影响(n=6)Fig.2 Effects of artesunate on the relative survival rate of PC12 cells induced by H2O2(n=6)
2.3 青蒿琥酯对H2O2诱导PC12细胞上清LDH水平的影响 各组细胞培养液中LDH含量检测结果见图3所示。对照组中LDH水平降低,而H2O2诱导组中LDH水平较高,两组比较差异有统计学意义(P<0.05);经过不同浓度青蒿琥酯干预后,上清中LDH水平随着剂量升高而明显降低,与H2O2诱导组相比差异有统计学意义(P<0.05)。
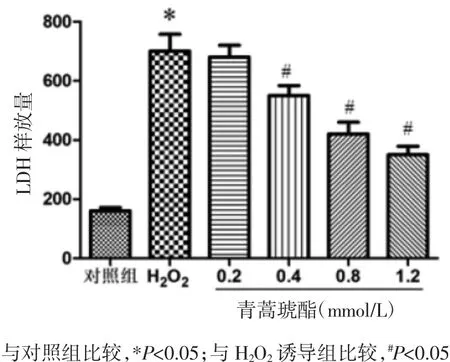
图3 青蒿琥酯对H2O2诱导PC12细胞上清LDH含量的影响(n=6)Fig.3 Effects of artesunate on the levels of LDH in PC12 cells induced by H2O2(n=6)
2.4 青蒿琥酯对H2O2诱导PC12细胞内ROS及MDA水平的影响 H2O2诱导PC12细胞中ROS及MDA水平变化见表1。与对照组比较,H2O2诱导组中ROS的相对荧光强度(RFU)及MDA水平显著升高(P<0.05);与 H2O2诱导组比较,经不同剂量青蒿琥酯干预后,PC12细胞内ROS及MDA水平均随着药物浓度升高而降低(P<0.05)。

表1 不同组间ROS及MDA水平比较(x±s)Tab.1 Comparison of the levels of ROS and MDA in different groups(x±s)
2.5 青蒿琥酯对PC12细胞内SOD、CAT及GSHPX活力的影响 H2O2诱导PC12细胞中SOD、CAT及GSH-PX活力变化见表2。与对照组比较,H2O2诱导组中SOD、CAT及GSH-PX活力降低(P<0.05);与H2O2诱导组比较,经不同剂量青蒿琥酯干预后,细胞内SOD、CAT及GSH-PX活力均随着药物浓度升高而上升(P<0.05)。
3 讨论
早前研究报道青蒿琥酯能够改善蛛网膜下腔出血后模型大鼠早期脑损伤,其作用机制可能与调节内皮细胞紧密连接蛋白Occludin和紧密连接蛋白-1(ZO-1)的表达相关[10],而且青蒿琥酯能促使视网膜下区神经干细胞的增殖,其作用机制与激活PI3K/Akt信号通路有关[11],还发现青蒿琥酯能抑制脂多糖诱导的小神经胶质细胞系(BV-2细胞)炎性反应[12]。相关报道证实青蒿琥酯可明显降低人结肠上皮细胞氧化应激损伤,其作用机制可能与抑制Jak2/Stat3信号通路的激活相关[13],本研究探讨了青蒿琥酯对H2O2诱导PC12细胞氧化损伤的保护作用,初步研究了青蒿琥酯保护PC12细胞免受氧化损伤的效果与机制。
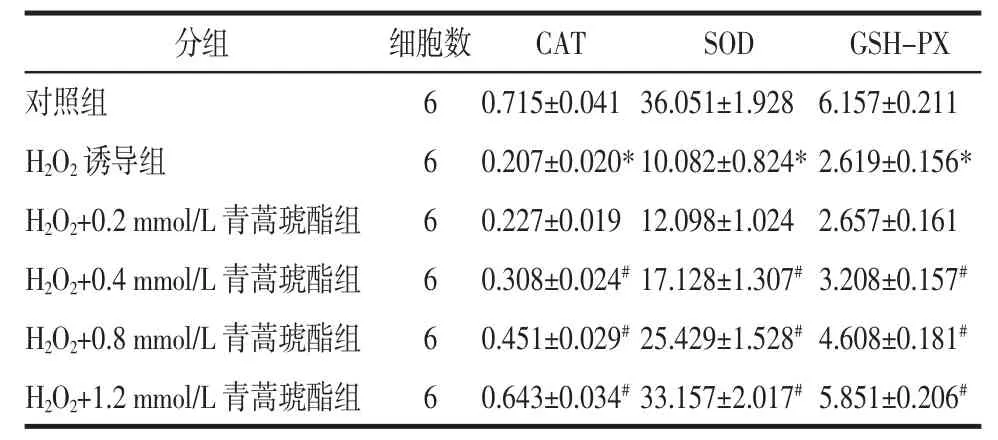
表2 不同组间SOD、CAT及GSH-PX活力的比较(x±s)Tab.2 Comparison of the activity of SOD,CAT and GSHPX in different groups(x±s)kU/g protein
药物毒性实验发现青蒿琥酯在0.1~1.6 mmol/L浓度范围内对PC12细胞的相对存活率没有明显影响,说明所选浓度的药物对PC12细胞的相对存活率没有影响。进一步研究不同浓度青蒿琥酯对PC12细胞免受H2O2损伤的实验,发现该药物能显著增加PC12细胞的相对存活率,并且表现出浓度依赖性。当细胞受到损伤时,胞内LDH会释放到培养液中,LDH水平能够直接反映细胞凋亡的状态。结果发现H2O2诱导组中细胞培养液中LDH含量显著升高,然而经过不同浓度青蒿琥酯干预细胞后LDH含量明显降低,且表现出剂量依赖性。ROS可以使细胞膜上的脂质类物质氧化,产生MDA引发细胞氧化损伤或凋亡,早期报道很多中药成分如生物黄酮类、类胡萝卜素等都有清除氧自由基的作用[14-16]。研究发现H2O2诱导组PC12细胞内ROS的水平明显升高,MDA含量也相应增加,采用不同浓度青蒿琥酯干预后,细胞内ROS、MDA含量均明显降低,提示青蒿琥酯可以减轻H2O2诱导的PC12细胞氧化损伤。SOD、CAT及GSH-PX都是内源性的抗氧化酶,可以直接清除自由基,降低细胞的氧化损伤[17]。实验最后检测了青蒿琥酯对PC12细胞内SOD、CAT及GSH-PX活性的影响,发现H2O2能诱导PC12细胞中抗氧化酶SOD、CAT及GSH-PX活性减弱,而青蒿琥酯则能显著升高SOD、CAT及GSH-PX的活性,从而达到清除细胞内氧自由基、减轻氧化损伤的作用。
胞内氧化/抗氧化系统的平衡在细胞增殖及生理功能中起着关键的作用,一旦平衡被打破便会出现ROS的过量产生,后者会诱导相关信号通路的激活,引发细胞损伤[18]。综上所述,青蒿琥酯对H2O2诱导PC12细胞的保护作用预示着其可能对一些神经病变性疾病有一定疗效,值得后期更深入研究。

