山苍子蛋白碱提工艺优化及其功能性质研究
张 园,仇超颖,汪 勇,何佳静,张 震
(1.暨南大学 食品科学与工程系,广东高校油脂生物炼制工程技术研究中心,广州 510632;2.暨南大学-萨斯喀切温大学 “油料生物炼制与营养”联合实验室,广州 510632;3.清远市瑶康生物科技有限公司,广东 清远 513200)
山苍子(Litseacubeba)又名山鸡椒、山姜子,是樟科(Lauraceae)木姜子属落叶灌木。山苍子在我国分布非常广泛,在广东、广西、湖南等省广泛种植,盛产期高达15 000~22 500 kg/hm2,是一类重要的山区资源。山苍子根、茎、叶和果实均含有芳香油,均可入药,山苍子油中含柠檬醛、柠檬醇、有机酸等[1-2]。同时,山苍子油具有抗菌[3]、抗氧化[4]、驱避昆虫[5]和抗肿瘤[6]等多种生物活性。提取山苍子精油后的核仁中含有40%左右的核仁油,其脂肪酸组成与椰子油相似,可广泛用于制造食品级、化妆品级表面活性剂。将提取精油后的山苍子果渣混在饲料中,能够提高猪瘦肉率,有试验表明,6%的山苍子果渣饼粉对饲料的防霉效果与0.3%的丙酸相当,防霉性能明显优于辣椒粉和桔皮粉,说明山苍子果渣不仅可以直接作为饲料原料,而且还兼有饲料天然防腐剂的功能[7]。山苍子除含极其丰富的油脂外,还含有20%~30%的优质蛋白质。
我国目前对山苍子的研究多偏重于芳香油及核仁油方面,随着山苍子种植及加工业的不断扩大,产生大量山苍子废弃粕,如何对粕中蛋白质利用成为一个亟待解决的问题。目前对山苍子综合利用的研究报道相对较少。碱溶酸沉法是一种经典的蛋白提取方式,尤其在种子、果实等作物的蛋白提取中应用广泛[8]。为了更好地对山苍子资源综合利用,提高其附加值,本文利用碱溶酸沉法对提取精油及核仁油后的山苍子粕中蛋白质进行研究,确定提取工艺参数,并测定山苍子蛋白的起泡性、乳化能力、持水能力等功能性质,以期为山苍子蛋白的深入开发提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
山苍子,由清远市瑶康生物科技有限公司种植基地提供;大豆食用油,市售;大豆分离蛋白,来自麦克林生化科技有限公司。氢氧化钠、盐酸、正己烷等,均为分析纯。
1.1.2 仪器与设备
KDC-1044低速离心机,安徽中科中佳科学仪器有限公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司;SHA-B水浴恒温振荡器,江苏省金坛市宏华仪器厂;可调高速均质器,金坛市晶玻实验仪器厂;722s可见分光光度计,上海菁华科技仪器有限公司;pHS-3C精密pH计,上海精密科学仪器有限公司;SCIENTZ-18N冷冻干燥机,宁波新芝生物科技股份有限公司;自动凯氏定氮仪,湖北正金仪器设备有限公司。
1.2 试验方法
1.2.1 脱脂山苍子粕制备
将山苍子脱除果肉后粉碎过60目筛,用料液比1∶10(质量体积比)的正己烷在功率为20%、室温25℃ 条件下超声浸提5 min,真空抽滤分离,将滤渣放置通风橱充分挥发至无正己烷残留。
1.2.2 常规指标检测
水分测定参照GB 5009.3—2016;粗蛋白质测定参照GB/T 14489.2—2008;粗脂肪测定参照NY/T 4—1982;灰分测定参照GB 5009.4—2016;粗纤维及其他物质含量:100%-(水分含量+粗蛋白质含量+粗脂肪含量+灰分含量)。
1.2.3 山苍子蛋白等电点测定
称取5 g脱脂山苍子粕,在浸提pH 10、浸提温度25℃、料液比1∶10条件下浸提60 min,3 500 r/min 离心20 min得到上清液,之后用1 mol/L HCl调溶液pH至4.0,离心得到沉淀,冷冻干燥得山苍子粗蛋白。相同条件下进行多次提取,合并提取的蛋白。称取1.000 0 g粗蛋白,加入100 mL10 mmol/L 的Na2HPO4-NaH2PO4缓冲液,分别调节pH至3.0、3.5、4.0、4.5、5.0、6.0、7.0、9.0,充分搅拌2 h,离心20 min(3 500 r/min)。取上清液,采用福林酚法在500 nm波长下测定吸光度,以牛血清白蛋白标准曲线计算上清液中蛋白质含量[9]。
1.2.4 山苍子蛋白提取工艺
将脱脂山苍子粕用NaOH溶液在一定温度下浸提一定时间,3 500 r/min离心20 min得到上清液,之后用1 mol/L HCl调溶液pH至山苍子蛋白等电点,离心得到沉淀,冷冻干燥即得山苍子粗蛋白。山苍子蛋白提取率根据如下公式计算。
提取率=山苍子粗蛋白质量×粗蛋白中蛋白质含量/(山苍子粕质量×粕中蛋白质含量)×100%
1.2 5 起泡性及泡沫稳定性测定[10]
称取山苍子粗蛋白0.400 g,溶解于20 mL蒸馏水中,测定此时溶液体积V0,分别调其pH为2.0、4.0、6.0、8.0、10.0,室温条件下磁力搅拌1 h,之后将溶液置于均质机10 000 r/min剪切2 min,测定此时泡沫体积V1,并记录均质停止静置30 min后泡沫体积V2。起泡性和泡沫稳定性计算公式如下。
起泡性=V1/V0×100%
泡沫稳定性=V2/V0×100%
1.2.6 乳化性测定[11]
称取0.400 g山苍子粗蛋白溶于20 mL蒸馏水中,分别调其pH为2.0、4.0、6.0、8.0、10.0,室温磁力搅拌1 h,分别加入20 mL大豆油,在均质机中以10 000 r/min搅打2 min,转入50 mL离心管, 3 500 r/min离心20 min。根据乳化层高度(H1)和溶液总高度(H2)计算乳化性,计算方法如下。
乳化性=H1/H2×100%
1.2.7 持水性测定[10,12]
取50 mL塑料离心管,称重为M1。分别称取0.400 g山苍子粗蛋白,置于离心管中,加入蒸馏水20 mL,调节pH分别至2.0、4.0、6.0、8.0、10.0,恒温振荡60 min。另将装有山苍子粗蛋白的离心管分别置于水浴锅中30、45、60、75、90℃保温30 min后在冷水中冷却30 min。之后3 500 r/min离心20 min,倾倒去除上清液,称取离心管的质量M2。分别计算pH和温度对蛋白质持水力的影响。蛋白持水力计算公式如下。
持水力=(M2-M1-0.4)/0.4
1.2.8 数据分析
数据均为3组测定结果的平均值,采用Origin 8.0进行数据整理、分析及作图,利用SPSS 17.0对结果进行统计分析。
2 结果与分析
2.1 脱脂山苍子粕主要成分(见表1)

表1 脱脂山苍子粕主要成分 %
由表1可知,脱脂山苍子粕中粗蛋白质含量为37.30%,此外含有大量的粗纤维成分,主要是山苍子核壳部分,同时含有10.80%的水分、4.07%的粗脂肪及2.71%的灰分。山苍子粕中粗蛋白质含量较高,可将其作为一种新型蛋白质资源加以开发利用。
2.2 山苍子蛋白等电点
不同pH下的山苍子蛋白溶解度如图1所示。
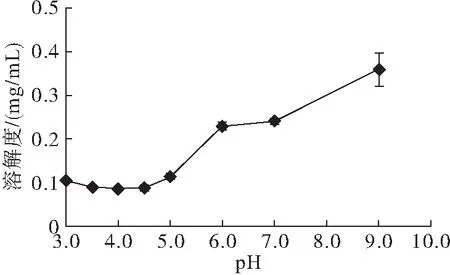
图1 不同pH下山苍子蛋白溶解度
由图1可以看出,当pH在3~5范围内时,山苍子蛋白溶解度较低,最低值在pH 4.0左右,此时上清液中山苍子蛋白溶解度仅为0.086 mg/mL,当pH大于6.0时,山苍子蛋白溶解度显著增加,pH 7~8时,山苍子蛋白溶解度为0.25 mg/mL左右,当pH为9时,山苍子蛋白溶解度增加至0.35 mg/mL。等电点时蛋白分子带电荷最少,因此静电斥力最小,蛋白聚集使溶解度最低,并形成沉淀[13],故后续选取等电点4.0为山苍子蛋白提取时的酸沉pH。山苍子蛋白等电点与花生蛋白及其他大多数油料蛋白的等电点较为相似[14-15]。
2.3 山苍子蛋白提取单因素试验
2.3.1 浸提pH对山苍子蛋白提取率的影响
在浸提温度35℃、料液比1∶15和浸提时间60 min条件下,研究浸提pH对山苍子蛋白提取率的影响,结果如图2所示。
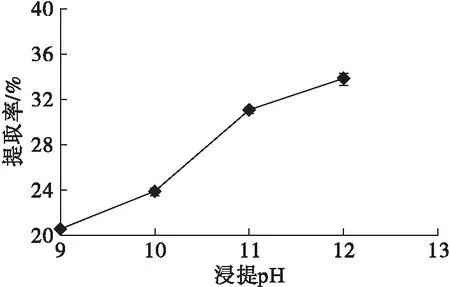
图2 浸提pH对山苍子蛋白提取率的影响
从图2可以看出,随着浸提pH的提高,山苍子蛋白提取率不断升高。山苍子蛋白组分多数为碱溶蛋白,随浸提pH增大蛋白带电荷增多,溶出能力提高,当浸提pH升高到11以后,继续增大浸提pH,山苍子蛋白提取率增大幅度变缓,表明在浸提pH为11时山苍子蛋白能够溶出较多。强碱性条件下,蛋白质的营养学特性易改变,易导致脱氨、脱羧和肽键断裂等化学反应,生成赖氨酰丙氨酸等有毒物质,造成营养物质损失[16];除此之外,强碱条件还会使蛋白质变性和水解,产生黑褐色物质,影响产品色泽和风味[17-18]。考虑到过高浓度的碱液会引入大量的离子,增加产品的盐分[19],故浸提pH选择11为佳。
2.3.2 料液比对山苍子蛋白提取率的影响
在浸提时间60 min、浸提温度35℃、浸提pH 11条件下,研究料液比对山苍子蛋白提取率的影响,结果如图3所示。
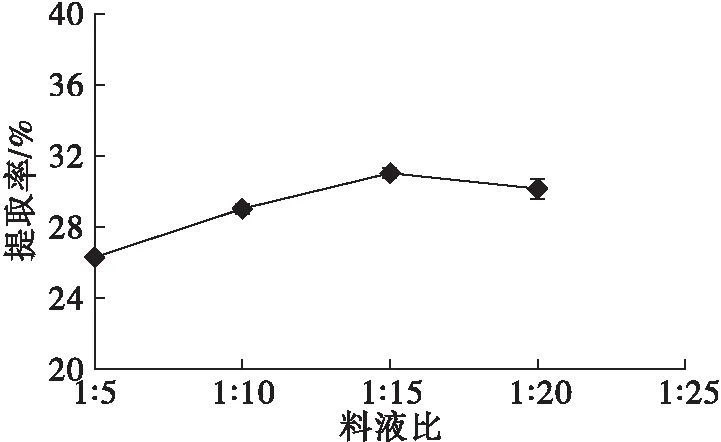
图3 料液比对山苍子蛋白提取率的影响
由图3可以看出,山苍子蛋白提取率随料液比的增加而升高,当料液比为1∶15时,山苍子蛋白提取率最大,当料液比为1∶5时提取率相对较低。这是因为当料液比较低时,山苍子粕膳食纤维吸水膨胀,不易搅动,降低了提取效率[20]。料液比升高至1∶20 时提取率无增长趋势。此时浸提液较多,降低了蛋白质分子在水中的扩散作用,导致蛋白溶出下降,同时提取液中蛋白质浓度偏低,也不利于蛋白提取后的酸沉过程[21]。综合考虑,料液比选择1∶15为佳。
2.3.3 浸提时间对山苍子蛋白提取率的影响
在料液比1∶15、浸提温度35℃、浸提pH 11条件下,研究浸提时间对山苍子蛋白提取率的影响,结果如图4所示。

图4 浸提时间对山苍子蛋白提取率的影响
由图4可以看出,延长浸提时间,山苍子蛋白提取率会略微提高,但过长的浸提时间并不能有效提高提取率,蛋白质在60 min提取过程已接近完全溶出。由于浸提时间越长,能耗越大[22],故浸提时间选择60 min为佳。
2.3.4 浸提温度对山苍子蛋白提取率的影响
在料液比1∶15、浸提pH 11、浸提时间60 min条件下,研究浸提温度对山苍子蛋白提取率的影响,结果如图5所示。

图5 浸提温度对山苍子蛋白提取率的影响
由图5可以看出,当浸提温度为25℃时,山苍子蛋白提取率为30.09%,当浸提温度升高至35℃时,提取率略微升高,浸提温度继续升高,提取率变化不大,由于浸提温度过高会使蛋白质变性并增加能源消耗,同时会对蛋白结构造成一定影响[23]。综合考虑,浸提温度选择35℃为佳。
2.4 正交试验优化山苍子蛋白提取工艺条件
根据单因素试验结果,以浸提pH、浸提温度、料液比、浸提时间4个因素为变量,山苍子蛋白提取率为指标,进行L9(34)正交试验,以确定碱提山苍子蛋白最佳工艺条件。正交试验因素水平见表2,正交试验设计及结果见表3。

表2 正交试验因素水平

表3 正交试验设计及结果
由表3可以看出,在碱提山苍子蛋白工艺中,4个因素主次顺序为浸提pH>浸提温度>料液比>浸提时间,最优组合为A3B2C2D1,即浸提pH 12、浸提温度35℃、料液比1∶15、浸提时间60 min。但由于当浸提pH为12时,溶液处于过碱状态,蛋白质的性质和结构将易被破坏,故浸提pH选取11,在此条件下提取率为31.03%,提取物中蛋白质含量为75%。
2.5 pH对山苍子蛋白起泡性及泡沫稳定性的影响(见图6)

图6 pH对山苍子蛋白起泡性及泡沫稳定性的影响
由图6可见,pH对山苍子蛋白起泡性具有显著影响,起泡性整体变化趋势与山苍子蛋白溶解度呈现相似趋势。在等电点pH 4附近,山苍子蛋白溶解度最低,起泡性也最低,约为5%,随着pH偏离等电点,山苍子蛋白可溶部分增多,起泡性显著升高,当pH为10时,起泡性达130%。泡沫稳定性呈现相似趋势,随着pH偏离等电点,山苍子蛋白溶解度的增加,使更多的蛋白质作为泡沫稳定剂吸附在气泡表面,蛋白质分子间相互作用形成较厚的吸附膜,从而增加泡沫稳定性[24]。虽然山苍子蛋白在pH 10时具有最高的起泡性,但此时泡沫稳定性并未显著提升,表明高碱性pH时蛋白结构伸展,使得蛋白吸附速度提高,但同时由于此时静电斥力增大,故起泡性增大,但泡沫稳定能力下降。
2.6 pH对山苍子蛋白乳化性的影响(见图7)
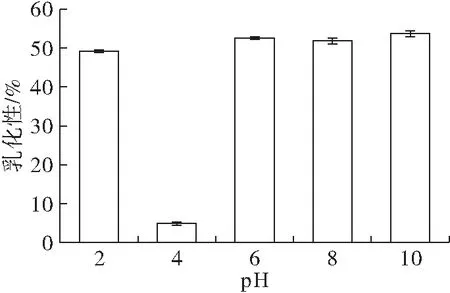
图7 pH对山苍子蛋白乳化性的影响
由图7可见,当pH为4时,山苍子蛋白的乳化性最低,可能是由于等电点时溶解性较差,吸附在油-水界面上的蛋白数量减少,蛋白呈现聚集状态,导致表面活性较低。中性及碱性条件时,蛋白分子静电斥力增大,蛋白表面带电荷量增多,有利于避免蛋白的聚集,此时蛋白溶解度较高,较多蛋白分子吸附在两相界面上,使得乳化性提高[25]。
2.7 持水性
2.7.1 pH对山苍子蛋白持水性的影响(见图8)

图8 pH对山苍子蛋白持水性的影响
持水性可表征蛋白与水分子结合形成凝胶的能力。由图8可见,山苍子蛋白的持水力在pH 2~10范围呈现先下降后上升的趋势,在pH 4~6范围山苍子蛋白的持水力较低,在偏酸性和偏碱性条件下具有较高的持水力。这可能是因为pH影响了蛋白分子的离子作用和静电荷数量,从而影响蛋白分子间的作用力以及蛋白与水分子结合的能力。远离等电点时,蛋白分子静电斥力增加,使持水性增加[26]。
2.7.2 温度对山苍子蛋白持水性的影响(见图9)

图9 温度对山苍子蛋白持水性的影响
由图9可见,山苍子蛋白的持水力随着温度的升高呈现先升高后下降的趋势。在30~60℃,山苍子蛋白的持水力随着温度的升高而增大,60℃时达到最大;超过60℃,随着温度继续升高,持水力略有下降,这可能与蛋白质的热变性有关,高温时蛋白分子构象发生变化,分子之间相互聚集,从而使持水力下降。蛋白质适度的热变性有利于其分子的伸展,从而增加蛋白质分子与水作用程度,而过高的温度会使蛋白质热变性程度升高[27]。同时将山苍子蛋白持水力与商业大豆分离蛋白的持水力比较,可发现山苍子蛋白持水力与大豆分离蛋白接近,并在温度低于60℃时持水力略高于大豆分离蛋白。
3 结 论
对山苍子核仁中蛋白提取工艺条件进行单因素试验和正交试验,得到的最佳工艺条件为:浸提pH 11,料液比1∶15,浸提温度35℃,浸提时间60 min。在最佳条件下,山苍子蛋白的提取率为31.03%,提取物中蛋白质含量为75%。山苍子蛋白等电点为4.0,山苍子蛋白的起泡性、乳化能力、持水能力均在pH偏碱性范围较高,在等电点附近,山苍子蛋白溶解性、乳化性及起泡性均较低。山苍子蛋白持水性与商业大豆分离蛋白接近,具有较好的功能性质。

