肠道菌群失调与消化系疾病相关性研究进展
李 晨,陈 伟,王 猛,周永坤
人类消化道寄居着一个复杂而有活力的微生物群即肠道菌群,其与宿主共同进化数千年,形成错综复杂的互利关系[1]。据估计,人胃肠道中寄居的微生物总量已经超过1014个,其微生物基因组数量超过人类基因组数量的100 倍[2]。
健康的肠道菌群主要由厚壁菌门和拟杆菌门构成,其次是放线菌门和疣微菌门。肠道菌群在肠道的不同部位其数量和分布存在差异。菌群数量由在食管和胃中的含量10个/g增长到在结肠的含量1012个/g[3],可见肠道中优势菌群的分布存在纵向差异。如表1所示,链球菌是食管远端、十二指肠和空肠的优势菌属[4-5]。在胃腔中,幽门螺杆菌(helicobacter pylori,HP)是优势菌,它决定着整个胃腔的微生物群落蓝图,当HP以共生菌的形式存在时,可与链球菌属、韦荣球菌属、罗思氏菌属共生。一旦HP获得致病表型,胃腔中菌群多样性便会降低。小肠菌群包括链球菌、拟杆菌、梭状芽胞杆菌、乳酸杆菌、肠球菌、γ-变形菌,如空肠弯曲菌、沙门氏菌、霍乱弧菌、大肠杆菌和脆弱拟杆菌,这些病原菌的丰富度相对较低,大约占整个肠道菌群的0.1%[6]。如表2所示,除纵向差异外,在管腔与肠粘膜表面,肠道菌群的分布还存在轴向差异。拟杆菌、双歧杆菌、链球菌、肠球菌、梭状芽孢杆菌、乳酸杆菌、肠球菌和瘤胃球菌主要寄生于管腔中,可于粪便中检测;梭状芽孢杆菌、乳酸杆菌、肠球菌主要寄生于肠黏膜表面,可在粘液层和小肠上皮隐窝中检测[7]。
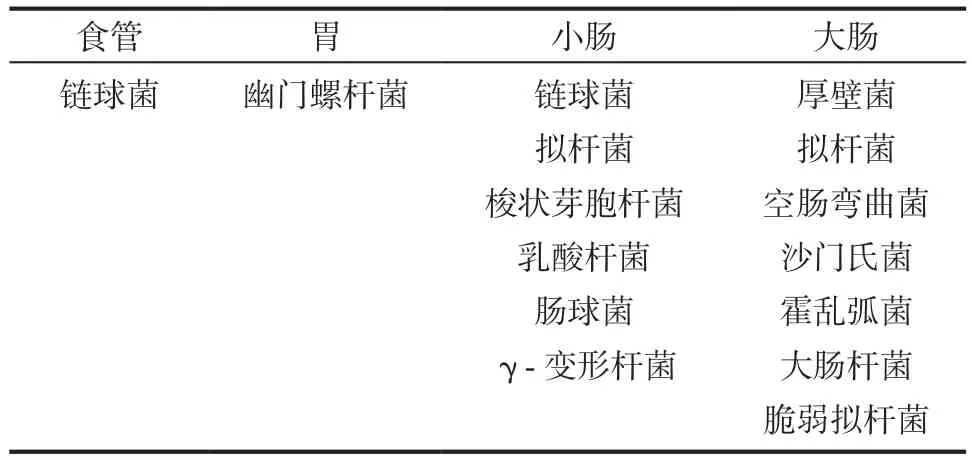
表1 肠道菌群的纵向分布

表2 肠道菌群的轴向分布
2 肠道菌群与消化系疾病
肠道菌群不仅数量庞大种类多样,而且与宿主健康息息相关,被认为是未来疾病治疗的潜在新方法[8]。肠道菌群自身拥有广泛的代谢能力和潜在的功能价值,既能从宿主的膳食成分和脱落的上皮细胞中获取营养物质,又能将宿主无法消化的多糖酵解为单糖和短链脂肪酸, 增加宿主对能量的吸收,促进肠上皮细胞增殖分化和肠道免疫系统的发育成熟,抵御病原微生物入侵。大量研究表明肠道菌群失调与功能性肠病(functional bowel disorders, FBD)、炎症性肠病(inflammatory bowel disease,IBD)、非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)、胰腺炎及消化道肿瘤等疾病密切相关。
2.1 肠道菌群与FBD FBD发病部位多在中、下消化道,其症状不能以结构或生化异常来解释,目前认为,FBD的发病机制是由于胃肠运动和感觉功能的中枢和外周神经系统功能异常引起,同时与遗传易感性、周围胃肠道因素、肠外神经激素和中枢性因素等有关。最近研究显示,肠道菌群失调与FBD发生密切相关。
随着16 S核糖体核糖核酸基因测序技术发展,人们分析肠道菌群与功能性便秘关系时发现,拟杆菌属在便秘患者的结肠黏膜富集,厚壁菌属与结肠转运密切相关[9]。
肠易激综合征(irritable bowel syndrome,IBS)是一种慢性功能紊乱性肠病,与肠道菌群分布变化、微生物多样性降低有关。IBS患者的亚型(腹泻型,便秘型,混合型)之间存在菌群分布的明显差异。其严重程度亦与粪便菌群特征有关,以菌群多样性减少,尤其是甲烷杆菌和普氏菌减少为特征[10]。IBS患者还存在厚壁菌门(如乳酸杆菌和双歧杆菌)减少[11],而潜在链球菌属增加[12]。动物研究显示,IBS患者粪便侵染无菌小鼠,其肠道生理转运功能和疼痛反应发生改变[13]。IBS也与小肠菌群过度生长有关。空肠穿刺培养大于105CFU/mL的细菌量被定义为小肠菌群过度生长,当小肠菌群过度生长的情况纠正后,IBS症状获得显著改善[14]。
2.2 肠道菌群与IBD IBD是一种慢性、自发性、反复发作的胃肠道炎症性疾病,主要包括溃疡性结肠炎和克罗恩病。其发病机制涉及肠道菌群,肠道菌群通过不断刺激肠道上皮导致肠道上皮屏障破坏,诱发IBD[15]。在溃疡性结肠炎患者肠道炎症严重的病灶,肠道菌群定植数量亦较多,炎症程度与细菌脂多糖内毒素活性相关。核苷酸结合寡聚化结构域 2(nucleotide oligomerization domain 2,NOD2)是第一个被确定的在克罗恩病发病中易感性基因。NOD2基因突变的病人,肠黏膜黏附细菌增加。携带NOD2等位基因的患者,梭菌属减低,放线菌、变形杆菌以及肠杆菌增加[16]。目前有超过160个基因位点发现调节IBD的发病风险,对菌群产生肠道免疫反应的特定位点与IBD的发病相关[17]。另外,克罗恩病患儿的结肠活检标本的研究表明,肠杆菌、巴斯德菌、韦荣球菌、梭杆菌科的丰富度增加,类杆菌和梭状芽胞杆菌降低[18]。真菌也与克罗恩病有关,包括酿酒酵母菌、白色念珠菌、马克思克鲁维酵母等。特别是与酵母细胞壁多糖反应的抗酿酒酵母抗体,可作为克罗恩病诊断的血清学标志物。克罗恩病患者的热带假丝酵母数量增加,与抗酿酒酵母抗体效价和生物膜中的灵杆菌和大肠杆菌数量相关。真菌微生物群还通过天然免疫受体树突状细胞相关性C型植物血凝素-1(Dectin-1)与宿主免疫细胞相互作用。 Dectin-1通过Caspase募集域家族成员9受体(CARD9)识别真菌细胞壁葡聚糖并激活细胞内信号,导致炎症细胞因子的产生继而诱导辅助性T 细胞17的应答反应。Dectin-1和CARD9的突变体均与克罗恩病和溃疡性结肠炎的发病有关,尤其 Dectin -1的突变与难治型溃疡性结肠炎关系更加显著。
IBD模型的小肠黏膜菌群分析发现,变形菌门增加, 拟杆菌门、梭杆菌门和硬壁菌门减少[19]。IBD患者的肠道菌群失衡,肠道菌群多样性显著降低,以厚壁菌和拟杆菌为代表的特定菌群降低为主,而肠杆菌包括大肠杆菌、梭杆菌的数量相对增加。
2.3 肠道菌群与NAFLD 肝脏和肠道关系密切,门静脉系统接受来自肠道的血液,肠血液成分可能参与慢性肝病的发生。研究表明菌群失调在NAFLD发生发展中发挥作用。非酒精性脂肪性肝炎患者的变形杆菌、肠杆菌和大肠杆菌明显升高[20],而拟杆菌减少[21]。胆酸与甘氨酸或牛磺酸在肝脏中形成结合型胆汁酸,进入肠道后,在肠道菌群的作用下形成胆汁酸[22]。胆汁酸与血清甘油三酯水平呈正相关,因此肠道菌群可通过调节胆汁酸水平与NAFLD的发生有一定关联。Toll样受体(toll-like receptors ,TLR)有助于宿主防御病原体入侵。TLR,特别是内毒素的主要受体TLR4,在肝脏慢性炎症性疾病的发病机制中起关键作用,是酒精性肝病和非酒精性肝病的肝脏炎症的中枢介质。在肥胖的动物和人体内,增加的内毒素与NAFLD关系密切。内毒素-TLR通路在肠-肝轴失衡介导的NAFLD发病机制中具有重要作用,肠道菌群失衡可引起TLR激活,从而促进炎性反应级联反应,进而加重非酒精性脂肪性肝炎的肝损伤[23]。
2.4 肠道菌群与胰腺炎 目前肠道菌群与胰腺炎关系的研究甚少。多中心研究表明,急性胰腺炎患者的肠杆菌和肠球菌群较高,而双歧杆菌较低,肠道菌群很可能与急性胰腺炎的病情进程有关[24]。慢性胰腺炎患者的厚壁菌与拟杆菌之比升高,普氏杆菌和布氏瘤胃球菌的丰富度增加;普氏杆菌的丰度与血浆内毒素呈负相关。研究还表明,柔嫩梭菌群可以通过刺激黏蛋白和紧密结合蛋白的合成来改善肠道屏障的功能。在合并有糖尿病时,慢性胰腺炎患者柔嫩梭菌群的数量大量减少,可能会导致肠道黏膜屏障的完整性受到破坏,从而使患者病程更长,营养不良程度更高[25]。
此外,HP增加胰腺炎大鼠模型组织炎症的严重程度[26]。慢性胰腺炎模型组小鼠的细菌和HP的过度生长可增加胰腺的炎症和纤维化程度[27]。
2.5 菌群失调与消化道肿瘤 肠道菌群与胃癌、结直肠癌、肝癌发展密切相关。HP的感染是胃癌发展的一个主要危险因素。HP通过一系列的机制侵袭和破坏胃黏膜,主要包括结构和粘着优势,如通过蠕动的鞭毛向胃粘蛋白层渗透以及产生尿素酶中和胃酸环境,从而定殖在胃黏膜上皮,引起炎症和免疫反应,导致消化性溃疡或慢性胃炎[28]。HP的高度致癌株携带的细胞毒素相关基因A是一个恶性肿瘤调节因子,通过作为外在支架蛋白破坏宿主信号通路,增强基因组的不稳定性或恶性转化,导致胃癌发生[29]。
当有外界干扰改变正常菌群的组成时,肠道菌群中专性厌氧菌被兼性厌氧APC蛋白在维持肠上皮细胞平衡中发挥重要作用。它的失活会激活Wnt /β-连环蛋白信号通路[30],使β-连环蛋白转运到细胞核,引发息肉增长[31]。肠道菌群在Wnt /β-连环蛋白信号通路失调上发挥作用,进而引发结直肠癌[32]。将来自结直肠癌带瘤小鼠的肠道菌群接种到无菌小鼠,发现菌群可以诱发无菌小鼠结直肠癌产生[33]。这样,改变肠道微生物组成有可能是防止结直肠癌发展的有效策略。
另外,慢性肝病和肝硬化与肝癌发病密切相关。肝硬化患者的肠道菌群组成发生实质性的变化,比如韦永氏球菌属或链球菌属富集,梭菌属的细菌减少[34]。并且患者代偿期与失代偿期菌群分布差异[35]说明肝硬化的病情发展与肠道菌群变化密切相关,从而可能参与肝癌的发生。
3 总结和展望
近年来,随着对肠道菌群的深入研究,肠道菌群与消化系疾病的关系越来越受到重视。肠道菌群不仅可酵解食物中较复杂的碳水化合物,生成短链脂肪酸,还参与宿主对食物的消化、营养摄入、肠道发育、免疫调节、肠动力等多种生理功能。然而因检测技术限制、标本来源困难、肠道解剖部位特殊及其本身的理化特性等因素限制了对肠道菌群的研究。深入地研究肠道菌群与消化系疾病的关系不仅有助于更全面地了解病因,而且可以借助肠道菌群的关系调节菌群失调,从而达到治疗消化系疾病的目的。对于肠道菌群与消化系疾病的关系仍存在许多未解之谜, 有待进一步深入探讨。

