硫化氢通过Nrf2/HO-1对神经病理性疼痛的调控作用
田礼华,韩焕芝,张 杨,谢克亮,陈红光
神经性疼痛是由周围神经系统或中枢神经系统的原发性损伤或功能障碍引起的,其临床表现以触诱发痛和痛觉过敏为主要特征,在人群中的患病率为8%[1]。周围神经损伤后的一系列症状和体征引起周围神经敏化,导致伤害性感受活动增强,疼痛阈值降低[2]。炎症反应在神经病理性疼痛的发病过程中发挥重要的作用。神经病理性疼痛是一种神经免疫疾病,免疫和神经胶质细胞的激活导致受损神经中炎症因子的释放。核因子-E2(nuclear factor,NF-E2)相关因子2 (related factor2,Nrf2)是一种碱性亮氨酸拉链氧化还原敏感转录因子,是编码II期解毒/抗氧化酶基因表达的主要转录调控因子,其下游编码的蛋白包括血红素加氧酶-1(HO-1)等。据报道,Nrf2/HO-1通路在脂多糖(LPS)诱导的巨噬细胞炎症反应中发挥重要调控作用[3]。硫化氢作为一种医用治疗气体,在一系列疾病当中发挥重要调控作用,如高血压、炎症、心力衰竭等[4]。研究报道,硫化氢通过减轻周围神经损伤炎症反应,改善神经病理性疼痛导致的痛觉过敏[5]。本实验拟在上述理论基础上,通过对神经病理性疼痛大鼠研究,探讨硫化氢对脊神经结扎(spinal nerve ligation,SNL)大鼠小胶质细胞激活的影响,及其Nrf2信号通路在这一过程中的调控机作用
1 材料与方法
1.1 动物分组及模型制备 选择雄性SD大鼠64只,体质量200~250 g,购自中国人民解放军军事医学科学院实验动物中心。饲养在室温20~25℃的SPF级动物房,自由进食水,适应环境1周。采用随机数字表法随机分为4组:对照组(Con组)、神经病理性疼痛组(SNL组)、神经病理性疼痛+NaHS组(SNL+NaHS组)和神经病理性疼痛+NaHS+Nrf2 siRNA组(SNL+siRNA+NaHS组)。神经病理性疼痛模型采用SNL完成。参考文献[6]方法,动物俯卧位,腰背部皮肤消毒,钝性分离,暴露左侧腰椎。分离L5神经,用4-0丝线用力结扎,远端剪断神经后逐层缝合。术毕肌肉注射青霉素,预防感染。手术后继续喂养至术后第7 d。
1.2 行为学 每组分别于SNL模型建立后1、2、3、5和7 d测定机械刺激缩足反应阈值(mechanical withdrawal threshold,MWT)和热缩足潜伏期(thermal withdrawl latency,TWL)。
机械刺激缩足反应阈值:参考文献[7],用Von-Frey纤维法进行机械痛阈检测。将大鼠放于透明玻璃笼中,玻璃底部有小孔。适应环境后,用不同力度值的von-Frey纤维丝(Stoehing公司,美国)刺激大鼠左后爪足底,刺激力度以von Frey丝轻微弯曲为准,直至出现缩足反应。缩足反应为阳性,记录力度为痛阈值,通过“up-and-down”的方法计算。
热缩足潜伏期:参考文献[7],大鼠适应30 min,使用热痛刺激仪(UGO公司,意大利),照射大鼠后足掌正中,自动记录缩足反应的潜伏期作为热痛阈。持续时间为20 s以内,以免造成足底损伤。每只大鼠测定5次,取5次平均值作为TWL。
1.3 鞘内置管及siRNA处理 采用Yaksh法稍作修改行鞘内置管[8]。麻醉,背部皮肤消毒。于L3~L4椎间隙为穿刺点,向尾端蛛网膜下腔置入PE-10导管2 cm。观察大鼠尾巴摆动及清亮脑脊液从导管内缓慢流出,为穿刺成功。固定导管,缝合伤口。出现肢体运动障碍者剔除。SNL+siRNA+NaHS组鞘内转染试剂2 μg siRNA-NLRP3加 入 10Μl DEPC水 +5 μL Lipofectamine,进行鞘内注射。Nrf2的siRNA序列由上海吉玛生物合成,Nrf2 siRNA正义链5'-AGAUUUAGAUCAUUUGAAATT-3’, 反 义 链5'-UUUCAAAUGAUCUAAAUCUTG-3’。
1.4 标本收集及准备 Con组、SNL组和SNL+NaHS组接受处理后7 d,收集各组大鼠脊髓膨大处,部分组织进行核蛋白和RNA的提取进行Nrf2的检测,部分组织包埋进行免疫荧光IBA1和Nrf2的共定位检测。Con组、SNL组、SNL+NaHS组和SNL+siRNA+NaHS组,给予处理后的1、2、3、5和7 d进行行为学的检测,于第7 d收集大鼠脊髓膨大处,进行蛋白的检测,部分组织匀浆,进行炎症因子的检测。
1.5 Western blotting 检测 采用 Western-blotting法检测大鼠脊髓中蛋白的表达水平。蛋白经过10% SDS-PAGE 凝胶电泳分离,转模到PVDF膜上。在室温下5%脱脂奶粉进行封闭2 h,加入Histone、Nrf2、IBA1、HO-1和β-actin特异性一抗 (稀释比 1:200~1:1000,Abcam,美国 ), 4 ℃孵育过夜。洗膜后,给予辣根过氧化物酶连接的二抗(稀释比1:5000,北京中杉金桥公司)室温孵育1 h。洗膜,用ECL液显色曝光。以相应的条带灰度值与内参条带灰度值之比作为结果对比。
1.6 RT-PCR检测 脊髓组织经过DEPC水处理过,经过Trizol、氯仿、异丙醇、75%乙醇处理,得到总RNA。进行逆转录合成cDNA,然后扩增引物。参数为 95 ℃ 2 min,95 ℃ 15 s,52 ℃ 20 s,60 ℃ 40 s, 45 个循环。读取 Ct,按2-ΔΔCt计算出相对含量。大鼠Nrf2上游引物5'GTGCCTTDAGTGTGCTTCTG-3’, 下 游 引 物5'TCCTCTGCTGCCATTAGTCA-3',以GAPDH为参照物,上游引物为5'TCACCATCTTCCAGGAGCGAG-3',下游引物5'TGTCGCTGTTGAAGTCAGAG-3'。
1.7 免疫荧光 收集脊髓组织,进行冰冻切片,PBS漂洗3次,室温封闭2 h。IBA1和Nrf2一抗(稀释比1:200)4 ℃过夜,漂洗3次,FITC对应二抗室温避光孵育2 h。漂洗3次,DAPI染色5 min,漂洗,封片,荧光显微镜观察并拍照。
1.8 ELISA检测 采用ELISA法检测TNF-α和IL-1β的浓度,严格按照试剂盒(武汉博士德生物工程有限公司)说明书要求进行。
1.9 统计学处理 采用 SPSS 13.0 统计软件进行统计分析。正态分布的计量资料以均数±标准差()表示,组间比较采用单因素方差分析,两两比较采用LSD检验,P< 0.05为差异有统计学意义。
2 结果
2.1 各组Nrf2核蛋白和mRNA表达情况 与Con组比较,SNL大鼠Nrf2核蛋白和mRNA表达增加;与SNL组相比,SNL+NaHS组Nrf2核蛋白和mRNA表达进一步增加, 与SNL+NaHS组比较,SNL+siRNA+NaHS组Nrf2蛋白表达减少。见图1和图2。
2.2 各组Nrf2和IBA1蛋白表达情况 免疫荧光结果提示,与Con组比较,SNL大鼠Nrf2和IBA1蛋白表达增加,且荧光结果显示Nrf2和IBA1重合表达增加;与SNL组相比,SNL+NaHS组Nrf2和IBA1蛋白表达进一步增加,且荧光结果显示Nrf2和IBA1重合表达也进一步增加。见图3。
2.3 各组IBA、HO-1蛋白表达 与Con组比较,SNL大鼠IBA和HO-1蛋白表达增加;与SNL组相比,SNL+NaHS组IBA蛋白表达减少和HO-1蛋白表达进一步增加;与SNL+NaHS组比较,SNL+siRNA+NaHS组IBA蛋白表达增加和HO-1蛋白表达减少。见图2。
2.4 模型建立后不同时间点大鼠行为学变化 与Con组比较,SNL大鼠MWT减少,TWL缩短;与SNL组相比,SNL+NaHS组MWT增加,TWL延长;与SNL+NaHS组比较,SNL+siRNA+NaHS组MWT减少,TWL缩短。见图4。
2.5 各组TNF-α和IL-1β表达情况 与Con组比较,SNL大鼠TNF-α和IL-1β表达增加,;与 SNL组 相 比,SNL+NaHS组 TNF-α和IL-1β表达减少;与SNL+NaHS组比较,SNL+siRNA+NaHS组TNF-α和IL-1β表达增加。见图5。
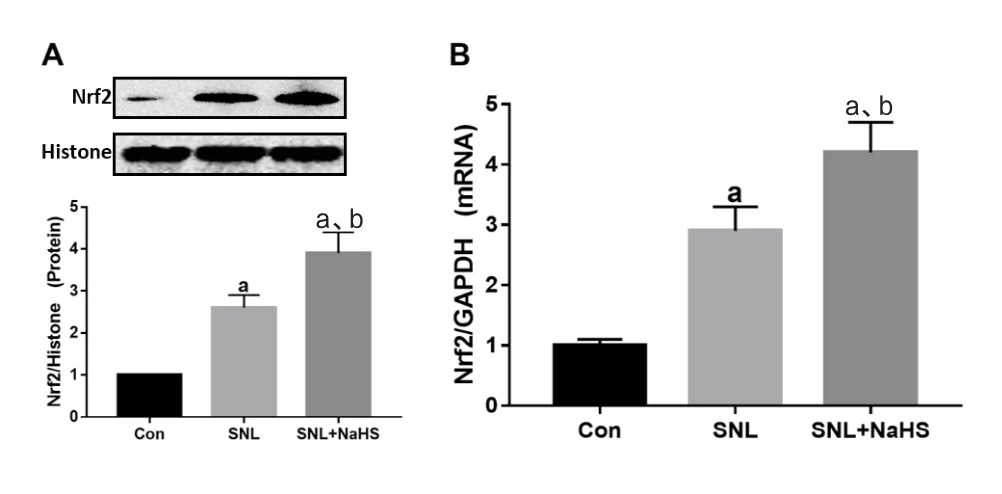
图1 3组大鼠Nrf2核蛋白和mRNA的表达变化

图2 4组大鼠脊髓组织IBA1,Nrf2和HO-1蛋白表达的比较
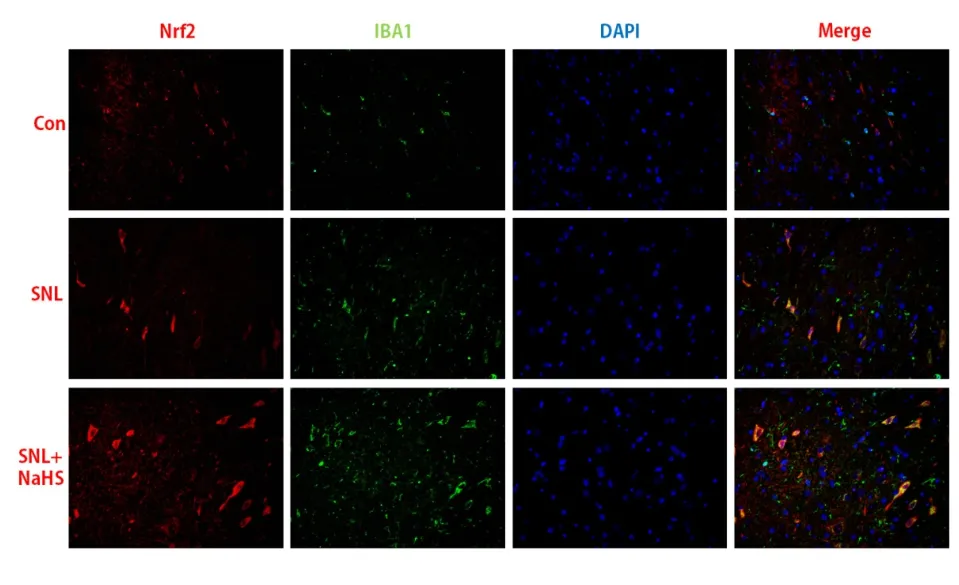
图3 3组大鼠脊髓背角免疫荧光Nrf2和IBA1表达变化的比较
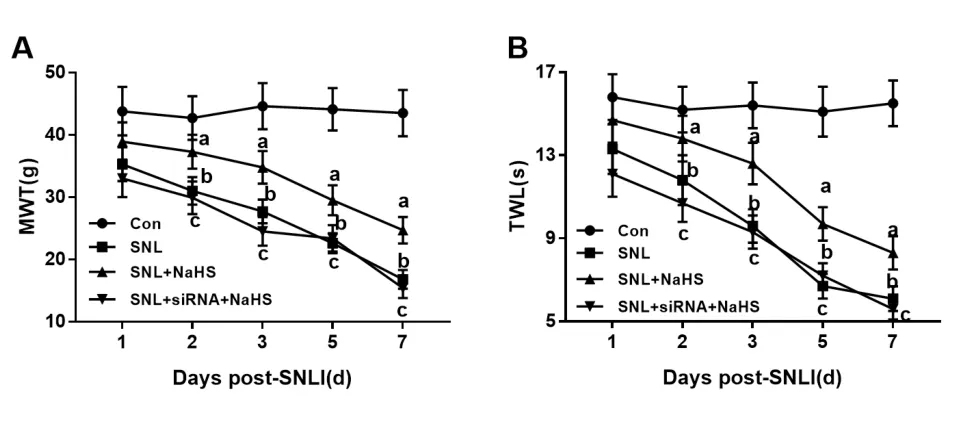
图4 4组大鼠行为学变化的比较

图5 4组大鼠脊髓组织TNF-α和IL-1β表达的比较
3 讨论
初级神经损伤引起的脊髓神经免疫和神经炎症活动增强,会导致并维持神经病理性疼痛的存在。外周神经受损可导致异常的免疫应答,导致外周或中枢神经系统过度的神经炎症。来自受损轴突发出的一种尚未确定的信号会激活细胞外信号调节激酶,即施万细胞中的丝裂原激活蛋白激酶信号通路,这是引发炎症介质过度表达和向受损神经招募免疫细胞的主要过程之一[9]。据报道,神经性疼痛不仅可以诱发神经元激活,而且还可进一步激活免疫细胞的活性,如小胶质细胞激活[10-12]。神经性疼痛治疗的目标为炎症反应,而小胶质细胞则为炎症介质释放主要效应器之一[13]。本研究结果提示,SNL可诱发神经免疫细胞—小胶质细胞的激活,表现为其标志物IBA1表达增加,小胶质细胞激活释放过量的炎症介质,TNF-α和IL-1β表达增加。这些促炎症介质的释放可调节神经元兴奋性和突触功能,致感觉系统的中枢和外周的神经敏化[14]。
研究发现,Nrf2系统的激活与炎症反应关系密切[15]。Nrf2不仅对内源性防御系统各种细胞应激具有重要的调节作用,而且还被认为是脑损伤中调控炎症的重要调节因子[15]。Nrf2在神经系统中广泛的表达,并且在急性脑损伤和神经退行性疾病中发挥重要的调控作用[16]。Nrf2在受到有害刺激后发生胞浆到胞核的转位,与位于核内的ARE结合,调控下游蛋白的表达。因此,本实验也进行了脊髓组织Nrf2和其下游蛋白HO-1的表达变化,发现SNL导致Nrf2核内蛋白和mRNA表达增加,其下游蛋白HO-1表达增加,证明Nrf2/HO-1系统在脊髓组织中被激活。
NaHS作为H2S的传递载体,被广泛应用于医学研究[17-18]。研究报道,H2S可抑制由炎症介质诱发的小胶质细胞的激活,减少炎症介质TNF-α、IL-6和CCL2的表达。本研究结果与上述结论一致。NaHS可以增加SNL大鼠脊髓组织Nrf2和其下游HO-1的表达,减少小胶质细胞的激活,减少炎症因子TNF-α和IL-1β的表达,从而神经免疫炎症反应,进一步的可以改善大鼠机械痛敏和热痛敏,发挥对神经免疫反应和中枢敏化的保护作用。为了进一步研究NaHS对神经痛的调控作用是否通过激活Nrf2通路,本实验采用siRNA抑制Nrf2的表达。结果提示,抑制Nrf2表达之后,NaHS失去了对炎症因子和痛敏的改善作用,不能对神经免疫反应和中枢敏化进行调控。由此可见,NaHS对神经病理性疼痛的保护作用是通过激活体内Nrf2/HO-1通路发挥作用的。
综上所述,NaHS可以激活Nrf2通路,增加Nrf2和HO-1的表达,且NaHS对SNL导致的神经病理性疼痛小胶质细胞的激活是通过调节Nrf2/HO-1信号通路实现的。

