胰尾后隧道在困难腹腔镜脾切除术中的应用
唐勇,李民,曹国军,胡青钢,万赤丹
(华中科技大学同济医学院附属协和医院肝胆外科,湖北 武汉430022)
随着腹腔镜技术的发展和手术器械的改进,腹腔镜脾切除术(laparoscopic splenectomy,LS)也日臻成熟,甚至成为轻、中度增大的脾切除的首选手术方式[1-3]。对于巨脾病人,尤其是伴有门静脉高压症,是否选用LS目前尚无统一定论,而手术的难点就在于如何控制出血,尤其是脾蒂的处理[4-5]。既往我们报道了一种通过“脾蒂上缘间隙”建立“脾蒂后隧道”,继而整体离断脾蒂的方法[6-8],取得了满意的效果。而对于困难的脾切除,术中出血风险更高,腹腔镜手术中一旦发生脾蒂出血,出血迅速而凶险,常常导致中转开腹,甚至危及病人生命。为了减少出血风险,我们使用金手指在胰尾背侧与左肾静脉之间建立隧道,简称胰尾后隧道,经隧道预置阻断带,将胰尾及脾脏动静脉主干束缚,当发生脾蒂出血时,收紧阻断带,阻断脾脏动静脉血流,从而控制出血速度,便于在腹腔镜下继续操作。本中心利用该方法取得了满意临床效果,现报告如下。
资料与方法
一、一般资料
收集2016年6月至2017年5月于华中科技大学同济医学院附属协和医院行困难LS的61例病人临床资料。61例病人中,40例因合并上消化道出血或者胃镜提示红色征阳性同期行贲门周围血管离断术[9],5例因胆囊结石同期行胆囊切除术,3例因肝占位行肝肿瘤穿刺活检术,1例因肝占位行肝叶切除术;4例既往有上腹部手术史,2例既往有下腹部手术史。所有病人术前均行CT或者MRI检查了解脾脏大小及血管走行,并告知手术方式和签署手术知情同意书。病人一般资料详见表1。
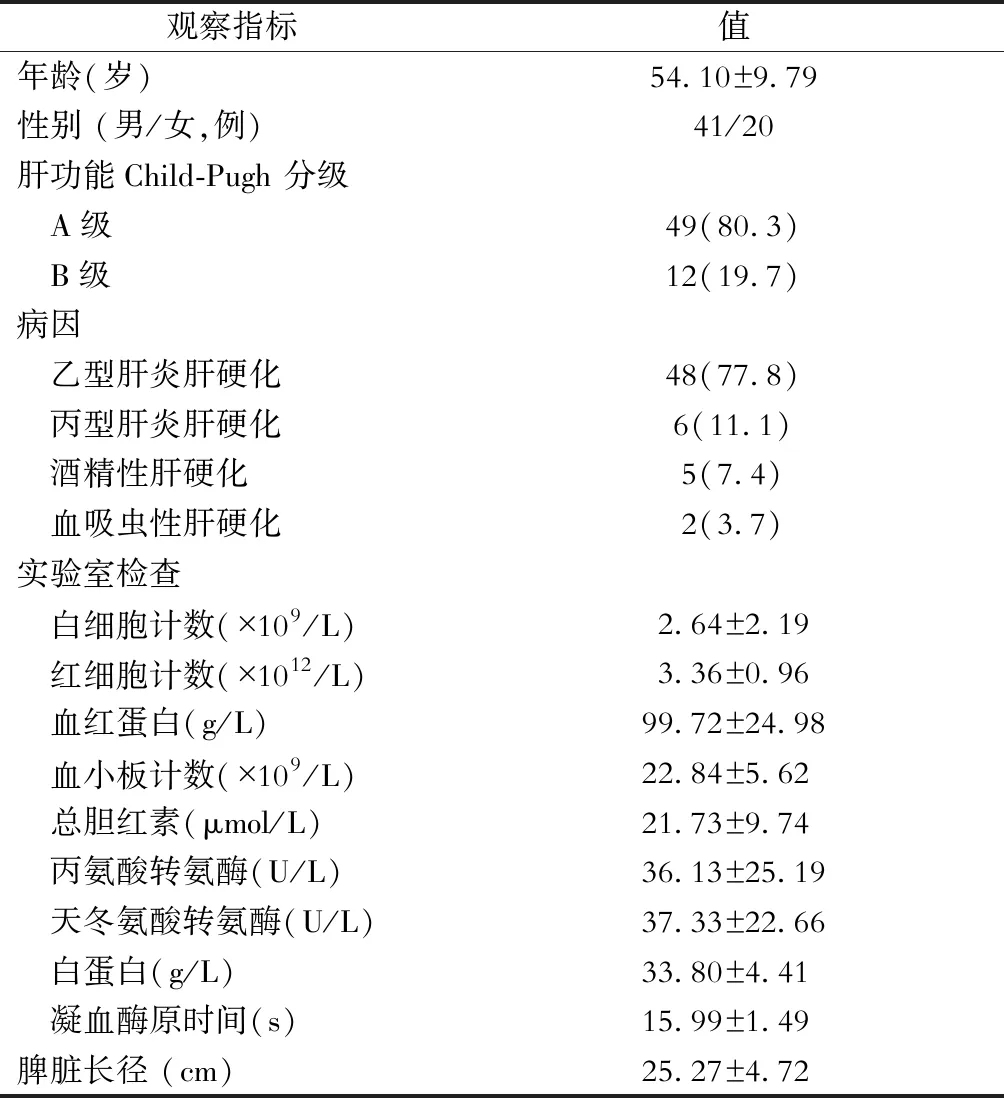
表1 病人一般资料
注:表中观察指标未注明单位的,其单位均为“例(%)”
二、纳入标准
①严重脾功能亢进(血小板计数<30×109/L 或者白细胞计数<3×109/L)[10];②肝功能Child-Pugh A 级或B级;③无心、肺、肾等器官严重损害;④能耐受CO2气腹;⑤术前或术中检查发现脾动脉位于胰腺后方,难以分离;⑥术前检查发现脾动脉周围血管迂曲扩张明显;⑦既往行脾动脉栓塞术,脾周围严重粘连且广泛侧支静脉形成;⑧脾门区动脉瘤。必须满足①~④,同时至少满足⑤~⑧其中一种。
三、手术方法
1.体位及Trocar布置 病人取仰卧位,左侧腰下垫高约10 cm,向右侧倾斜30°,并30°头高脚低位。气腹压维持在10~12 mmHg。采用五孔法:取脐旁1 cm为观察孔(10 mm Trocar),脐部与剑突连线中点偏右侧(12 mm Trocar)为主操作孔,具体部位需根据术中探查脾脏大小决定偏移距离,剑突左侧2~3 cm靠肋弓处(5 mm Trocar)、左侧锁骨中线平脐(5 mm Trocar)和左侧腋前线脾下极(12 mm Trocar)为副操作孔。术者和扶镜手位于病人右侧,助手位于病人左侧,所有手术均由同一组医生完成。
2.胰尾后隧道建立及预置脾蒂阻断带(图1) ①离断脾胃韧带,在距离脾门3~5 cm,胰尾下缘切开后腹膜,使用金手指钝性分离(图2),在胰腺背侧与左肾静脉腹侧的疏松间隙内分离,金手指头端经脾动脉主干上缘穿出,建立胰尾后隧道;②经隧道内预置阻断带(图3)。
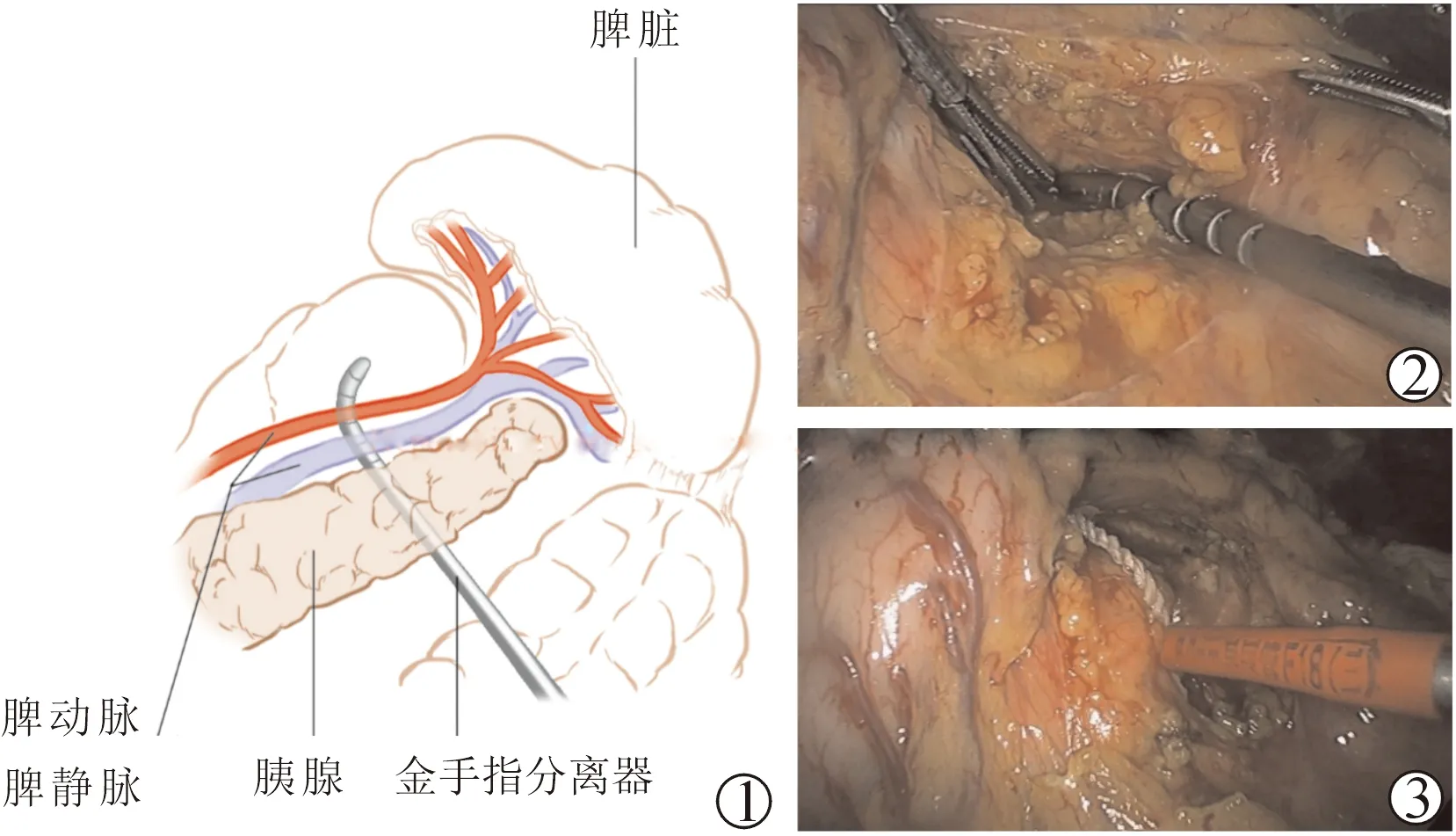
图1 胰尾后隧道建立及预置脾蒂阻断带 图2 离断脾胃韧带,在距离脾门3~5 cm,胰尾下缘切开后腹膜,使用金手指钝性分离,建立胰尾后隧道 图3 经隧道内预置阻断带
技术要点及注意事项:①胰尾后隧道需建立在脾动脉主干远端,靠近脾动脉发出分支处,便于完整阻断脾蒂动静脉血流;②建立胰尾后隧道时需保存完整胰腺被膜及脾脏动静脉鞘膜,否则有引起出血及损伤胰腺的风险;③阻断带宜选择直径较粗的棉绳或具有弹性的束带,收紧力度适中,便于松解,避免损伤胰腺。
3.脾切除方法 ①按上述步骤建立胰尾后隧道并预置阻断带;②离断脾脏周围韧带,经脾蒂上缘间隙建立“脾蒂后隧道”,根据术中需要适时收紧阻断带,阻断脾脏动静脉血流,内镜切割闭合器整体离断脾蒂;③分离结扎胃短血管,完整切除脾脏;④取出脾脏,脾窝处放置引流管。
四、观察指标
术前常规行血常规、肝肾功能、凝血功能检查,并进行Child-Pugh肝功能分级;胃镜检查以明确食管胃底静脉曲张程度;CT或者MRI检查明确脾脏大小和脾脏血管走向;围手术期指标包括手术时间(单纯脾切除时间)、术中出血量、输血率、中转开腹率、术后住院时间、胰漏发生率和术后进食时间等。
结 果
一、围手术期结果
本研究共有61例病人采用胰尾后隧道方法进行手术,20例病人脾动脉周围营养血管丰富,尝试解剖脾动脉后容易出血,改为胰尾后隧道进行手术;22例病人术前血管造影提示脾门周围血管重度迂曲;18例病人术前有脾动脉介入栓塞史。所有病人均顺利完成手术,无术中输血,无中转开腹,手术时间为(81.8±14.5) min,术中出血量为(68.6±23.2) ml,术后进食时间为(2.7±1.2) d,术后住院时间为(7.1±2.0) d。其中有25例在术中因出血收紧了预置阻断带,阻断时间10~25 min,术毕松开阻断带。全组无胰漏发生,共11例病人出现不同程度并发症,其中Clavien-Dindo分级Ⅰ级1例即胸水1例;Clavien-Dindo分级Ⅱ级10例:深静脉血栓2例、腹水2例、术后出血4例、肺部感染2例。所有并发症均经保守治疗后痊愈。
二、随访结果
本组61例病人,57例获得随访,随访率为93.4%,随访时间(15.54±1.75)个月(12~19个月);同期行贲门周围血管离断术病人3例(7.5%)术后1个月出现消化道出血,2例表现为呕血(其中1例因出血过多致多器官功能衰竭死亡,1例经内镜止血后痊愈),1例表现为黑便,经保守治疗后痊愈;8例(13.1%)病人出现门静脉血栓,均给予对症治疗,后期随访发现血栓无明显进展。
讨 论
脾功能亢进和食管胃底静脉曲张是肝硬化合并门静脉高压症病人的常见并发症,脾功能亢进导致血小板明显减少更易引起食管胃底静脉曲张破裂出血[11-12]。有学者[13报告肝功能Child-Pugh B级的病人行脾切除以后肝功能可以得到改善。随着腹腔镜技术的日趋成熟,国内外许多学者[14-15]也将LS应用于肝硬化和门静脉高压症病人,然而对于脾肿大病人,欧洲内镜外科学会仍不推荐行腹腔镜手术[1]。门静脉高压症病人,脾门血管往往迂曲扩张,血管壁薄、张力大,同时肝硬化导致凝血功能异常,在脾切除处理脾门血管时出血风险较高[16]。预先结扎脾动脉可以减少脾脏供血,使脾脏体积缩小,在脾切除时尤为重要[17],但对于部分病人脾动脉结扎困难,亟需另外一种方法控制脾脏血流。
本中心经脾蒂上缘间隙建立脾后隧道,然后用内镜切割闭合器整体离断脾蒂,明显降低了出血风险,节约了手术时间,同时我们发现胰尾和后腹膜之间存在一疏松的解剖间隙,对于肝硬化和门静脉高压症病人,该区域曲张血管也较少。打开胰尾下方后腹膜,可以用金手指沿胰尾与左肾静脉之间钝性向上分离并建立隧道,同时使用金手指可以在该隧道内预置棉线经胰尾前方绕回,然后经18F红色尿管穿出,形成一个阻断装置,类似于肝切除时Pringle's法阻断入肝血流[18];该方法同时阻断了脾脏动脉和静脉,在脾动脉结扎困难或者分离脾动脉易出血时可以收缩棉线达到阻断血流的目的。本研究中,使用金手指在胰尾后方解剖间隙钝性分离,并未对胰腺造成损伤,证明该隧道的建立是安全可行的。但是需要强调的是找到胰尾后方的疏松间隙同时保护好胰腺被膜是胰尾后隧道建立的要点。
对于脾动脉走行于胰尾后方难以分离的病人或者脾动脉周围血管较多分离易出血时,通过建立胰尾后隧道可以同时阻断脾动脉和脾静脉,控制脾脏血流,避免了强行解剖脾动脉造成的出血风险,同时该隧道的建立易于操作,可以达到与阻断脾动脉相同的手术效果。既往部分病例在解剖脾蒂引起难以控制的出血时,通常需要中转开腹止血,在此隧道的基础上,可以通过收紧棉线同时阻断脾脏的出入血流,为止血争取时间和空间,避免中转及开腹相关并发症的发生。
门静脉系统血栓形成是脾切除术后常见并发症,发生率为2%~26%[19-20],术后预防性抗凝治疗方案不一,本中心经验是术后第2天如无出血倾向即开始小剂量低分子肝素预防性抗凝治疗,出院后给予阿司匹林抗凝治疗并定期复查血小板含量和门静脉血管造影;长期随访结果显示门静脉血栓发生率为13.1%,再出血率为7.5%,与既往报道一致。
总之,门静脉高压症行腹腔镜脾脏切除时一旦发生出血往往凶险,处理棘手,必然使手术时间延长、术中失血量增加、输血率增加,严重者导致中转开腹,甚至危及病人生命,所以如何预防和控制术中出血是关键,虽然经脾蒂后隧道和脾蒂整体离断使常规的脾切除安全可行,但是仍有一部分病例脾蒂难以妥善处理,操作过程中面临很高的出血风险。胰尾后隧道建立及脾脏动静脉的阻断,能控制出入脾脏的绝大部分血流,犹如为我们处理复杂的脾蒂加了一道保险,可以增强术者的信心,也可以为术者妥善处理出血获得术野、赢得时间。经过本中心的实践,证明经胰尾后隧道脾脏血流阻断是简便、安全、可行的。当然,在何种情况下需要建立胰尾后隧道,建立胰尾后隧道有哪些风险和并发症,需要我们进一步研究和长期随访。在初步开展腹腔镜脾切除单位,术者如果担心因为操作不熟练可能出现难以控制的出血时,也可以常规先建立胰尾后隧道,预置脾脏血管阻断,减少术中出血量、输血率,降低中转开腹率,使更多病人获益。

