UBE2T在原发性肝癌中的表达及临床意义
石小康 丁佑铭 汪 斌 余 斌 徐 雨
原发性肝癌(简称肝癌)是最常见的恶性肿瘤之一,以肝细胞肝癌(Hepatocellular carcinoma,HCC)最为常见,约占70%~90%,在世界范围内其发病率居恶性肿瘤的第6位,致死率位列第2[1]。2015年新增病例约466 100人,死亡约422 100人,值得注意的是,仅中国就占每年新增病例和死亡人数的一半以上[2]。肝癌早期临床症状不明显,难以及时发现并诊断,故大多数确诊时已处于中晚期,预后多较差。据统计[3],在我国经年龄标准化后的5年生存率仅为10.1%左右。因此,亟需深入研究肝癌的发病机制,寻找敏感可靠的分子标志物,以期为肝癌的早期诊断、有效治疗及预后判断提供可靠依据。UBE2T是泛素结合酶E2家族成员之一,最初发现于范可尼贫血(Fanconi anemia,FA)患者。近年来研究发现,UBE2T在多种肿瘤中表达上调,如乳腺癌[4]、胃癌[5]、前列腺癌[6]、膀胱癌[7]等。也有研究报道其可以通过泛素化p53抑制其表达而促进肝癌细胞的增殖[8]。有鉴于此,本研究基于TCGA数据库现有数据探究UBE2T在肝癌组织中表达及其与肝癌患者临床病理参数及预后的关系,进一步探究其相应的作用机制。
1 资料与方法
1.1 收集数据资料
从TCGA数据库(https://cancergenome.nih.gov/)下载371例肝癌组织样本和50例正常肝组织样本的mRNA seqV2表达谱数据集及相对应的临床病理资料。筛除部分数据不详资料,余下正常肝组织样本50例,肝癌组织样本365例,其中有314例包含完整的无病生存时间随访。同时从cBioPortal网站(美国国家癌症研究所,http://www.cbioportal.org/)下载TCGA数据集肝癌患者UBE2T基因改变数据。
1.2 方法
1.2.1 生存分析 UBE2T mRNA seqV2表达谱数据集经log2处理后,将肝癌样本按UBE2T的表达量高低排序,以UBE2T的表达量中位数为分组的界值,分为高表达组与低表达组,表达量低于中位数值定义为低表达组,反之则为高表达组。利用Kaplan-Meier法分别分析两组患者的总生存期(Overall survival,OS)和无病生存期(Disease-free survival,DFS),并作Log-Rank检验。
1.2.2 富集分析 使用GSEA 3.0软件进行基因富集分析(Gene set enrichment analysis),按上述方法根据UBE2T表达量将其分为低表达组和高表达组。利用GSEA网站中分子标签数据库(Molecular Signatures Database,MsigDB)中获得的c2.cp.kegg.v6.0.symbols.gmt数据集为参照数据集,按缺损加权富集统计(Default weighed enrichment statistic)的方法,设置随机组合次数为1 000次,进行分析GSEA,以P<0.05,FDR<0.25为条件判断显著富集基因集。
1.3 统计学处理
采用SPSS 22.0软件进行统计分析,使用GraphPad Prism 6软件作图,计量资料采用独立样本t检验,UBE2T mRNA表达与肝癌患者临床病理学特征的关系采用χ2检验,运用Cox比例风险回归模型分析影响患者预后的危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 UBE2T在cBioPortal数据库中的改变
cBioPortal数据库包含348例(共371例,部分数据缺失)HCC患者的UBE2T基因表达数据。该队列中22%(75/348)的HCC病例表现出UBE2T改变,其中包括61例mRNA上调,20例扩增,6例既包括mRNA上调也包括扩增,0例错义突变(图1)。
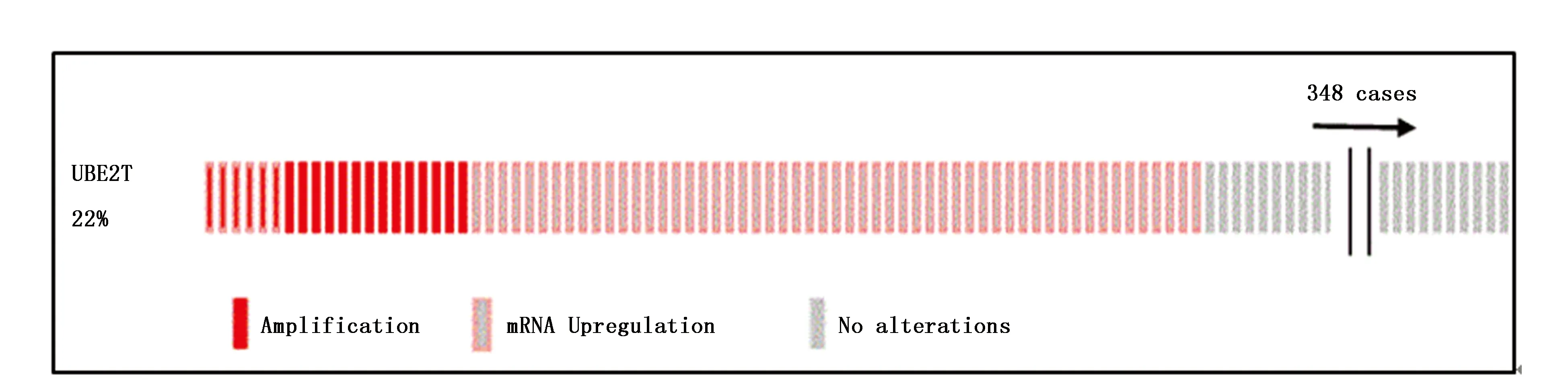
图1 UBE2T基因在肝癌组织中的改变Figure 1 The genomic alteration of UBE2T in HCC
2.2 UBE2T在肝癌组织及正常肝组织中的表达
对TCGA数据库中UBE2T在肝癌组织(n=371)和正常肝组织(n=50)表达水平进行分析,结果显示UBE2T在肝癌组织中表达水平明显高于正常肝组织,差异有统计学意义(P<0.001)(图2)。
2.3 肝癌组织UBE2T表达及其与临床病理学特征的关系
对UBE2T mRNA表达水平与肝癌患者的临床病理学特征进行分析后显示,UBE2T与年龄(P=0.192)、性别(P=0.195)、TNM分期(P=0.140)无关,但与种族(P=0.034)、Grade分级(P<0.01)、有无血管侵袭(P=0.029)有关(表1)。
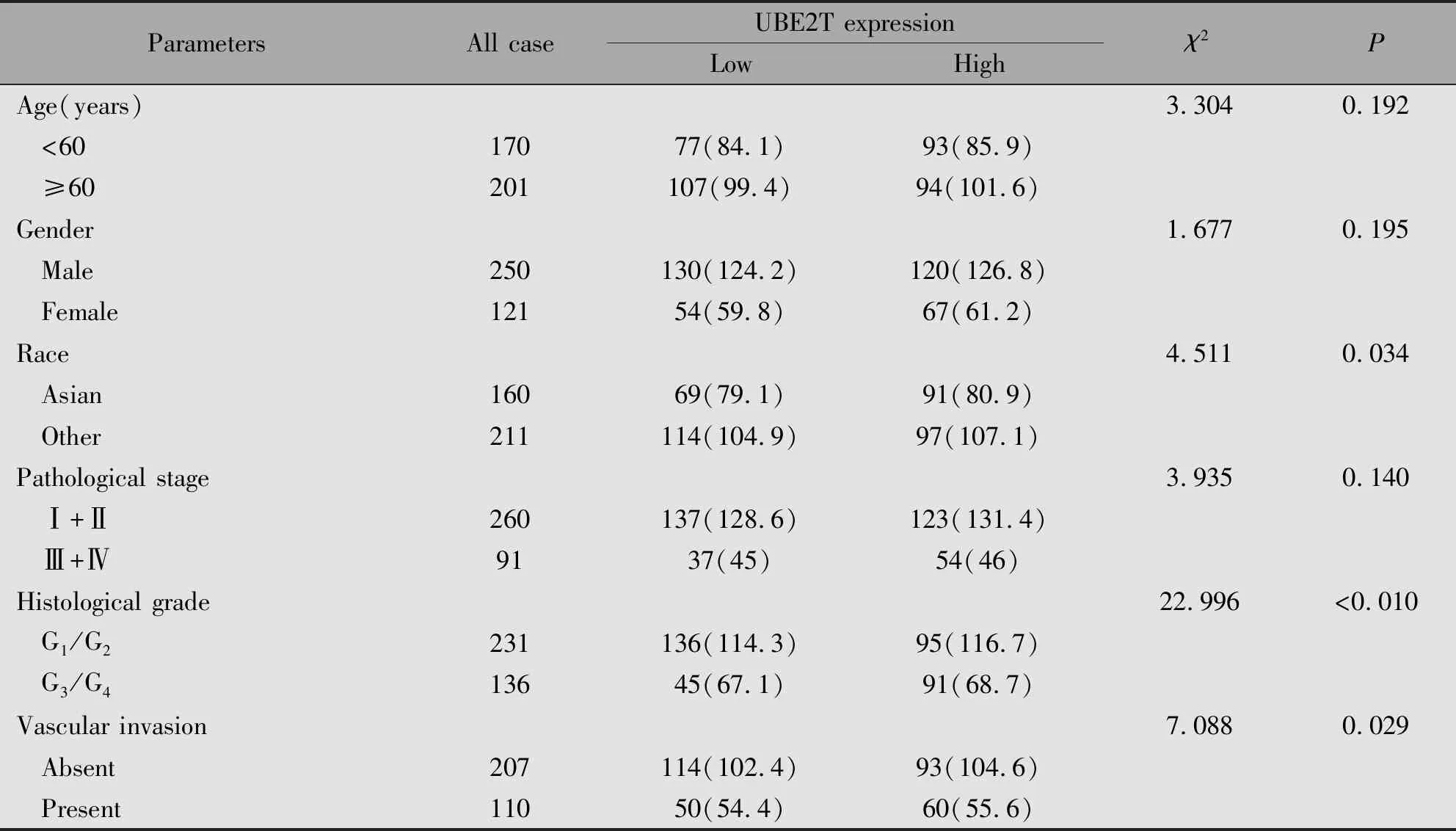
表1 UBE2T表达与肝癌患者临床病理参数之间的关系Table 1 Relationship between the expression of UBE2T and clinicopathological parameters of patients with liver cancer
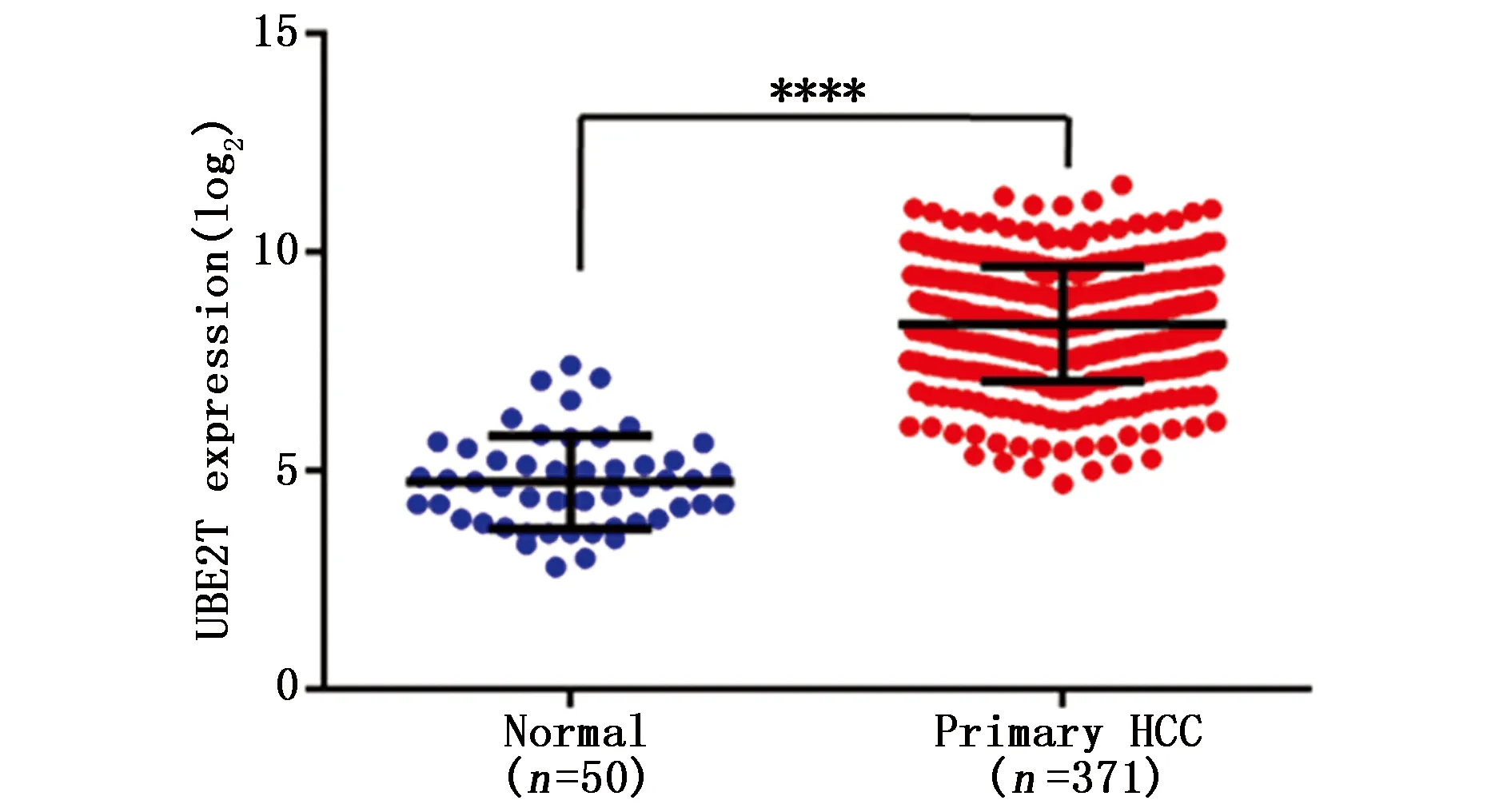
图2 肝癌组织和癌旁组织中UBE2TmRNA的表达Figure 2 The expression of UBE2T in liver cancer and adjacent non-tumor tissues
2.4 UBE2T表达与肝癌患者OS的关系
Kaplan-Meier分析结果提示UBE2T的表达与肝癌患者OS有关(P=0.006),与UBE2T低表达组相比,UBE2T高表达组患者的OS明显降低(图3A)。进一步利用Cox比例风险模型进行了单因素和多因素分析。单因素分析结果显示,UBE2T表达水平(P<0.01)、TNM分期(P<0.01)、血管侵袭(P<0.01)与肝癌患者OS显著相关;多因素分析进一步提示TNM分期(HR=1.63,95%CI:1.247~2.147,P=0.01)、血管侵袭(HR=1.33,95%CI:1.057~1.682,P=0.015)、UBE2T表达水平(HR=1.830,95%CI:1.273~2.641,P<0.01)是影响肝癌患者OS的独立危险因素(表2)。
2.5 UBE2T表达与肝癌患者DFS的关系
利用Kaplan-Meier法分析了UBE2T表达水平与肝癌患者DFS的关系,结果提示UBE2T高表达组的HCC患者DFS(P=0.005)明显差于低表达组(图3B)。单因素分析结果显示,UBE2T表达水平(P=0.013)、TNM分期(P<0.001)、血管侵袭(P<0.001)与肝癌患者DFS相关;多因分析进一步提示TNM分期(HR=1.985,95%CI:1.399~2.816,P<0.001)、血管侵袭(HR=1.721,95%CI:1.211~2.445,P=0.002)、UBE2T表达水平(HR=1.410,95%CI:1.044~1.905,P=0.025)是影响肝癌患者DFS的独立危险因素(表3)。
2.6 UBE2T高表达组的GSEA功能富集分析
将TCGA的表达矩阵按照UBE2T的表达量分为高表达、低表达两组进行GSEA分析,结果提示UBE2T高表达样本富集到细胞周期、DNA复制、DNA损伤碱基切除修复、RNA降解、前体RNA剪切、泛素介导蛋白水解等相关基因集(图4)。提示UBE2T表达上调可能通过影响细胞周期调控、干扰基因的损伤修复及蛋白泛素化来参与肿瘤的发生和发展。
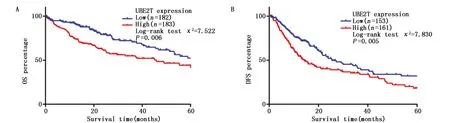
图3 UBE2T表达与肝癌患者OS和DFS曲线Figure 3 The OS and DFS curves of UBE2T expression in patients with HCC

表2 HCC患者OS影响因素的Cox回归分析Table 2 Cox regression analysis of factors affecting OS in HCC patients

表3 HCC患者DFS影响因素的Cox回归分析Table 3 Cox regression analysis of factors affecting DFS in HCC patients
3 讨论
肝癌是最常见的恶性肿瘤之一,大多数患者被诊断时已处于中晚期,因而错失最佳治疗的时机,故绝大多数患者预后极差[9]。鉴于目前的诊疗现状,亟需寻找新的分子靶标用于肝癌的早期诊断、预后判断和靶向治疗药物的开发,以期更为积极有效的改善肝癌患者的不良预后。本研究基于TCGA数据库371例肝癌组织和50例正常肝组织样本信息,研究了UBE2T表达与肝癌患者的临床病理学特征及预后相关性。结果表明,UBE2T在肝癌组织中表达显著上调,其表达水平与肝癌患者的种族、Grade分级、血管侵袭等显著相关。后续分析表明UBE2T表达水平、TNM分期、血管侵袭可显著影响肝癌患者的预后,且UBE2T高表达组的肝癌患者预后明显较低表达组患者预后差。由此推测,UBE2T表达上调可作为肝癌患者预后不良的独立危险因素,有望成为潜在的判断肿瘤患者预后的标志和肿瘤治疗的靶标。
UBE2T是泛素结合酶E2家族成员之一,其具有一个大小约16~18 kDa特征性的保守结构域-泛素结合(UBC)结构域,最先发现于FA的相关研究中。UBE2T可作为范可尼信号通路(FA pathway)重要成员参与DNA损伤修复。DNA损伤通过激活范可尼通路,诱导泛素激活酶E1将泛素分子传递给UBE2T,UBE2T将泛素分子传递给该通路中的核心复合体,后者再将泛素分子传递给范可尼贫血互补基因群(Fanconi anemia group D2 protein,FANCD2),导致FANCD2单泛素化,单泛素化的FANCD2向细胞核DNA损伤点聚集,促进DNA损伤分子的修复,进而维持基因组的完整性。作为该通路的重要组成部分,UBE2T的表达异常会导致基因组稳定性下降,诱发范可尼贫血或肿瘤易感倾向。本文通过富集分析发现,UBE2T高表达主要富集在细胞周期、DNA复制、DNA损伤碱基切除修复、RNA降解、前体RNA剪切、泛素介导蛋白水解等相关基因集。提示UBE2T表达上调可以通过干扰基因的损伤修复及蛋白泛素化来促进肿瘤的发生。
诸多文献报道UBE2T在鼻咽癌、乳腺癌、胃癌、前列腺癌、膀胱癌等肿瘤中异常表达。研究发现UBE2T参与了多种肿瘤的发生、发展进程。Hu等[10]研究发现UBE2T可以通过AKT/GSK3β/β-catenin通路促进鼻咽癌细胞增殖、侵袭和转移。Ueki等[11]研究发现UBE2T可通过抑制抑癌基因BRCA1的表达而发挥其癌基因的作用。上皮间质转化(Epithelial-mesenchymal transition,EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。已有诸多文献报道EMT与多种肿瘤的侵袭、转移密切相关[12-13]。EMT使上皮细胞的细胞极性消失,失去与基底膜的连接,明显增强细胞的侵袭和转移能力。EMT在分子水平上主要表现为上皮细胞标志物上皮型钙黏附蛋白(E-Cadherin)、β-连环蛋白(β-Catenin)等的表达下调和间质细胞标志物纤粘蛋白(Fibronectin)、波形蛋白(Vimentin)等的表达上调[14]。Luo等[15]报道UBE2T可以通过调控EMT相关因子如E-Cadherin、β-Catenin、Fibronectin、Vimentin的表达而促进胃癌细胞的侵袭和转移。同样,也有研究发现过表达的UBE2T亦可作用于Vimentin介导前列腺癌细胞的增殖、转移和EMT过程[16]。关于UBE2T是否可以同样的机制促进肝癌的发生和发展,曹传辉等[17]通过免疫印迹方法检测UBE2T过表达和RNAi干扰后肝癌细胞EMT相关蛋白表达变化,证明UBE2T可通过EMT促进肝癌细胞的的侵袭和转移能力。亦有研究[16]通过UBE2T基因过表达和敲除技术,证实了UBE2T高表达可显著促进肝癌细胞的侵袭和转移。不仅如此,Liu等[18]研究发现UBE2T还可通过泛素化P53抑制其表达而促进肝癌细胞的增殖。由此可鉴,UBE2T与肝癌的发生、发展密切相关。综上,UBE2T极有潜力作为临床肝癌早期诊断、预后判断及治疗的新靶点。
本研究利用生物信息学原理分析了UBE2T在肝癌患者中的表达差异及其与肝癌患者预后的相关性,为进一步研究UBE2T在肝癌中的基础和临床研究提供线索和依据。但仍需进一步实验研究其在肝癌中的具体作用机制,以期为肝癌的临床诊断和治疗提供新方向。

