Chk1在胶质母细胞瘤中的表达及其与肿瘤生物学行为和预后生存的关联性
白晓斌 霍龙伟 谢万福 徐高峰 王茂德
胶质母细胞瘤(Glioblastoma,GBM)是一种恶性原发性脑肿瘤,早期接受手术联合规范放、化疗的情况下仍会在短期内复发,复发肿瘤往往恶性程度更高且再次放化疗效果甚微,中位生存期仅为12~15个月[1-2]。细胞周期检查点(Checkpoint)是一类细胞周期中保证染色体分配质量和DNA正确复制的负反馈检查机制[3]。细胞周期检测点激酶1(Checkpoint kinase 1,Chk1)是一类协调DNA合成以及调节细胞周期正常进程的重要效应分子[4],研究证实Chk1过量表达与肺癌、乳腺癌、卵巢癌、前列腺癌等多种恶性肿瘤的发生、复发以及治疗耐受高度相关[4-9],但是其在GBM中的表达及其与生物学行为和预后生存相关性尚不明确。
1 材料与方法
1.1 实验材料
DMEM-F12培养基和胎牛血清购自Gibco公司;聚丙烯酰胺凝胶购自Life Technology公司;HRP标记山羊抗兔和山羊抗鼠IgG二抗、Tris-MOPS SDS电泳缓冲液和Western blot转膜所用的Transfer Buffer购自Thermo Fisher公司;抗Chk1抗体购自LifeSpan公司;抗β-actin抗体购自Abcam公司;siCHEK1慢病毒购自ABM公司。
1.2 资料收集整理
蛋白激酶基因差异表达结果通过TCGA数据库利用Bioconductor/TCGA biolink下载,利用Rembrandt数据库(http://www.betastasis.com/glioma/rembrandt/)分析验证GBM和正常脑组织以及其它类型胶质瘤中蛋白激酶Chk1基因表达差异,并通过Rembrandt数据库利用Kaplan-Meier生存分析研究高低表达Chk1与临床预后的关系。
研究同时纳入西安交通大学第一附属医院神经外科40例经过手术病理切除GBM患者,男性24例,女性16例;年龄24~71岁,平均(58.62±8.25)岁;病变部位包括丘脑、岛叶、顶叶、颞叶和额叶;GBM患者存在不同程度头痛、恶心、肢体活动和言语障碍。GBM患者信息获取以及发表经过患者本人或家属同意。
1.3 细胞培养
GBM细胞系(U87,U251,SHG-44)购自上海富衡生物科技有限公司,GBM细胞使用含有10% FBS的DMEM-F12培养基培养,培养基至多每7~10天更换一次,加入Accutase酶在37℃,5% CO2条件下消化5 min至细胞脱壁后转移至离心管内,加入等体积培养基终止消化反应,800 rpm离心5 min,弃上清后加入5 mL PBS洗去残余培养基,再行800 rpm离心5 min,注入5 mL新鲜DMEM-F12培养基重悬,采用全自动细胞计数仪进行细胞计数后转移至培养瓶内,于37℃,5% CO2条件下继续培养。
1.4 体外细胞增殖实验
GBM细胞系U87细胞传代至第三代时进行细胞计数,并将细胞(1×104个/ mL )接种至96孔板内,每孔接种1 mL,加入20 μL细胞增殖检测试剂(Alarma blue),一次测量6个复孔,轻轻晃动摇匀之后在37℃,5% CO2条件下孵育8 h,利用荧光分光光度计测量在530 nm和590 nm波长处的吸光度值。体外细胞增殖实验应分别在接种后0 d、2 d、4 d、6 d和8 d分别进行,根据检测所得结果绘制细胞体外增殖曲线。
1.5 Western blot检测
分别收集GBM细胞系(U87,U251,SHG-44)和正常人星型胶质细胞系(NHA),在4℃条件下,经过RIPA蛋白裂解液裂解30 min后,收集总蛋白,经过考马斯亮蓝法对总蛋白进行定量后。利用分离胶(8%)以及浓缩胶(5%)对30 μg蛋白样品进行SDS-PAGE电泳。转模和蛋白封闭后,在4℃下孵育抗β-actin抗体过夜,洗膜处理后进行二抗孵育,接着进行显影和成像,利用Image J软件后进行蛋白分析。
1.6 体外细胞成球试验
GBM细胞系U87细胞传代至第三代时进行细胞计数,并将单细胞悬液稀释至1×102个/mL细胞浓度,依次按照0、1、10、20、40、50细胞/孔接种至96孔板内,每个浓度设置10个复孔轻晃混匀后在37℃,5% CO2培养箱中孵育。统计各浓度复孔中无细胞球形成的孔数并计算其比率,利用Prism 6.0进行线性回归分析。
1.7 实时定量荧光PCR(Real-time PCR)
Real-time PCR的详细步骤参考已发表的相关论文[10]。GAPDH作为内参基因,实验所用的引物序列如下:Chk1-Forward:ATATGAAGCGTGCCGTAGACT,Chk1-Reverse:TGCCTATGTCTGGCTCTATTCTG,GAPDH-Forward:GAAGGTGAAGGTCGGAGTCA,GAPDH-Reverse:TTGAGGTCAATGAAGGGGTC。
1.8 免疫组化染色
根据试剂盒说明书采用辣根过氧化物酶法检测Chk1,详细步骤参考已发表的相关论文[10]。染色结果由2名以上的研究员分别进行观察统计,染色结果按照德国免疫组化评分标准(German immunohistochemical score,GIS)进行评估。具体评分标准为:阳性细胞比率评分:0分(无阳性细胞),1分(阳性细胞比率<10%),2分(11%<阳性细胞比率<50%),3分(51%<阳性细胞比率<80%),4分(阳性细胞比率>80%);染色强度评分:0分(无染色),1分(弱染色),2分(中度染色),3分(强染色);GIS评分结果为阳性细胞比率评分×染色强度评分。目的蛋白表达量的评判标准为:GIS评分<5分:低表达;5分≤GIS评分≤8分:中度表达;GIS评分>8分:高表达。
1.9 慢病毒转染
GBM细胞系U87细胞传代至第三代时进行细胞计数,并4×105个/mL接种1 mL至预先用层粘连蛋白处理过的无菌六孔板中,37℃,5% CO2条件下孵育6 h待细胞完全贴壁;将购得的siChk1慢病毒在冰上溶化后,在3 mL培养基中加入3 μL聚凝胺和20 μL慢病毒,混合充分后加入6孔板中;转染12 h后在荧光显微镜下观察GFP表达评估转染效率,如转染效率满意,移除含有慢病毒的培养基后注入3 mL Accutase消化液消化细胞后,加入3 mL培养基终止反应,室温下800 r/min离心5 min;移除上清液后加入5 mL新鲜培养基,轻柔吹打后将细胞悬液接种至无菌培养瓶中,37℃,5% CO2条件下继续培养。转染通过Real-time PCR及Western blot进行验证。
1.10 统计学分析

2 结果
2.1 Chk1在GBM组织和细胞中的表达
通过对TCGA数据库中668个蛋白激酶编码基因的表达进行分析[11],结果发现同正常脑组织相比,Chk1是在GBM中表达上调最为显著的蛋白激酶编码基因之一(图1)。同时,对Rembrandt数据库的分析结果显示Chk1在GBM中的表达显著高于正常脑组织及其他类型胶质瘤(图2)。为了进一步研究Chk1在GBM细胞中的表达情况,本研究利用Realtime PCR和Western blot对3株GBM细胞系(U87,U251,SHG-44)和1株正常人星形胶质细胞(NHA)中Chk1的表达进行测定,结果显示GBM细胞中Chk1的mRNA和蛋白水平均显著上调(图3,图4)。

图2 Chk1在GBM组织中的表达高于正常脑组织及其他类型胶质瘤组织Figure 2 Chk1 gene was highly expressed in GBM in comparison with normal brain tissues and other subtypes of glioma cells.Note:** P<0.01,*** P<0.001,ns P>0.05.

图1 Chk1在GBM组织中高表达Figure 1 Chk1 gen was highly expressed in GBM tissues

图3 Real-time PCR结果显示Chk1在GBM细胞(U87,U251,SHG-44)中高表达Figure 3 Chk1 at mRNA level was highly expressed in GBM U87,U251 and SHG-44 cellsNote:** P<0.01,*** P<0.001.

图4 Western blot结果显示Chk1在GBM细胞(U87,U251,SHG-44)中高表达Figure 4 Chk1 protein was highly expressed in GBM U87,U251 and SHG-44 cells

图5 Real-time PCR结果显示siChk1转染U87细胞中Chk1表达下调Figure 5 Real-time PCR analysis indicated Chk1 was decreased after siChk1 transfection in U87 cellsNote:**P<0.01.
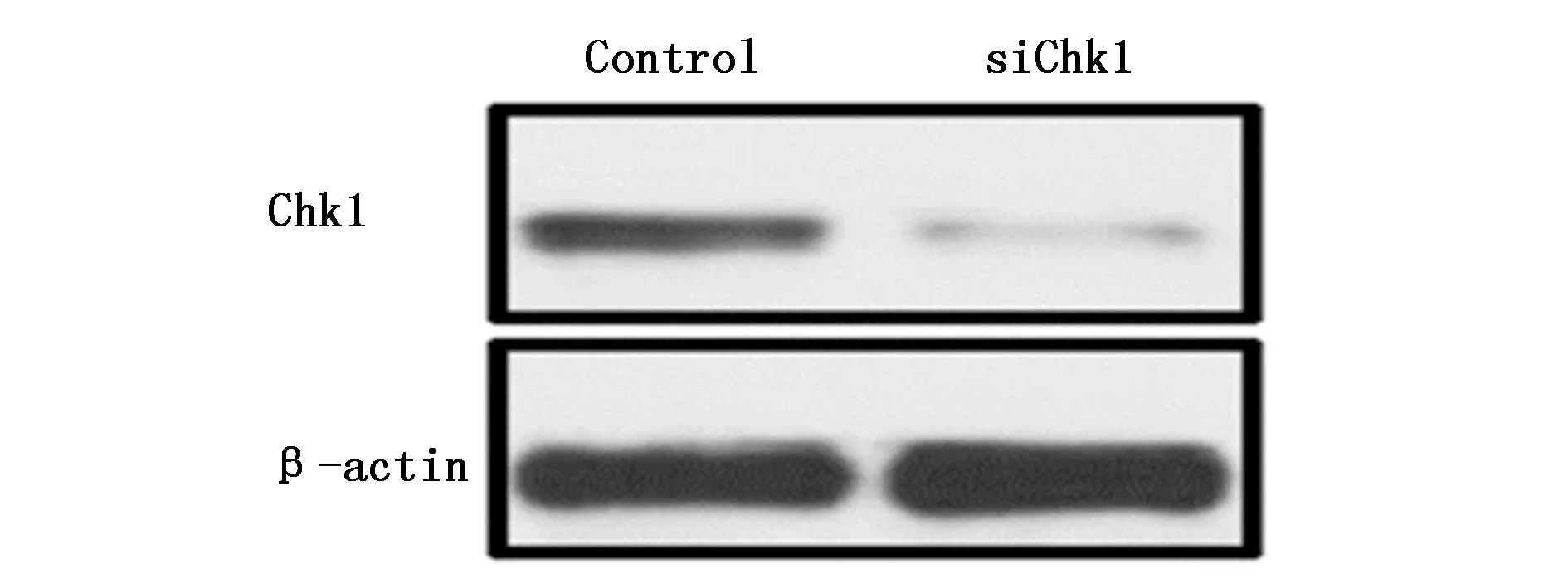
图6 Western blot结果显示siChk1转染U87细胞中Chk1表达下调Figure 6 Western blot analysis indicated Chk1 was decreased after siChk1 transfection in U87 cells
2.2 Chk1能够促进GBM细胞的体外增殖和成球能力
为了进一步说明Chk1对GBM细胞生物学行为的影响,本研究通过慢病毒转染技术特异性沉默GBM细胞中Chk1表达,Real-time PCR和Western blot结果显示:沉默后GBM细胞与对照细胞相比,Chk1表达显著下降(图5,图6)。同对照组相比,沉默Chk1表达后GBM细胞的增殖能力(P<0.01)和体外成球能力(P<0.05)显著受到抑制,表明Chk1对GBM细胞的增殖和成球能力具有促进作用(图7,图8)。

图7 体外增殖实验显示siChk1 U87细胞的增殖能力显著受到抑制Figure 7 Chk1 knock-down reduced cell proliferation of U87 cellsNote:**P<0.01,compared with the control.

图8 体外成球实验显示siChk1 U87细胞的成球能力显著受到抑制Figure 8 Chk1 knock-down reduced colony-formation in U87 cellsNote:*P<0.05,compared with the control.
2.3 Chk1高表达与GBM患者不良预后相关
收集自2010—2016年期间就诊于我院的GBM患者病理组织切片共40例,利用免疫组化染色对Chk1的表达进行分析(图9),并对Chk1的表达和患者预后生存相关性进行研究,结果表明Chk1低表达组GBM患者的临床预后显著优于高表达组患者(图10)。与此相似,对Rembrandt数据库中537例GBM患者的预后和Chk1表达进行分析,结果显示Chk1高表达同GBM患者的不良预后高度相关(图11),提示Chk1可能作为预测GBM患者预后的分子标志物,具有一定的临床应用前景。

图9 利用免疫组化染色分析GBM肿瘤中Chk1的表达Figure 9 The expression of Chk1 protein in GBM tissues by immunohistochemistry

图10 Chk1高表达同GBM患者的不良预后高度相关Figure 10 The expression of Chk1 was correlated to poor prognosis in GBM patients

图11 Rembrandt数据库分析结果显示Chk1高表达同GBM患者的不良预后高度相关Figure 11 The expression of Chk1 was correlated to poor prognosis in GBM patients from Rembrandt database
3 讨论
GBM是一类复发率高和预后较差的严重神经系统肿瘤,其5年生存率低于5%[12-13]。蛋白激酶因其参与细胞生物学行为调控以及基因修复等重要生命活动而得到广泛关注[14]。Chk1是一种含有200个氨基酸的复合物,通过磷酸化活化激活ATM/R激酶[15]。Chk1同多种肿瘤的发生和复发有关,其重要生物学功能之一是通过诱导DNA修复进而使细胞获得对放疗及某些化疗药物的耐受性[8]。Matsumoto等[16]通过临床研究检测发现嘧啶类似物吉西他滨能够激活原发性肝癌和胆管癌中Chk1活性并且能激活细胞外信号调节激酶(ERK)1/2,增加肿瘤细胞的DNA修复并减少其凋亡,进而增强其对吉西他滨的耐受性。另有研究通过免疫组化测定Chk1在子宫颈癌和慢性子宫颈炎患者中的阳性率,发现子宫颈癌的阳性表达显著上升[5,9]。除此之外,在生殖系统肿瘤包括女性卵巢癌和男性前列腺癌中,Chk1信号分子被激活,表达显著增高,参与肿瘤细胞生物学行为的改变[17]。虽然Chk1被证实同多种肿瘤的发生相关并通过多种分子生物学机制参与调控肿瘤细胞的生物学行为,但是Chk1在胶质瘤尤其是胶质母细胞瘤中的作用仍不明确。本研究通过TCGA数据库和脑肿瘤分子数据库(Rembrandt)选择和分析GBM中Chk1的表达并采用Western blot和Real-time PCR等分子生物学技术检测GBM细胞中Chk1的表达水平,同时利用慢病毒转染siRNA沉默Chk1的表达以探究其对于GBM细胞增殖能力的作用;同时利用免疫组化染色及Rembrandt数据库对Chk1同GBM患者的预后生存进行分析,结果表明Chk1在GBM中高表达,而特异性沉默Chk1能够显著抑制GBM细胞的生长和成球能力;同时,Chk1低表达组GBM患者的临床预后显著优于高表达组患者,证实了Chk1表达上调能够促进GBM细胞的生长和增殖,并和GBM患者的不良预后相关,提示Chk1可能作为GBM临床治疗和药物研发新的潜在靶点,为GBM治疗提供了新想法。
Chk1促进肿瘤生长的机制主要是调控ATR-Chk1信号转导通路,从而启动细胞损伤修复程序,能够显著提高肿瘤细胞化学治疗的耐受性[18]。Lam等[19]通过文献复习指明Chk1在调控细胞生长和维持细胞周期和基因信息稳定性方面具有重要意义。Kohn等[20]通过反复验证发现,Chk1在p53突变的人乳腺癌MDA-MB-231细胞周期调控中起关键作用,Chk1抑制剂UCN-01能够恢复细胞周期异常。尽管我们的研究发现Chk1对于GBM细胞的生长具有重要的调控作用,但其分子生物学机制尤其是下游信号转导通路仍需进一步深入的研究。值得注意的是,Levesque等[21]证实Chk1不仅在肿瘤细胞的生长、增殖过程中发挥重要作用,而且抑制Chk1能够影响正常细胞的生物学行为,因此抗Chk1靶点药物抗肿瘤效果还存在一定争议。因此,Chk1表达与GBM生物学行为和临床预后相关性尚需要进一步的探索和研究。

