PEAR1基因多态性对冠心病患者阿司匹林抗血小板作用的影响与相关性分析
鲁燕,徐炳欣,郭明拴
冠状动脉硬化性心脏病(CHD,冠心病)。近年来,我国CHD患者逐年增多,根据全球急性冠状动脉(冠脉)事件注册研究数据表明[1]:CHD患者在出院后6个月内死亡、卒中和再住院率高达25%,4年累积病死率高达22.6%,而且死亡患者中有50%死于再发心肌梗死。抗血小板聚集是目前临床治疗CHD的主要方法,而阿司匹林是经典的抗血小板药物[2],在临床上部分冠心病患者虽然按照专业指南或者经验规律服用阿司匹林,但却达不到预期抑制血小板聚集的作用,患者若发生阿司匹林抵抗则会大大增加缺血性心血管不良事件的发生风险,阿司匹林抵抗问题越来越引起临床的重视[3,4]。如何根据患者的实际情况优化抗血小板聚集治疗方案、尽量减少缺血性不良事件发生,已成为当前抗血小板聚集治疗研究领域的新热点。目前已有多项研究对阿司匹林抵抗的发生机制进行了探究,其中PEAR-1基因因素可能在阿司匹林抵抗中具有重要作用。血小板内皮聚集受体1(PEAR-1)是一种血小板跨膜蛋白,其主要在血小板和内皮细胞表达,其可促进血小板的黏附和聚集,具有参与血栓形成、维持血小板聚集稳态的作用[5]。PEAR-1基因位于1q23.1,其包括22个内含子和23个外显子,PEAR-1基因的多态性可以影响血小板对各种生理激动剂等物质的反应性[6]。本研究旨在分析冠心病患者的PEAR-1基因多态性对基本治疗药物阿司匹林抵抗作用的影响,以指导冠心病患者及早采取有效措施,减少阿司匹林抵抗的发生率,提高冠心病的临床治疗疗效。
1 资料与方法
1.1 研究对象选取2016年4月至2018年4月于许昌市中心医院心内科确诊并收治的364例冠心病患者为研究对象。患者的诊断均符合《冠心病诊断与治疗方法指南解读(2015年版)》[7]的相关标准。纳入标准:①入院前未接受过阿司匹林治疗的;②无阿司匹林用药禁忌的。排除标准:①有先天性心脏病的患者;②合并脑、肝、肾等重大脏器功能损伤的患者;③伴有免疫缺陷综合征或恶性肿瘤的患者;④具有嗜烟嗜酒习惯的患者。所有患者均签署知情同意书,该实验获本院伦理委员会批准。根据患者PEAR1基因多态性检测结果,将患者分为野生型(GG组,n=118例)、突变杂合型(GA组,n=124例)和突变纯合型(AA组,n=122例)。
1.2 方法所有患者在确诊后给予阿司匹林(100 mg×30片,拜耳医药保健有限公司,国药准字J20130078,生产批号:BJ39455、BJ39456)进行治疗,口服,1/d,0.3 g/d,持续治疗30 d。检测三组患者治疗前后血小板聚集率、血小板抑制率、血清环氧化酶(COX)-1、COX-2、血栓素A2(TXA2)和前列腺素(PGs)的水平。
1.3 观察指标①PEAR1基因型频率[8]。按照单核苷酸多态性(SNP)方法对患者基因频率进行分析,采集患者禁食12 h的空腹外周血3 ml置于乙二胺四乙酸(EDTA)抗凝管中,采用荧光染色原位杂交检测法。基因型频率=基因型例数/总例数×100%;②血小板聚集率及抑制率。抽取患者治疗前后禁食12 h的空腹外周血3 ml置于柠檬酸钠抗凝管中,采用血栓弹力图仪(美国Haemonetics,型号5000 Thrombelastograph Hemostasis Analyzer System)分别检测由二磷酸腺苷诱导的血小板聚集率和花生四烯酸诱导的血小板抑制率。血小板聚集率越低,抗凝作用越好。血小板抑制率≥70%即为阿司匹林敏感,血小板抑制率≤50%即为阿司匹林抵抗[9]。③COX-1、COX-2、TXA-2和PGs水平。抽取患者治疗前后禁食12 h的空腹外周血5 ml,4℃低温离心后分离血清样本,置于-80℃保存。样本收集后采用酶联免疫吸附(ELISA)试剂盒(瑞士Roche)检测COX-1、COX-2、TXA-2和PGs水平。
1.4 统计学分析本研究数据均采用SPSS 19.0软件进行录入和分析,计量资料采用均数±标准差的形式表示,三组间比较采用单因素方差分析,组内比较采用LSD-t检验,治疗前后比较采用配对资料t检验;计数资料采用例数(百分比)表示,三组间比较采用卡方检验,两两比较采用分割法。以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者基线资料及PEAR1基因多态性分布根据患者PEAR1基因多态性检测结果,将患者分为野生型(GG组,n=118例)、突变杂合型(GA组,n=124例)和突变纯合型(AA组,n=122例)。三组患者基本资料比较,差异均无统计学意义(P>0.05),表1。
2.2 三组患者血小板聚集率、抑制率比较三组治疗前血小板聚集率和抑制率比较,差异均无统计学意义(P>0.05)。给予阿司匹林治疗后,与治疗前相比,三组血小板抑制率均显著增高(P<0.05),GG组与GA组的血小板聚集率均显著低于治疗前(P<0.05)。组间比较,治疗后GG组和GA组血小板聚集率均显著低于AA组(P<0.05),GG组和GA组血小板抑制率均显著高于AA组(P<0.05),表2。
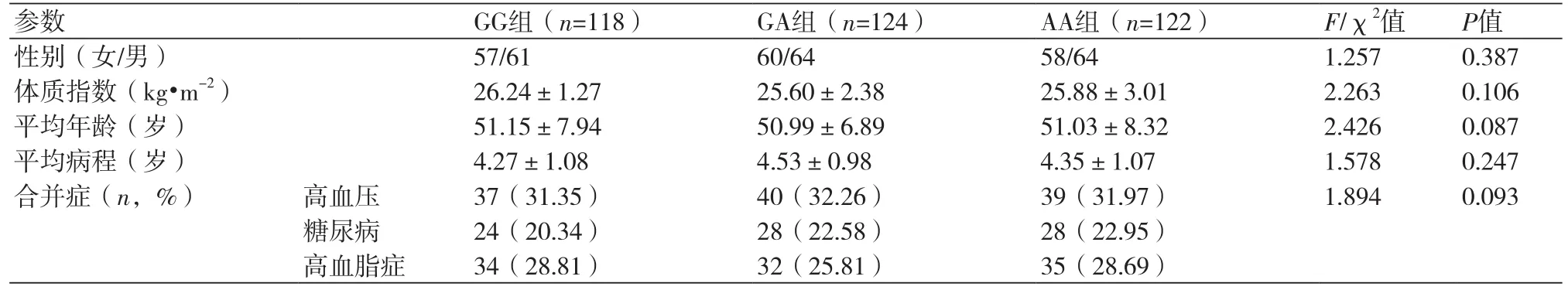
表1 三组患者基线资料及PEAR1基因多态性分布比较
2.3 三组患者血清COX-1、COX-2、TXA-2和PGs水平比较三组患者治疗前血清COX-1、COX-2、TXA-2和PGs水平经比较,差异均无统计学意义(P>0.05);经阿司匹林治疗后,GG组和GA组血清COX-1、COX-2、TXA-2和PGs水平均显著低于治疗前(P<0.05)。组间比较,治疗后GG组和GA组血清COX-1、COX-2、TXA-2和PGs水平均显著低于AA组(P<0.05)。
3 讨论
阿司匹林是临床上治疗冠心病的常规治疗用药,其主要是通过抑制COX的活性从而阻碍花生四烯酸转化为TXA-2和PGs,进而发挥抗血小板的作用[10,11]。大量临床研究发现[12-14],阿司匹林在治疗冠心病的过程中,常出现抗血小板作用失败的病例,主要表现为较高的血小板聚集率或较低的血小板抑制率,临床治疗效果很差。患者若发生阿司匹林抵抗则会大大增加缺血性心血管不良事件的发生风险。近年来,随着冠心病介入治疗及新型抗血小板药物研究的不断发展,阿司匹林抵抗问题越来越引起临床的重视,如何通过简便易行的实验检测手段,将阿司匹林药物代谢酶的基因类型应用于优化冠心病患者抗血小板聚集治疗中,尽早采取措施有效地减少阿司匹林抵抗引发的缺血性心血管不良事件,从而使冠心病的抗血小板聚集治疗更加安全、有效[15,16]。本研究旨在观察PEAR1基因多态性与临床阿司匹林抵抗之间的关系,据此优化冠心病患者抗血小板聚集治疗,减少阿司匹林抵抗所致的缺血性心血管不良事件发生。
PEAR1基因是一种参与血小板活化和血小板聚集的一种膜蛋白。本研究结果表明,PEAR1基因的GG、GA和AA分型与患者的年龄、性别、体脂、合并症等基本资料情况无相关性。给予阿司匹林治疗后,PEAR1基因的GG、GA和AA组三组血小板抑制率均显著高于治疗前(P<0.05),GG组与GA组的血小板聚集率均显著低于治疗前(P<0.05)。组间比较,治疗后GG组和GA组血小板聚集率均显著低于AA组(P<0.05),GG组和GA组血小板抑制率均显著高于AA组(P<0.05),说明PEAR1基因可以影响冠心病患者血小板的活化和聚集反应,AA基因型的患者存在严重的阿司匹林抵抗情况。与GG纯合子相比,携带A等位基因的变异可能与血小板功能的变异有关,可增加患者的不良心血管事件的发生率和死亡率[17]。COX主要分为COX-1和COX-2两类,COX-1在生理状态下可催化花生四烯酸转化为TXA-2,促进血小板聚集,诱导血栓形成,而COX-2可在炎症刺激下可催化花生四烯酸转化为PGs,从而调节血管张力,使得冠状动脉狭窄,因此,血清COX-1、COX-2、TXA-2和PGs水平在冠心病的发病过程中起着重要作用。经阿司匹林治疗后,GG组和GA组血清COX-1、COX-2、TXA-2和PGs水平均显著低于治疗前(P<0.05)。组间比较,治疗后GG组和GA组血清COX-1、COX-2、TXA-2和PGs水平均显著低于AA组(P<0.05),说明阿司匹林对野生型GG和GA组血清COX-1、COX-2、TXA-2和PGs水平的下调作用最显著,对纯合突变AA组的作用最差。
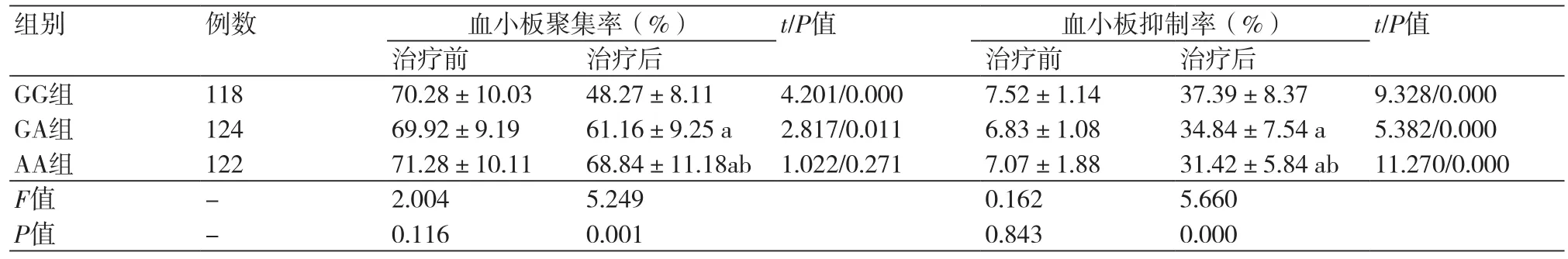
表2 三组患者血小板聚集指标比较(x±s)

表3 三组血清COX-1、COX-2、TXA-2和PGs水平比较表(x±s)
综上所述,阿司匹林治疗不同PEAR1基因型的冠心病患者,PEAR1基因GG型对阿司匹林的应答性最好,PEAR1基因AA型对阿司匹林存在严重抵抗。对于PEAR1突变基因型尤其是突变纯合型存在阿司匹林抵抗患者,值得进一步做深入研究。

