代谢工程改造酿酒酵母生产L-苹果酸
陈修来 ,王元彩 ,董晓翔 ,罗秋玲 ,刘 佳 ,刘立明 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
L-苹果酸作为生物体TCA循环的重要中间体,在食品、化工、医药等领域具有广泛的应用[1]。早期关于L-苹果酸的研究主要集中于高产菌株的筛选和培养条件的优化[1-2]。通过优化发酵条件,如:转速、溶氧、氮源浓度、金属离子及CaCO3添加量等,使得黄曲霉(Aspergillus flavus)在 190 h时能够积累113 g/L的L-苹果酸,生产强度达到0.59 g/L/h[1]。由于高产L-苹果酸的野生型菌株为霉菌[3],具有发酵周期长、条件难以控制、产生黄曲霉毒素等缺点,使其不能被广泛的应用[4]。因此,近年来的研究主要集中于代谢工程策略改造常见工业微生物生产L-苹果酸,如:酿酒酵母(Saccharomyces cerevisiae)[5]、光滑球拟酵母 (Torulopsis glabrata)[6]和大肠杆菌(Escherichia coli)[7-8]等。 由于S.cerevisiae较其他微生物,具有以下优点:(1)良好的食品安全性,S.cerevisiae已广泛应用于食品、医药等领域;(2)低pH耐受性,有利于高效积累有机酸、降低下游提取纯化成本;(3)高葡萄糖耐受性,为实现高密度发酵奠定基础。因此,S.cerevisiae被认为是二羧酸生产的潜在高效细胞工厂[9]。
目前,S.cerevisiae生产L-苹果酸的代谢策略主要有:1)L-苹果酸积累路径的构建:以丙酮酸为起点在丙酮酸羧化酶 (PYC)及苹果酸脱氢酶(MDH)的作用下积累L-苹果酸,即胞质还原路径,因该路径简单且理论得率高,而被广泛应用于二羧酸的生产[7-10]。通过在丙酮酸高产菌株S.cerevisiaeTAM中过量表达基因PYC2和MDH△SKL构建L-苹果酸积累的胞质还原路径,使得L-苹果酸产量提高了3倍[11];2)转运系统的强化:研究表明L-苹果酸的外转运是限制L-苹果酸积累的关键性因素[6,12]。在构建完成L-苹果酸路径的基础上,过量表达源于栗酒裂殖酵母 (Schizosaccharomyces pombe)的C4-二羧酸转运蛋白,使得L-苹果酸产量提升到了31.5 g/L[5];3)启动子表达水平的改造:Pines等[13]利用不同表达强度的启动子,对基因MDH2进行过量表达,有效的提高了MDH的酶活,最终使得L-苹果酸产量达到11.8 g/L。
本研究以高产丙酮酸的S.cerevisiaetTAM为出发菌株,利用分子生物学手段将高产L-苹果酸A.flavus代谢路径表达于S.cerevisiae中,构建Afpyc单表达,Afpyc、Afmdh双基因共表达和Afpyc、Afmdh、Afmae三基因共表达的工程菌株,通过分析基因表达对碳流分布的影响,探讨A.flavus胞质还原路径对S.cerevisiae积累L-苹果酸的影响,为利用代谢工程策略生产L-苹果酸提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒S.cerevisiaeTAM由荷兰代尔夫特理工大学Jack T.Pronk教授赠送。pY26和pY14购自Turbo生物工程有限公司。pMD19-T-simple购自TaKaRa(大连)生物工程有限公司。表1为本研究所用的菌株和质粒。
1.1.2 主要仪器和试剂紫外可见分光光度计(日本岛津公司,型号UV2450);SBA生物传感仪(山东科学院生物研究所);高效液相色谱仪(美国赛默尔飞,型号Ultimate 3000)。丙酮酸和L-苹果酸标准品购自sigma公司,其他试剂均为国产分析纯试剂。
1.1.3 引物本研究所用引物如表2所示,引物GMC-SacI-S、GMC-NotI-A为扩增GPD启动子、多 克 隆 位 点 、CYC1 引 物 ;18SrDNA-BglII-S、18SrDNA-SphI-A为扩增18S rDNA引物;rDNAtrp-SacINotI-S、rDNAtrp-NcoI-A 为扩增Trp引物。Afpyc-BamH I-S和Afpyc-PstI-A用于扩增基因Afpyc;Afmdh-NotI-S和Afmdh-BglII-A用于扩增基因Afmdh;Afmae-EcoR I-S和Afmae-XhoI-A用于扩增基因Afmae。
1.1.4 培养基LB培养基(g/L):氯化钠 10,酵母膏5,蛋白胨 10。YNB培养基 (g/L):葡萄糖20,YNB 6.7,根据需要添加20 mg/L的氨基酸。种子培养基(g/L):葡萄糖 20,YNB 6.7,碳酸钙 5。发酵培养基 (g/L): 葡萄糖 80,K2SO46.6,KH2PO43,MgSO4·7H2O 0.5,尿素终浓度1,生物素终浓度为10-3,CaCl2·2H2O终浓度为0.735,碳酸钙 25(接种时添加5 g/L,发酵48 h时添加20 g/L),微量金属离子液、维生素液均为1 mL/L。微量金属离子液(mg/L):EDTA 15,ZnSO4·7H2O 4.5,CoCl2·6H2O 0.3,MnCl2·4H2O 1,CuSO4·5H2O 0.3,CaCl2·2H2O 4.5,FeSO4·7H2O 3,NaMoO4·2H2O 0.4,H3BO31,KI 0.1。 维生素液(mg/L):生物素 0.05,泛酸钙 1,烟酸 1,肌醇 25,盐酸硫胺素1,盐酸吡哆醇1,对氨基苯甲酸0.2。

表1 本研究所用菌株和质粒Table 1 Strains and plasmids used in this study

表2 本研究所用引物Table 2 Primers used in this study
1.2 分子生物学操作
1.2.1 RNA的提取及18S rDNA整合表达框的构建利用UNIQ-10柱式Trizol总RNA抽提试剂盒 (上海生工生物),提取总A.flavus的 RNA。按照PrimerScript RT reagent Kit Perfect Real Time试剂盒(TaKaRa),将RNA反转录获得cDNA。以cDNA为模板,利用引物Afpyc-BamH I-S和Afpyc-PstIA进行PCR扩增获得Afpyc基因。基于此,设计Afpyc基因18S rDNA整合表达框的构建流程 (图1):(1) 利用引物 GMC-SacI-S、GMC-NotI-A 为扩增GPD启动子的表达元件,并将其连接于pMD19-T-simple载体,获得pMD19-GMC;(2)利用引物18SrDNA-BglII-S与 18SrDNA-SphI-A、rDNAtrp-SacINotI-S与rDNAtrp-NcoI-A进行PCR扩增,分别获得18SrDNA基因片段、Trp标记基因,并将其连接至pMD19-T-simple载体,获得pMD19-18S-TRP;(3)将Afpyc基因插入到 pMD19-GMC的GPD启动子的表达元件中,获得pMD19-GMCAfpyc;(4) 将 pMD19-18S-TRP 的 18S-TRP 片段,通过酶切与连接的方法,连接到pMD19-GMCAfpyc,获得Afpyc基因的融合表达载体pMD19-GMC-Afpyc-18S-TRP。

图1 基因Afpyc的18S rDNA整合表达框构建Fig.1 Construction procedure of gene Afpyc intergration plasmid pMD19-GMC-Afpyc-18S-TRP
1.2.2 重组质粒的构建以A.flavusATCC13697的 cDNA为模板,扩增关键基因Afpyc、Afmdh、Afmae。利用限制性酶BamH I&PstI、NotI&BglII双酶切后,借助T4连接酶分别连接至pY14、pY26, 获得重组质粒 pY14/Afpyc、pY26/TEFAfmdh。在此基础上,利用限制性酶EcoR I&XhoI双酶切后,借助T4连接酶连接至pY26/TEFAfmdh,获得重组质粒pY26/TEF-Afmdh-GPDAfmae。
1.3 苹果酸发酵条件及参数测定
1.3.1 培养条件将平板菌落接种于种子培养基,30℃,200 r/min培养 48 h,4 000 r/min离心 5 min收集菌体。将菌体以发酵培养基悬浮,调整发酵起始OD600为1.0,30℃,200 r/min培养96 h。 发酵起始时,添加5 g/L的CaCO3;当发酵48 h时,补充20 g/L 的 CaCO3。
1.3.2 发酵参数测定葡萄糖的测定:利用SBA-40E生物传感分析仪测定,发酵液经适当的稀释后,取25 μL直接进样到生物传感器中,根据葡萄糖标准样品浓度、仪器读书及发酵液稀释倍数计算发酵液中的葡萄糖含量。
菌体干重测定:将发酵液稀释一定倍数后,以相应的培养基作为对照,在波长600 nm处测定吸光值,并将该吸光值按照细胞干重 (Dry Cell Weight,DCW)与菌体吸光值的线性曲线(1 OD600=0.23 g/L DCW),计算菌体干重。
有机酸测定:采用高效液相色谱(HPLC)测定,色谱柱为 Atlantis®C18(5 μm 4.6×250 mm),流动相为 0.1 mol/L KH2PO4,pH 2.8;流速为 0.6 mL/min;柱温为20℃;进样量为20 μL;检测器为紫外检测器;检测波长为210 nm。胞内苹果酸的提取及样品预处理方法参照文献[14-15]。
甘油测定:采用HPLC测定,色谱柱为BioRad Aminex HPX-87H,流动相为5 mmol/L稀硫酸;柱温为 35℃;流速为 0.6 mL/min;进样量为 20 μL;检测器为示差检测器。
1.3.3 酶活测定取不同时期的发酵液离心弃上清,用0.1 mol/L、pH 8.0的磷酸钾缓冲液洗涤菌体3次,并悬浮于缓冲液中,超声破碎10 min(工作5 s,间隔 5 s)后,4 ℃,8 000 r/min 离心 3 min,所得上清液用于酶活测定。苹果酸脱氢酶的酶活测方法定参考文献[5]。丙酮酸羧化酶的酶活测定参考文献[16]。蛋白质浓度的测定,采用改良型Bradford法蛋白质浓度测定试剂盒(上海生工生物)。
2 结果与分析
2.1 Afpyc的表达对碳流分布的影响
丙酮酸羧化酶是影响苹果酸、富马酸等二羧酸大量积累的关键因素[5,10],且其低水平表达有利于提高目标产物[10-17]。前期研究表明,Afpyc基因的中、高水平表达对菌体生长有一定的抑制作用。因此,考察了Afpyc低水平表达对碳流分布的影响。将整合表达质粒pMD19-GMC-Afpyc-18S-TRP,利用限制性内切酶SphI和BglII进行双酶切,得到条带大小分别为6 165 bp和2 692 bp的片段(图2),表明该整合表达质粒已经构建成功。将测序正确的Afpyc基因 (3 582 bp)经BamH I、PstI双酶切后,连接用相同限制酶酶切的表达载体pY14,经双酶切获得条带大小分别为5 414 bp和3 582 bp的片段,表明质粒pY14/Afpyc已经构建成功。利用LiAc转化法,将线性化的质粒pMD19-GMC-Afpyc-18STRP和重组质粒pY14/Afpyc分别转入菌株tTAM中,筛选获得阳性转化子,并分别命名为W002和W003(表 1)。
基因Afpyc的单独表达能够调节碳流分布,降低丙酮酸的积累量,具体表现在 (表3):1)菌株W002和W003的丙酮酸羧化酶比酶活分别为0.63 U/mg和0.78 U/mg,相对于对照组W001分别提高了30倍和38倍,且单独表达Afpyc基因,对菌体生长没有影响;2)菌株W002、W003的丙酮酸积累量相对于W001分别降低了29.6%和42.3%;3)分析其他副产物情况可知,菌株W002、W003的α-酮戊二酸 (α-KG)积累量较对照组W001分别提高了48.1%和79.7%,这可能是由于Afpyc基因的表达使得丙酮酸的碳流流向草酰乙酸,从而进入TCA循环,导致部分α-酮戊二酸(α-KG)积累[18]。上述结果表明Afpyc的低水平表达能够有效的调节丙酮酸节点的碳流分布,且Afpyc基因的低水平游离表达效果较好。因此,选择菌株W003进行下一步研究。
2.2 Afmdh的表达对碳流分布的影响
为了进一步将碳流导向L-苹果酸,将测序正确的Afmdh基因经NotI、BglII双酶切后,连接至相同限制酶酶切的表达载体pY26,经双酶切获得条带大小分别为7 430 bp和996 bp的片段 (图3(a)),表明重组质粒pY26/TEF-Afmdh构建成功。利用LiAc转化法,将上述质粒转入菌株W003,获得菌株W005。

图2 质粒pMD19-GMC-Afpyc-18S-TRP、pY14/Afpyc酶切验证Fig.2 Confirmation of recombinant plasmid pMD19-GMC-Afpyc、pY14/Afpyc
将菌株W005经摇瓶发酵后,研究基因Afmdh的表达对碳流分布的影响,结果如图3所示:1)菌株W005的苹果酸脱氢酶比酶活为0.63 U/mg,细胞干重DCW为1.54 g/L,比对照组W004分别提高了350.2%和23.3%;2)发酵96 h时,菌株W005积累了1.93 g/L的L-苹果酸,但是,其胞内L-苹果酸浓度达到了7.52 mg/g DCW,比对照组菌株W004提高了1.59倍;3)菌株W005的丙酮酸产量为9.03 g/L,相对于菌株W004降低了62.5%。上述结果表明,基因Afmdh的表达有利于菌体生长,且共表达基因Afpyc和Afmdh能够进一步将丙酮酸的碳流导向L-苹果酸。但是由于菌株W005的胞内L-苹果酸浓度较高,限制了L-苹果酸的进一步积累。目前,已有研究表明,苹果酸的外转运是限制L-苹果酸大量积累的一个关键性因素[5-6,12],因此,需要强化L-苹果酸的外运系统,降低胞内L-苹果酸的积累量,进一步提高L-苹果酸产量。
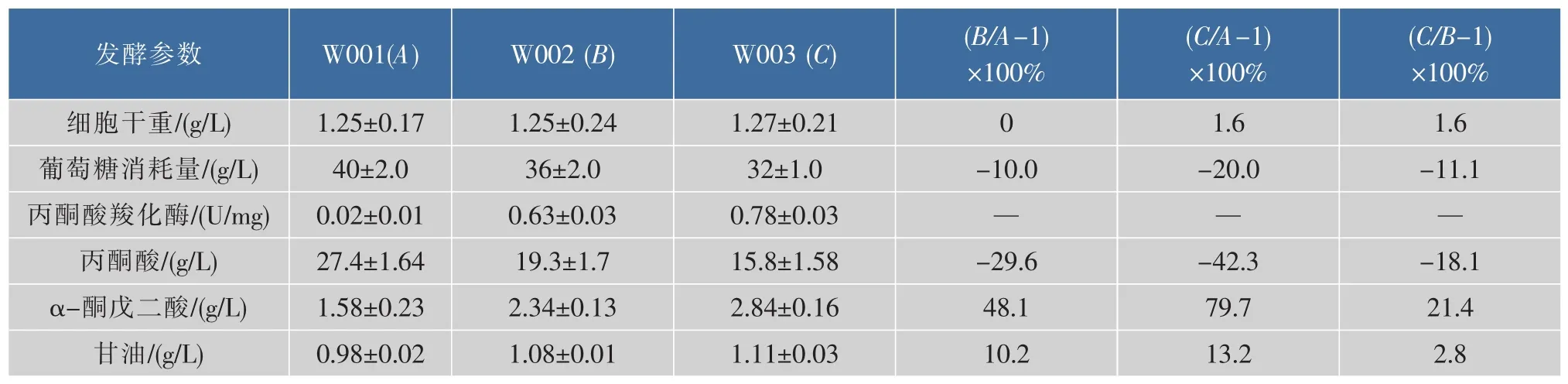
表3 Afpyc的表达对碳流分布的影响Table 3 Fermentation profiles by overexpressing Afpyc
2.3 Afmae的表达对L-苹果酸积累的影响
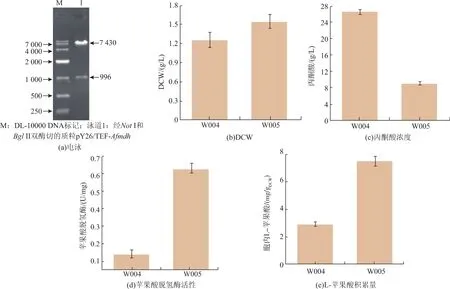
图3 胞质还原路径对L-苹果酸积累的影响Fig.3 Effect of construct rTCA pathway on the production of L-malate
通过在菌株W005中过表达基因Afmae,强化L-苹果酸的外转运系统,促进胞内L-苹果酸向胞外转运。将测序正确的Afmae基因经EcoR I、XhoI双酶切后,连接至相同限制酶酶切的表达载体pY26/TEF-Afmdh,经双酶切获得条带大小分别为8 443 bp 和 996 bp 的片段(图 4(a)),表明重组质粒 pY26/TEF-Afmdh-GPD-Afmae构建成功。利用LiAc转化法,将上述质粒转入菌株W003,获得菌株W006。
在此基础上,分析基因Afmae的表达对菌株W006积累L-苹果酸的影响,结果表明:(1)发酵96 h时,菌株W006的L-苹果酸积累量为2.34 g/L,相对于 W005提高了 21.2%;(2)菌株 W006的DCW由1.54 g/L提高到1.88 g/L,提高了22.1%;(3)分析其他副产物情况可知,丙酮酸积累量为10.4 g/L,没有进一步下降(图 4(b)),且仍然存在少量的α-酮戊二酸(α-KG)和甘油。上述结果表明,外转运系统的强化有利于菌体生长及L-苹果酸的积累。

图4 质粒pY26/TEF-Afmdh GPD-Afmae的验证及菌株W006发酵生产L-苹果酸Fig.4 Vertification of plasmid pY26/TEF-Afmdh GPD-Afmae and fermentation performance of strain W006
2.4 接种量对L-苹果酸积累的影响
为了进一步提高L-苹果酸产量,研究了不同接种量对L-苹果酸积累的影响,结果如表4所示:1)初始接种量OD600=2时,L-苹果酸的产量最高达到3.28 g/L,最终菌体DCW为2.34 g/L,单位细胞产L-苹果酸能力(L-malate/DCW)为1.40 g/L/gDCW,较对照组 (OD600=1)分别提高了40.2%、13.0%和22.8%;2)当初始接种量OD600<2时,随着接种量的增加,菌体DCW、L-苹果酸产量和L-malate/DCW也随之提高;3)当初始接种量OD600>2时,菌体DCW和L-苹果酸产量开始下降。上述结果表明,L-苹果酸产量提高的原因,一方面是由于菌体DCW的增加,另一方面是由于单位菌体生产能力 (L-malate/DCW)的提高。因此,后续研究可以通过浓缩菌体量的方式,进一步提高L-苹果酸的产量。

表4 接种量对L-苹果酸发酵的影响Table 4 Effect of initial inoculum on the production of L-malic acid
3 讨 论
丙酮酸生产菌S.cerevisiaeTAM能够积累高浓度的丙酮酸,这为构建理性的L-苹果酸生物合成路径,有效地将丙酮酸碳流导向L-苹果酸奠定了基础[5]。本研究构建的L-苹果酸生物合成路径涉及2个关键酶:丙酮酸羧化酶和苹果酸脱氢酶,该路径在理论上能够实现L-苹果酸的最大化生产。已有研究表明,丙酮酸羧化酶是高效生产氨基酸和四碳二羧酸的主要代谢瓶颈,因此,该酶也是进行基因改造获取高产菌株的重要靶标酶[19-21]。过量表达丙酮酸羧化酶能够有效增强自丙酮酸到草酰乙酸的碳流,从而,一方面增加L-苹果酸合成的直接前体,另一方面提高进入TCA循环的碳流[22]。然而,提高的碳流最终并没有转变成更多的L-苹果酸,其原因可能是苹果酸合成路径的下游草酰乙酸代谢路径存在着限速步骤[5]。单独过量表达苹果酸脱氢酶,使得由草酰乙酸到L-苹果酸的产物代谢流得到了很大的提升[23]。但是,苹果酸脱氢酶的过量表达大量消耗了胞质的NADH,有效地增强了糖酵解的速率[24-25]。综上所述,结合丙酮酸羧化酶和苹果酸脱氢酶的特点,本研究通过过量表达丙酮酸羧化酶和苹果酸脱氢酶将碳流由丙酮酸导向L-苹果酸,成功构建了L-苹果酸积累的胞质还原路径。
然而,上述路径并不能有效的将丙酮酸碳流导向L-苹果酸,原因在于L-苹果酸生物合成路径中存在着动力学代谢瓶颈。本研究中,通过测定胞内L-苹果酸的含量,发现菌株W005胞内L-苹果酸浓度达到了7.52 mg/g DCW,比对照组菌株W004提高了1.59倍。上述结果初步证明了L-苹果酸的外转运能力弱为关键代谢瓶颈。因此,应当增强工程菌W005对二羧酸的转运能力以便于竞争性转运胞质中的L-苹果酸,提高发酵液中L-苹果酸的积累量。已有研究表明,通过过量表达SpMAE1能够有效地将胞质中的L-苹果酸转运到胞外,使得在发酵液中积累更多的L-苹果酸[26]。基于此,为了进一步提高L-苹果酸的产量,将SpMAE1过量表达于W005中(即W006),最终使得L-苹果酸的产量比W005提高了21.2%。
然而,工程菌W006除了产生L-苹果酸外,仍然能够产生13.94 g/L丙酮酸,及少量的α-酮戊二酸等杂酸,从而大大提高了L-苹果酸的下游提取成本,该结果表明,L-苹果酸的生产菌株仍有再次提高的空间。伴随着组学技术的发展,系统代谢工程作为一种概念性技术框架,有效地加速了对存在路径的修饰,有效地优化了对目标代谢物的生产,为高效改造微生物生产工业产品提供了新的方法[27]。例如,利用转录组、蛋白组和代谢组能够有效深入的分析利用还原路径生产L-苹果酸所存在的代谢瓶颈。在上述基础上,利用模块路径工程系统性的装配与优化代谢模块,进而精细化控制已经存在的代谢路径,实现生产宿主的代谢平衡,进而有效地消除代谢瓶颈,改善微生物的细胞表型[28]。最终,实现杂酸大幅度降低、L-苹果酸大幅度提高,从而有效的降低L-苹果酸的下游提取成本。
4 结 语
通过在S.cerevisiae中过量表达源于A.flavus的丙酮酸羧化酶(Afpyc)、苹果酸脱氢酶(Afmdh)及C4-二羧酸转运蛋白(Afmae),成功构建了L-苹果酸合成的胞质还原路径。在此基础上,通过优化工程菌株W006的发酵条件,使得L-苹果酸的积累量达到3.28 g/L。本研究为利用异源路径生产L-苹果酸提供了一种新的借鉴。

