电解质溶液分析思维模型的构建及应用
广东 刘汉国
电解质溶液是历年高考的必考点和热点,多以选择题的形式出现,选项主要考查“守恒关系”、微粒大小比较和判断比值变化及计算。但是这部分题型得分率较低,主要原因是学生不能快而准地写出“守恒关系”,不能熟练掌握微粒大小比较与判断比值变化的方法。本文通过构建“守恒关系”思维模型、“微粒大小比较”思维模型和“比值”思维模型,突破考查电解质溶液知识的难题,供同仁们在教学时参考借鉴。
一、思维模型的构建与应用
1.“守恒关系”的思维模型
通过对n元弱酸HnA和n元弱碱B(OH)n溶液中的离子种类和A(B)的存在形式探究发现:n元弱酸HnA溶液中的阴离子种类为酸根和氢氧根,共n+1种;n元弱碱B(OH)n溶液中的阳离子种类为碱对应的阳离子和氢离子。n元弱酸HnA溶液中A的存在形式为酸根和弱酸分子,共n+1种;n元弱碱B(OH)n溶液中的B的存在形式为碱对应的阳离子和弱碱本身。另外,amol BOH(一元弱碱)的溶液与含有bmol H2A(二元弱酸)溶液混合前后,溶液中的阴、阳离子种类、A(B)的存在形式及其物质的量均不发生变化。
盐可以看成对应的酸和碱反应的产物。根据此思想和探究的结论,构建了电荷守恒和物料守恒的思维模型如图1和图2所示。

图1 电荷守恒书写的思维模型图

图2 物料守恒书写的思维模型图
对于质子守恒,只有单一的电解质溶液可以直接书写,而对于混合的电解质溶液是无法直接书写的。但是无论单一溶液还是混合溶液,都可以通过电荷守恒和物料守恒合并得到,所以这里不再构建质子守恒书写的思维模型。

( )

图3

(2)(2017·江苏卷·14,节选)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,下列说法正确的是
( )
C.0.2 mol·L-1HCOOH与0.1 mol·L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)

(2)根据思维模型写出电荷守恒c(Na+)+c(H+)=c(HCOO-)+c(OH-)和物料守恒式:2c(Na+)=c(HCOO-)+c(HCOOH),两式消去c(Na+)即可得到质子守恒c(HCOO-)+2c(OH-)=c(HCOOH)+2c(H+),故C选项错误。
【变式训练1】(2016·天津卷·6,节选)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图4所示,下列判断错误的是
( )
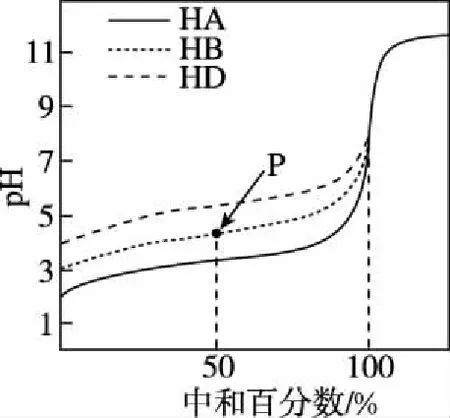
图4
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【解析】根据思维模型写出电荷守恒式:c(Na+)+c(H+)=c(A-)+c(OH-)、c(Na+)+c(H+)=c(B-)+c(OH-)和c(Na+)+c(H+)=c(D-)+c(OH-),pH=7时,c(OH-)=c(H+),所以c(Na+)=c(A-)、c(Na+)=c(B-)=c(D-)和c(Na+)=c(D-),但是三种溶液中的c(Na+)并不相等,故C选项错误。根据思维模型写出电荷守恒式:c(Na+)+c(H+)=c(A-)+c(B-)+c(D-)+c(OH-)和物料守恒式:c(Na+)=c(A-)+c(B-)+c(D-)+c(HA)+c(HB)+c(HD),消去c(Na+)即可得到质子守恒c(HA)+c(HB)+c(HD)+c(H+)=c(OH-),故D选项正确。
2.“微粒大小比较”的思维模型
“微粒大小比较”时,首先确定电解质溶液的组分,然后对组成组分的微粒按照“直接组成微粒”和“电离或水解生成微粒”进行分组,因为电离或水解都比较微弱,所以“直接组成微粒”浓度大于“电离或水解生成微粒”浓度。对于直接组成微粒,先假设微粒不发生电离或水解,按照微粒数目比较大小,若微粒数目相同,则再考虑微粒是否发生电离或水解。对于电离或水解生成的微粒,先判断溶液的酸碱性,若溶液显酸性,则在该组中c(H+)最大,c(OH-)最小,其他电离或水解生成的微粒在中间。构建的“微粒大小比较”思维模型如图5所示。

图5 “微粒大小比较”的思维模型
【例2】(2017·江苏卷·14,节选)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,下列说法正确的是
( )
D.0.2 mol·L-1CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
【解析】根据“微粒大小比较”思维模型,CH3COONa与盐酸混合后溶液的组分为等浓度CH3COOH、CH3COONa和NaCl三种溶质的混合溶液,该组分直接组成微粒CH3COOH、CH3COO-和Cl-,假设CH3COOH不发生电离、CH3COO-不发生水解,则CH3COOH、CH3COO-和Cl-三者相等,但混合后的溶液中pH<7,意味着CH3COOH电离比CH3COO-水解程度大,故c(CH3COO-)>c(Cl-)>c(CH3COOH);“电离生成微粒”为H+,故c(H+)最小,故D选项正确。
【变式训练2】(2016·上海卷·31,节选)已知:碳酸(H2CO3),Ki1=4.3×10-7,Ki2=5.6×10-11;草酸(H2C2O4),Ki1=5.9×10-2,Ki2=6.4×10-5。若将等浓度的草酸溶液和碳酸溶液等体积混合,各种离子浓度大小的顺序正确的是________。(选填编号)

3.“比值”的思维模型
判断比值变化或计算比值时,先根据题干信息写出平衡常数表达式,然后把表达式变形成题干中的形式,再根据题目条件,判断出比值的变化。构建“比值变化”思维模型如图6所示。

图6 “比值”的思维模型
【例3】(2017·全国卷Ⅰ·13,节选)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
( )
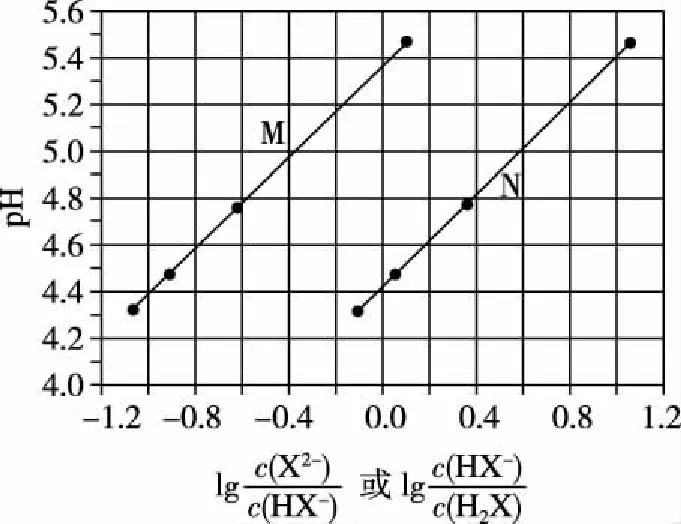
图7

【变式训练3】(2016·全国卷Ⅲ·13,节选)下列有关电解质溶液的说法正确的是
( )




二、电解质溶液考点的备课建议
高中知识纷繁复杂,高中生学业繁重,电解质溶液是高考的重点、难点和热点,教师在教学中如何帮助学生突破该考点的瓶颈呢?
1.精心研究考纲,把握命题动向
研究考纲是高三复习的前提。通过对近几年高考题的研究,把握今后的命题方向。把考纲和命题动向作为复习和练习的主要依据,使复习和练习更具有针对性。
2.深挖事物本质,抓住核心知识
越是看似错综复杂的问题,越是要回归原点,所以在复习时强调基础知识,把握核心知识。只有抓住核心知识,才能以不变应万变应对高考。
3.探究知识规律,构建思维模型
解题是学生对所学知识进行内化的过程,更是培养学生思维能力的过程。解题思路的正确与否直接关系到解题的效率和正确性。只有科学掌握知识,遵循客观规律,才能在正确的解题思维指导下正确解题。在教学中,应积极引导学生探究知识规律,构建思维模型。只有探究规律,才能应用规律。在某些问题的解决中,思维模型的作用是其他手段无法替代的。思维模型的构建,不仅简化了解题过程,提升了解题效率,而且培养了学生“证据推理与模型认知”的化学核心素养。

