“五关注”思维模式下的离子浓度大小比较
重庆 王 明
“离子浓度大小比较”是高考试题中的热点和难点问题。通过对近三年各地高考试题的细致研究,发现这类题目的出现通常都伴有图象,要求学生看懂图象,用好图象。
作为化学教师我们应该深入思考,高考试题为什么会这样设置呢?其实,这是由化学学科特征所决定的。随着社会的发展和科技的进步,化学已由“宏观、微观和符号”的“三重表征”走向了“宏观、微观、符号和曲线”的“四重表征”。“离子浓度大小比较”能集中体现化学学科的四重表征:宏观的反应现象;微观的离子行为(包括电离、水解、沉淀、氧化还原反应等);符号即化学方程式(或离子方程式);曲线即酸碱中和滴定曲线、沉淀滴定曲线、电导率滴定曲线等。在化学核心素养和新课程标准大力推行的现实背景下,笔者大胆预测这类题目将继续成为高考的热点。
为了让学生顺利解答此类问题,在实际教学中笔者运用了“五关注”思维模式,取得了不错的教学效果。其思维模式可简单表述如下:
关注组成:指溶液中的溶质组成。特别是几种物质混合能发生化学反应时,更要特别注意反应后溶液中溶质的组成。
关注程度:溶液中某些物质的电离或水解程度有多大。
关注竞争:溶液中各种平衡的相互竞争。特别是当溶液中既有水解平衡又有电离平衡时,搞清楚以哪一种或哪一步平衡为主。
关注守恒:通俗地讲就是溶液中的等式关系。即电荷守恒、元素守恒,以及两种守恒合并之后的质子守恒。
关注转换:即等量替换。需要特别注意的是,有时候离子浓度的大小顺序往往也是通过守恒关系中的等式和等量替换转变而来的。
一、“五关注”思维模式的建立
【例题】(2016·全国卷Ⅰ·12改编)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
( )



【答案】D

二、思维模式的运用
【变式训练1】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲线如图所示。下列说法正确的是
( )

A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
【答案】D
【变式训练1分析】关注溶液中溶质组成、守恒和程度即可判段出:A、B、C错误,D正确。
【变式训练2】(2012·江苏·15)(双选)25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
( )

A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
【答案】C

三、拓展运用
各种滴定曲线中,尤以酸碱中和滴定曲线最为常见。在“酸滴碱”或“碱滴酸”的过程中,不仅混合溶液的pH会发生改变,溶液中水的电离程度也会发生改变。引入“水的电离程度”这个变量后,就对学生的综合能力提出了更高的要求。实际的教学实践中,笔者在上述“五关注”思维模式建立的基础上,对练习题做了更进一步的升华。
【拓展训练1】298 K时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴定过程中氨气不逸出)。下列有关叙述不正确的是
( )
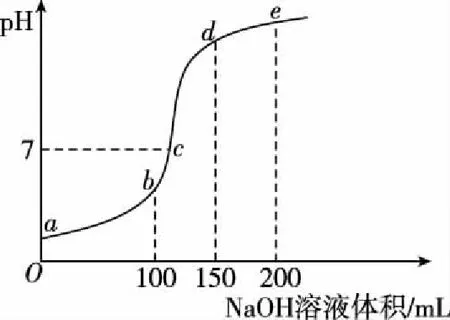

B.水的电离程度由大到小的顺序为b>c>d>e

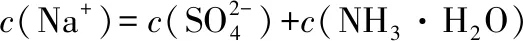
【答案】C

【拓展训练2】上题中随着NaOH溶液的滴入水的电离程度如何变化?用图象表示c(H+)水电离与所加NaOH溶液体积的关系?
【答案】a→b,水电离程度增大;b→e,水电离程度减小。图象表示为

【拓展训练3】0.1 mol·L-1的稀盐酸溶液,分别用0.1 mol·L-1的NaOH和氨水滴定,pH随着加入碱溶液的体积变化如图所示,下列叙述正确的是
( )

B.中和完全后,两溶液混合,所得溶液中:c(NH3·H2O)+c(OH-)=c(H+)
C.曲线Ⅰ是利用氨水滴定盐酸,B点溶液的导电能力等于D点
D.C~D(不包括C、D两点)之间,所有点都会使水的电离平衡发生移动
【答案】B


