高血钾预处理对心搏骤停大鼠心肺复苏效果和心肌顺应性的影响▲
韦永先 覃 涛 卢俊宇 杨叶桂 陈蒙华
(广西医科大学第二附属医院重症医学科,南宁市 530007,电子邮箱:wyx0238@sina.com.cn)
心肌细胞钙超载可影响细胞兴奋-收缩偶联,从而导致心肌持续强直性收缩[1-2]、左室舒张压和每搏输出量顺行性下降,大体病理表现为典型的“石头心”[3-4]。钙超载时心肌的顺应性极差,随着左室舒张压的逐渐下降,心脏失去泵血功能,几乎不能接受回流的血液[5],患者的预后不佳。本课题组前期动物实验结果显示,心搏骤停大鼠复苏失败的主要原因是发生了“石头心”;且大鼠心搏骤停持续时间越长或心肺复苏时间越长,发生“石头心”的概率越大[6]。而临床研究表明,高钾灌注液能够抑制心肌细胞内的钙超载,减少心肌细胞的缺血再灌注损伤(ischemia-reperfusion injury,IRI)[7-11],其潜在机制可能与高血钾提高心肌细胞对IRI的耐受性、拮抗钙超载、抑制心肌过度收缩、维持心肌一定的顺应性有关。若一定程度高血钾状态可减轻心肌持续缺血后钙超载程度,这可能会对临床上心搏骤停高危人群的防治起到一定的指导作用。因此,本研究通过静脉注射氯化钾以升高大鼠体内血钾浓度,再采用电刺激法建立心搏骤停模型,旨在探讨高血钾预处理对心搏骤停模型大鼠的心肺复苏成功率、心肌舒张功能及顺应性的影响。
1 材料与方法
1.1 实验动物 健康清洁级雄性SD大鼠90只,8~12周龄,体重210~230 g,由广西医科大学动物实验中心提供,动物许可证号:SCXK(桂)2014-0002。大鼠术前12 h禁食,自由饮水。本研究符合动物伦理学标准,在获得广西医科大学医学部动物管理和应用委员会的许可后开展实验。研究过程中,保障动物生活栖息场的温度、湿度、气流、采光、清洁卫生状况,提供充足清洁的饮用水和食物;在操作过程中,尊重及善待动物,避免其恐惧及不安,减少对动物的伤害,采用伤害最小的方式处置动物。
1.2 主要仪器和试剂 BL-420F型生物机能实验系统(四川成都泰盟仪器公司),RWD407型小型动物呼吸机(深圳市瑞沃德生命科技有限公司)。氯化钠注射液(广东大冢制药有限公司,批号:H44020186),10%氯化钾溶液(湖北天圣药业有限公司,批号:H42020421),水合氯醛(成都科龙化工,批号:2016092901)
1.3 动物分组 将90只大鼠按随机数字表法分为高血钾预处理组和生理盐水组,每组45只,再将两组大鼠按随机数字表法分别分为3个亚组,即6 min高血钾预处理(HK 6min)组、9 min高血钾预处理(HK 9min)组、12 min高血钾预处理(HK 12min)组和6 min生理盐水(NS 6min)组、9 min生理盐水(NS 9min)组、12 min生理盐水(NS 12min)组,每组15只。
1.4 预处理及心脏骤停模型的建立方法 (1)预处理:室温环境下,腹腔注射10%水合氯醛(300 mg/kg)麻醉大鼠,将大鼠以仰卧位固定于手术台后备皮消毒、于左侧腹股沟作一约1 cm的纵向切口,分离大鼠左侧股动、静脉,分别置入1条20 G留置管(管内充满5 IU/ml肝素钠生理盐水)。高血钾预处理组、生理盐水组从股静脉留置管分别注入80 μg/g的10%氯化钾、等量生理盐水。(2)大鼠心脏骤停模型的建立:采用经食道交流电刺激诱导的方法建立大鼠心脏骤停模型[12]。经股静脉给予氯化钾或生理盐水5 min后,将双极F6临时起搏电极经口送入大鼠食道内,深度为5~6 cm(即在大鼠心脏搏动最强的后方),选用12 V电压的交流电刺激60 s后,停止电刺激观察心电图及心电监护,若仍出现自主心律或血压回升,则附加1次20 s的12 V电刺激,直至心电监护持续显示无脉性电活动或心跳停搏状态。成功诱发心脏骤停的标准:心电监护显示无脉性电活动,有创血压监测显示无搏动波,平均动脉压<10 mmHg,见图1。
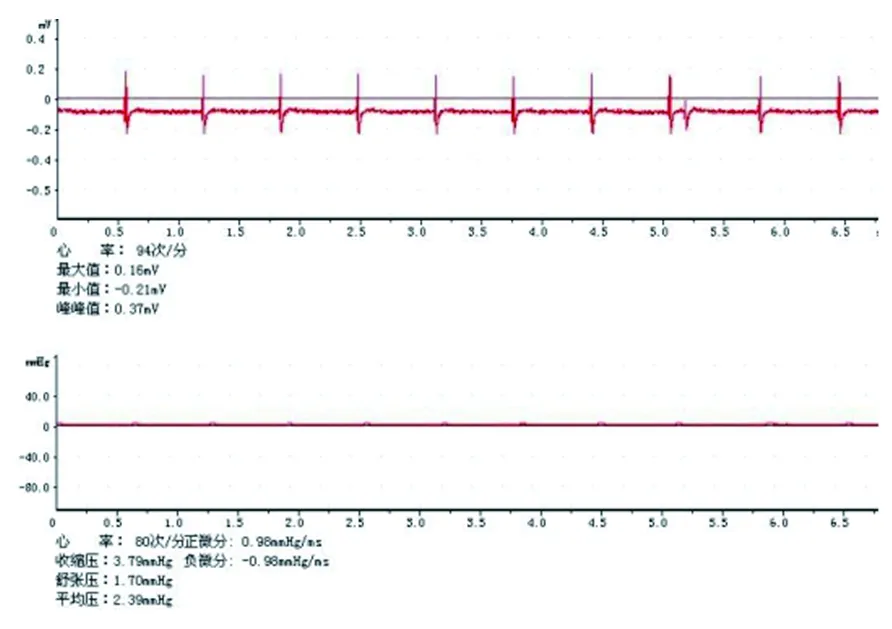
图1 电刺激成功诱发大鼠心搏骤停效果图
1.5 干预方法 (1)干预的时机:HK 6min组和NS 6min组:在电刺激诱发心搏骤停6 min后开始心肺复苏;HK 9min组和NS 9min组:在电刺激诱发心搏骤停9 min后开始心肺复苏;HK 12min组和NS 12min组:在电刺激诱发心搏骤停12 min后开始心肺复苏。(2)心肺复苏方法:连接动物胸外按压器,按压频率设定为180次/min,按压深度约为大鼠胸廓前后径的1/3,按压与松开时间的比例为1 ∶1,同时用14 G气管套管经口行气管插管,连接呼吸机进行机械通气,通气频率设定为70次/min,潮气量设定为6 ml/kg。实验过程中维持室温26℃,使用加热灯控制维持体温,全程监测动物肛温维持在(37.0±0.5)℃[12]。若心肺复苏过程中未能自主循环恢复(restoration of spontaneous circulation,ROSC),分别在开始按压后的第1、4、7 min给予静脉注射肾上腺素(0.02 mg/kg),心肺复苏超过10 min大鼠未ROSC则定义为复苏失败,ROSC的标准:心电监护示室上性节律(包括窦性、房性或交界性心律)伴有平均动脉压≥50 mmHg,持续5 min以上。心肺复苏过程中持续给予机械通气,待大鼠血流动力学稳定15 min后停止机械通气;同时持续给予心电监护及动脉血压监测,动脉血压
监测方法:股动脉留置管与BL-420F型生物机能实验系统的压力换能器相连,四肢经皮下针头记录标准Ⅱ导联心电图,心电描记速度为125 ms/div。
1.6 观察指标 (1)各组大鼠的复苏成功率以及复苏成功大鼠心肺复苏成功所需时间,其中心肺复苏成功所需时间指自心肺复苏开始到ROSC的时间,复苏成功率=各组复苏成功大鼠数量/各组大鼠数量×100%。(2)各组复苏失败大鼠终止心肺复苏前按压状态下的舒张压、心脏硬度评分和“石头心”的发生率。心脏硬度评分:心脏的硬度分为5级,每级记1分,其中1级为指尖触摸大鼠心脏如口唇硬度,3级为指尖触摸大鼠心脏如鼻尖硬度,5级为指尖触摸大鼠心脏如额头硬度,2级和4级分别介于1级与3级和3级与5级硬度之间[9]。心脏硬度评分≥3分判断为“石头心”。“石头心”发生率=各组发生“石头心”大鼠数量/各组大鼠数量×100%。
1.7 实验质量 实验开展前对实验人员进行严格的培训,包括仪器使用及检测方法等;定期检查、校准实验测量仪器,确保检测结果的准确性;控制实验室的温度、湿度、光线等,保障外界环境的一致性;实验操作过程中,实验人员分工明确;严格按照模型制作标准,剔除不合格的样本。
1.8 统计学分析 采用SPSS 21.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料以例数或百分比表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 6组大鼠一般情况比较 实验前6组大鼠体重、心率、体温、平均动脉压及电刺激用时比较,差异均无统计学意义(均P>0.05),见表1。所有大鼠均成功诱导心脏骤停。
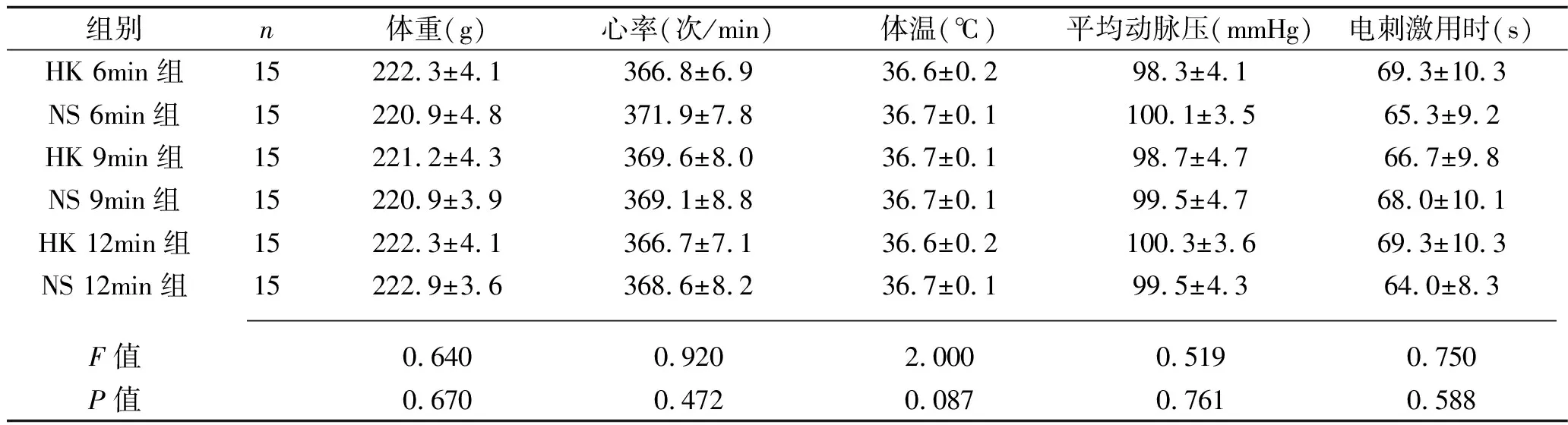
表1 6组大鼠一般情况比较(x±s)
2.2 6组大鼠心肺复苏成功率及所需时间的比较 HK 6min组、HK 9min组、HK 12min组大鼠复苏成功率依次降低,高于相应间隔时长的生理盐水组(均P<0.05),见表2。HK 6min组、HK 9min组、HK 12min组心肺复苏成功所需时间依次延长,且HK 6min组、HK 9min组所需时间短于NS 6min组、NS 9min组(均P<0.05),见表3。

表2 6组大鼠复苏成功率比较[n(%)]
注:与HK 6min组比较,*P<0.05;与HK 9min组比较,#P<0.05;与HK 12min组比较,▲P<0.05。
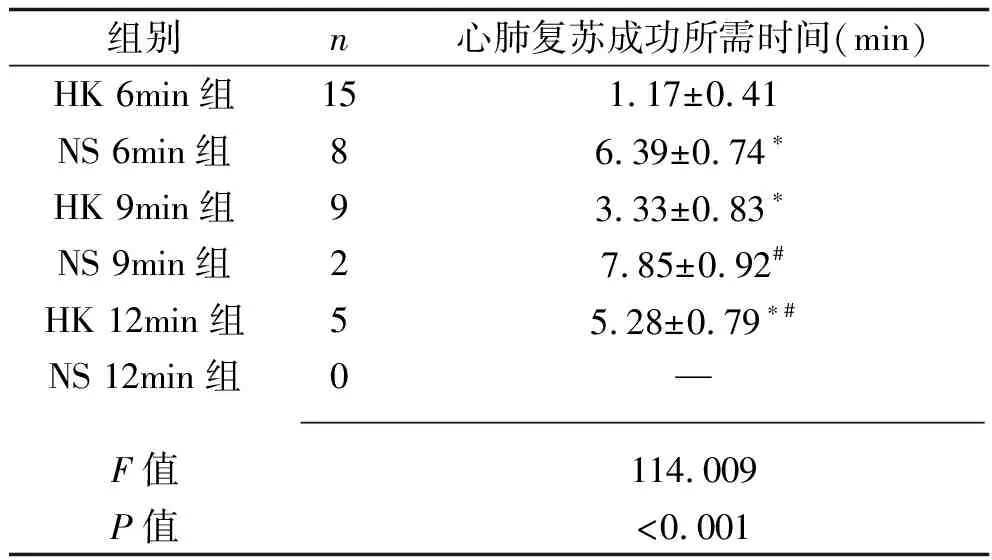
表3 6组复苏大鼠心肺复苏成功所需时间比较(x±s,min)
注:与HK 6min组比较,*P<0.05;与HK 9min组比较,#P<0.05。
2.3 复苏失败大鼠心肌顺应性情况比较 打开复苏失败大鼠胸腔后可观察到,生理盐水组大鼠心脏挛缩明显,而高血钾预处理的大鼠心脏仍保持一定腔隙结构,见图2。在复苏失败的大鼠中,HK 9min组、HK 12min组心脏硬度评分、“石头心”发生率均分别低于NS 9min组、NS 12min组,终止复苏前舒张压分别高于NS 9min组、NS 12min组(均P<0.05),见表4。
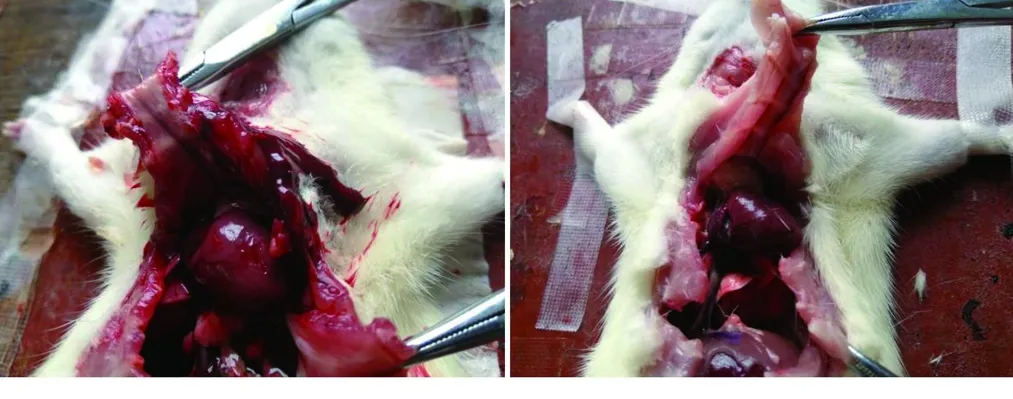
图2 高血钾预处理与生理盐水组复苏失败大鼠心脏大体图
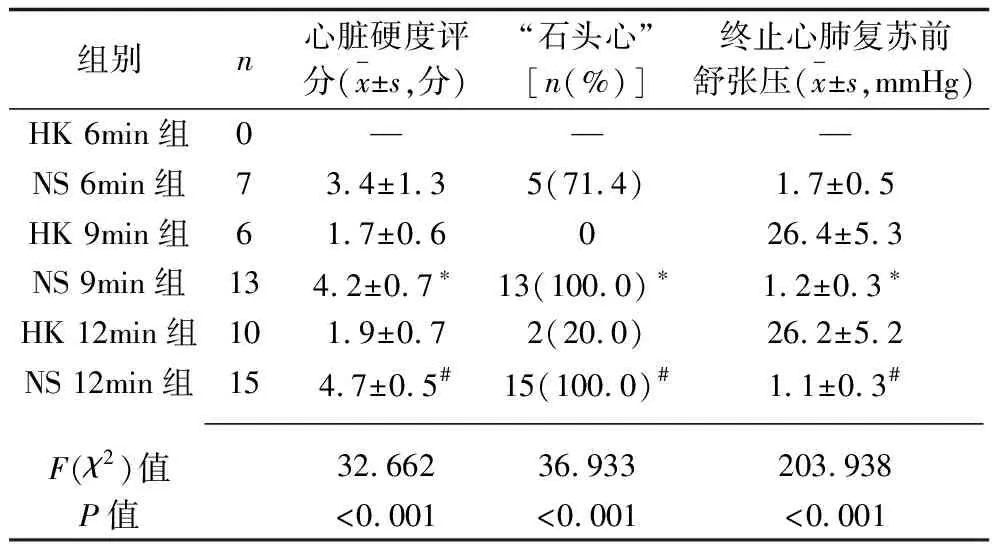
组别n心脏硬度评分(x±s,分)“石头心”[n(%)]终止心肺复苏前舒张压(x±s,mmHg)HK 6min组0———NS 6min组73.4±1.35(71.4)1.7±0.5HK 9min组61.7±0.6026.4±5.3NS 9min组134.2±0.7∗13(100.0)∗1.2±0.3∗HK 12min组101.9±0.72(20.0)26.2±5.2NS 12min组154.7±0.5#15(100.0)#1.1±0.3# F(χ2)值32.66236.933203.938P值<0.001<0.001<0.001
注:与HK 9min比较,*P<0.05;与HK 12min组比较,#P<0.05。
3 讨 论
正常人体内含钾总量为50~55 mmol/kg,其中约98%的钾离子存在于细胞内,是细胞内最主要的阳离子。钾离子是维持细胞膜静息电位的物质基础,同时还参与调节细胞内外渗透压和酸碱平衡以及体内多种新陈代谢过程[13]。人体内正常的血清钾浓度为3.5~5.5 mmol/L,在临床上高血钾(血清钾浓度>5.5 mmol/L)或严重高血钾(血清钾浓度>7.0 mmol/L)的最主要危害是引起心室颤动和心脏骤停[14]。高血钾导致心肌细胞静息电位减小,从而造成兴奋细胞所需的阈刺激也相对减小,心肌细胞兴奋性增高;同时还造成动作电位除极幅度减小、细胞的兴奋性扩布减慢,导致传导性降低;血钾升高可造成钙离子内流延迟,并激活钠-钾泵促进钠-钙交换,使得细胞内钙外流增多,细胞内钙离子浓度下降,心肌细胞兴奋-收缩偶联受影响[1-2,15]。
随着相关心脏手术以及介入治疗手段在急性冠脉综合征中的广泛应用,心肌细胞的IRI越来越受到临床重视[16-17]。目前,在关于心肌细胞IRI的研究中,低钾给心脏带来的损害已得到普遍认可[18-20],而关于高钾液减轻心肌细胞钙超载的研究也已在细胞及器官层面上得到证实,同时研究也逐渐深入至离子通道的相关机制。动物实验研究表明,高钾可以使心肌细胞钙通道较早关闭,减少钙内流,抑制心肌过度收缩,使心脏处于舒张状态,且可在心脏停跳阶段大幅度地减少心肌细胞的能量消耗,从而有利于心脏功能的恢复[7,21-23]。句海松等[7]通过建立离体大鼠心脏灌流模型发现,一定程度的高钾能保护心肌细胞膜上的Na+-K+-三磷酸腺苷酶活性,抑制细胞内钙和钠的过负荷;同时还发现即使在心脏骤停后予少量高钾溶液灌注,也能减轻心肌细胞的IRI,其机制可能与减轻钙超载有关。有学者在大鼠及兔的心肌缺血再灌注模型研究中也发现,缺血再灌注过程中细胞外钾离子浓度的不均一性是造成再灌注心律失常的重要原因,再灌注早期短暂给予高钾液可显著减轻再灌注心肌细胞的损伤[9-10]。
研究结果显示,通过静脉注射氯化钾建立的小鼠心脏骤停模型小鼠心脏停跳时间(10~12 min)明显长于采用电刺激法建立的心脏骤停模型(4~5 min)[24-27],且复苏成功率高于电刺激法模型[26-27]。因此,为了排除静脉注射氯化钾本身对模型带来的干扰,本研究采用电刺激法建立心脏骤停模型。
本研究结果显示,与相应间隔时长的生理盐水组比较,HK 6min组、HK 9min组、HK 12min组大鼠复苏成功率均较高,且心肺复苏成功所需时间均缩短(均P<0.05),提示高血钾预处理可提高对心脏骤停模型大鼠的心肺复苏质量,考虑为高血钾预处理对心脏骤停模型大鼠心脏IRI起到抑制作用,对缺血缺氧的心肌具有保护作用。且HK 6min组、HK 9min组、HK 12min组大鼠复苏成功率依次降低,心肺复苏所需时间依次延长(均P<0.05),提示随着心脏骤停时间的延长,大鼠复苏成功率降低。
“石头心”是缺血性心肌挛缩的一种严重形式,具体表现为心室游离壁渐进性增厚和心室腔的不断缩小。Klouche等[3]在诱导猪发生室颤的实验中描述了“石头心”的存在,且发现随着室颤持续时间延长,心脏的左室舒张末压和每搏输出量出现顺行性下降。Takino等[5]发现心肌挛缩与心肺复苏的结局密切相关,“石头心”患者通常以复苏失败而告终。Koretsune等[28]的研究也表明,心肌出现能量代谢障碍时会导致“石头心”的发生,且其可能与钙离子浓度升高有关。本研究结果显示,HK 9min组、HK 12min组复苏失败大鼠终止复苏前的舒张压分别高于NS 9min组、NS 12min组(均P<0.05),提示高血钾预处理可以使心搏骤停大鼠心脏一定舒张功能,保证心肌在按压时仍可通过心肌舒张接受回心血流、处于可泵血的状态,为复苏成功在结构和功能上提供了基础。此外,HK 9min组、HK 12min组复苏失败大鼠心脏硬度评分、“石头心”的发生率分别低于NS 9min组、NS 12min组(均P<0.05)。提示高血钾预处理还可以降低复苏失败大鼠的心脏硬度评分,在整个复苏阶段其心肌仍能保持一定的顺应性,心肌未因过度挛缩而失去舒张功能,形成所谓的“石头心”。其机制可能与高血钾通过拮抗钙超载、抑制心肌细胞收缩-舒张功能,从而达到松弛心肌、降低耗氧及抑制心肌过度收缩等有关。
综上所述,高血钾预处理可以提高对心搏骤停大鼠的心肺复苏质量,但随着心搏骤停持续时间的延长,大鼠的复苏成功率下降。心肺复苏过程中高血钾预处理可能通过抑制钙超载从而抑制心肌过度挛缩,改善心搏骤停大鼠心肌顺应性,为复苏成功在结构和功能上提供了基础。本研究结果或可为临床上心搏骤停高危人群的防治提供一定的参考。

