水囊扩张法3D经直肠腔内超声在低位直肠癌术前分期中的应用
刘启志 洪永刚 施洪 徐怡 白辰光 王忠昊 陶正博 郝立强 张卫
直肠癌是消化道最常见的恶性肿瘤之一,而低位直肠癌占国内直肠癌的大多数[1]。直肠腔内超声(endorectal ultrasonography,ERUS)检查是目前评估直肠癌浸润深度最准确的影像学方法之一,其能清晰显示肿瘤浸润深度,在低位直肠癌术前分期中占有重要地位[2]。本研究回顾性分析上海长海医院肛肠外科低位直肠癌手术前行水囊扩张法3D经ERUS检查的资料,探讨其在术前T分期中的灵敏度及特异度。
资料与方法
一、研究对象
回顾性分析2015年6月至2017年12月间在长海医院肛肠外科经水囊扩张法3D经ERUS检查的直肠癌患者的临床资料,手术病理证实为直肠癌。病例入选标准:(1)手术前未行任何新辅助放化疗;(2)肿瘤切除完整;(3)术前完成ERUS检查,并保存完整图像;(4)具有术后病理检查结果。符合上述标准,最终入选病例72例,其中,男性38例,女性34例,年龄35~79岁,平均(52.7±2.8)岁。
二、仪器与方法
使用丹麦Brüel&Kjae公司彩色多普勒超声扫描仪,配备2052直肠腔内探头(频率6~16 MHz)。检查当天给予患者硫酸镁或复方聚乙二醇口服,或者清洁灌肠。检查时嘱患者左侧卧位,双腿弯曲向前,医生肛门指检后明确肿瘤位置、深度、大小及可否通过探头,然后将套上水囊的直肠腔内探头缓慢插入肛门,向水囊注水,使水囊壁紧贴直肠黏膜。检查时可手动调整探头的晶片并调节深度与方向,多方向、多水平断面观察肿瘤。将扫描全貌动态图像及肿瘤浸润最大深度图用3D模式储存于计算机中。检查结束后经2名超声诊断医生共同进行评估,记录肿瘤方位、大小、距肛门的距离、形态及浸润深度。
三、图像分期标准
3D腔内超声下直肠壁呈5层“三明两暗”的结构(图1A)。当肿瘤浸润直肠壁时,原有的5层结构呈现出失去回声或回声中断的表现,未被侵犯的层次则保持原回声的完整性。通过观察直肠癌各层的完整性判断肿瘤浸润的深度。直肠癌ERUS分期(uT)标准,具体为:uT1期,肿瘤局限在黏膜和黏膜下层(图1B);uT2期,肿瘤穿透黏膜下层,侵犯固有肌层(图1C);uT3期,肿瘤穿透固有肌层,侵犯无腹膜覆盖的直肠旁组织(图1D);uT4期,肿瘤侵犯邻近器官和(或)脏层腹膜[3]。术后分期采用病理分期(pT),根据病理科对手术标本的病理诊断。
四、统计学分析方法
采用SPSS 17.0软件对数据结果进行统计分析,计量资料以均值±标准差()表示。术后病理分期诊断结果作为金标准,统计ERUS在直肠癌术前分期中的灵敏度、特异度、阳性预测值、阴性预测值以及过深分期和过浅分期。灵敏度=真阳性人数/(真阳性人数+假阴性人数)×100%,特异度=真阴性人数/(真阴性人数+假阳性人数)×100%。
结 果
本组72例直肠癌患者中,肿瘤最大直径6.0 cm,最小 2.1 cm,平均(4.7±1.8)cm。肿瘤下缘距齿线最大距离5.5 cm,最小距离1.0 cm,平均(3.9±1.5)cm。肿瘤形状主要为:息肉型10例、隆起型20例、溃疡型42例。根据术前ERUS分期,结合术前MRI检查,最终手术方式采用经肛门局部切除、经腹直肠癌根治性切除术和腹会阴联合直肠癌根治术。
术前超声诊断uT1期16例,uT2期23例,uT3期25例,uT4期8例。水囊扩张法经ERUS对诊断uT1期直肠癌敏感度、特异度、阳性预测值、阴性预测值分别为93.3%、96.5%、87.5%、98.2%,诊断符合率为95.8%;对诊断uT2期直肠癌敏感度、特异度、阳性预测值、阴性预测值分别为87.0%、93.9%、87.0%、93.9%,诊断符合率为91.7%;对诊断uT3期直肠癌敏感度、特异度、阳性预测值、阴性预测值分别为84.0%、91.5%、84.0%、91.5%,诊断符合率为88.9%;对诊断uT4期直肠癌敏感度、特异度、阳性预测值、阴性预测值分别为71.4%、95.4%、62.5%、96.9%,诊断符合率为93.1%。过深分期百分比为5.6%,过浅分期百分比为11.1%。直肠癌术前uT与术后pT分期比较结果如表1所示。
讨 论
目前,CT、MRI和腔内超声等检查是直肠癌术前评估的主要手段。《2017版结直肠癌诊疗规范》推荐ERUS作为中低位直肠癌诊断及术前分期的常规检查,它可以清楚显示直肠壁层次,能对肿瘤浸润深度做出较为准确的判断[4]。而且,ERUS对于T1和T2分期直肠癌诊断的准确率较高,且效果优于MRI检查[5]。Zhong等[6]研究发现,ERUS与MRI在T3期直肠癌术前分期的准确性方面差异无统计学意义。目前认为,ERUS是术前评估直肠癌最可靠的影像学方法之一,在判断直肠癌浸润深度,特别是术前T分期方面具有较为明显的优势[7]。
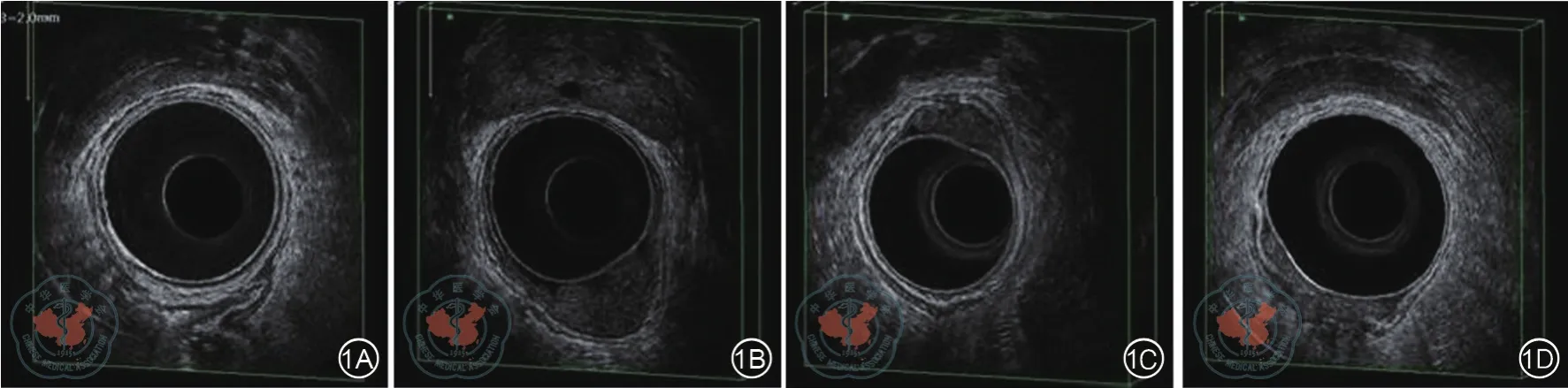
图1 不同T分期的直肠癌ERUS图像。1A:正常直肠壁呈5层“三明两暗”结构(自内向外第1层强回声为直肠黏膜与探头水囊贴合形成,第2层低回声对应直肠黏膜肌层,第3层强回声与直肠黏膜下层向对应,第4层低回声与直肠固有肌层一致,第5层强回声对应于直肠外膜);1B:T1期直肠癌;1C:T2期直肠癌;1D:T3期直肠癌
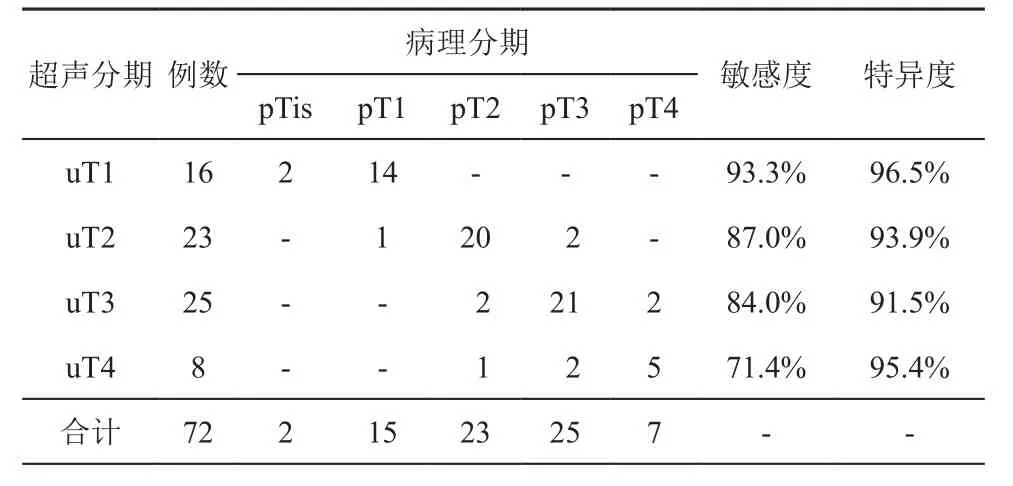
表1 直肠癌术前腔内超声诊断与术后病理诊断T分期对照结果(例)
本研究中水囊扩张法3D ERUS诊断的T1~T4期诊断符合率分别为95.8%,91.7%,88.9%和93.1%,说明本方法在术前诊断早期直肠癌中准确率较好。本组研究中,ERUS检查在诊断低位直肠癌中存在过深或过浅判断。本研究过深判断共4例:其中,2例T2期过深判断为T3期,2例T3期过深判断为T4期,这可能与肿瘤周围组织的纤维化、炎症反应和组织水肿而使超声图像出现了过深分期的假象有关。本研究过浅判断共8例:其中,2例uT1期术后病理示Tis,术前超声显示肿瘤局限在黏膜肌层,术后病理提示肿瘤是高级别上皮内瘤变,相关文献也提示ERUS对于T1期肿瘤常存在过深诊断的误区;3例可能是因为肿瘤纵轴过长,ERUS未能观察肿瘤浸润最深处而误将T4期肿瘤判断为T2和T3期;还有3例可能因气泡干扰等因素导致图像不清晰,ERUS不能对肿瘤进行全面评估而导致。Kolev等[8]回顾性分析71例术前分期的结果,结果表明ERUS对T1、T2、T3、T4分期直肠癌的术前分期敏感度分别为92.8%、93.1%、91.6%、100%,特异度分别为98.2%、95.4%、97.8%、98.5%,过高分期2.75%,过低分期6.87%。对于ERUS的敏感度和特异度,不同的单位出具不同的结果,但是经验丰富的腔内超声医生往往可以避免过高和过低的术前分期,因此,这就要求广大医师积极提高自身的操作水平,避免出现差错。
手术前对肿瘤做出正确的术前分期,对制订治疗方法、手术方案选择和提高患者生存率具有重要的决策作用。ERUS能提供肿瘤距离肛门的距离、大小、浸润深度,以及是否侵犯周围组织(特别是前列腺、精囊腺及阴道等),是否存在淋巴结转移等。这都有利于我们结直肠外科医生根据ERUS结果选择手术方式。尤其对于早期直肠癌,ERUS具有比MRI更准确的分期效果,可更精确地指导临床手术治疗[9]。本研究中,ERUS发现16例uT1期患者,经盆腔MRI增强检查,均行经肛门直肠肿瘤微创术(TEM术);48例uT2及uT3期有/无淋巴结转移患者,均行全直肠系膜切除术(TME术);ERUS发现肿瘤侵犯齿线处及外扩约肌的患者,均行腹会阴联合直肠癌根治术;8例uT4期直肠癌患者根据术中情况行扩大直肠癌根治术,并进行术中冰冻,保证环周切缘的完整性。Leon-Carlyle等[10]研究证实ERUS经常对肿瘤术前过度分期,因此,不该拒绝临床合适的患者行TEM手术。
水囊扩张法3D ERUS能够清晰显示直肠壁解剖层次关系。目前国内ERUS检查多采用耦合剂充盈法和水囊扩张法[11]。本研究采用水囊扩张法ERUS,它通过充盈水囊充分扩张直肠腔,将水囊与直肠壁黏膜紧密贴合,超声通过水囊中的介质水,清晰显示直肠壁三明两暗的五层结构。与耦合剂充盈法相比,水囊扩张法消除了直肠壁的皱襞,有利于浸润深度的准确判断。而耦合剂充盈法,则是肿瘤直接漂浮于耦合剂中,尽管可清楚显示肿瘤的形状等信息,但很多因耦合剂充盈不良等因素,不利于准确显示肿瘤浸润肠壁的深度,从而影响对术前T分期的准确判断。耦合剂充盈法和水囊扩张法各有优势,耦合剂充盈法可更好地显示肿瘤形态,但是水囊扩张法能够更清晰地显示直肠壁各层次,分析其原因可能是水囊扩张法超声与直肠黏膜贴合紧密,超声衰减比较少,因而可有效评估直肠癌浸润深度。因此,在实际工作中,医师应结合各种超声仪器的优缺点,充分发掘超声的优势,并在工作中积极寻找产生错误的原因,尽可能使超声分期贴合病理分期。
当然,ERUS结果的准确性也受多种因素制约,单纯依靠ERUS并不能达到理想的治疗策略的需求[12]。根据笔者的经验,第一,水囊扩张法ERUS仅能探测低位直肠癌,对于位置比较高的肿瘤,因为患者的排便感和水囊扩张的作用,无法达到比较深的距离,限制了对中高位直肠癌的检查;第二,肿瘤周边常伴随炎症反应,引起肠壁层次感不清。在超声声像图中癌细胞浸润和炎细胞浸润表现有时很难区分,这是导致腔内超声术前病理分期过深的主要原因;第三,清洁灌肠不彻底,气囊内气体引起的伪像也会干扰术前分期的结果;第四,超声操作者的技术差异及经验水平也决定了ERUS的准确性。因此,在临床工作中,医师应该结合CT、MRI及ERUS对直肠癌患者的术前分期进行综合判断,为直肠癌的治疗提供最优的解决方案。
总之,水囊扩张法3D经ERUS检查作为一种腔内超声检查方法,能清晰显示直肠癌浸润深度,对低位直肠癌术前分期具有重要的指导意义,是低位直肠癌术前分期和评估手术方式的首选检查方法。

