亚麻浸泡脱胶与短时间浸渍脱胶的比较
田英华,张羽飞,刘晓兰,王 路
(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
亚麻纤维是可再生、可生物降解的天然纤维,具有优越的物理力学特性,被广泛用于纺织、生物复合材料等领域[1-3]。亚麻纤维以纤维束的形式存在于麻茎的韧皮部,纤维束外包裹着胶质并且由胶质相互黏结。脱胶就是从非纤维组分中分离出纤维的过程。由于脱胶过程在很大程度上决定了亚麻纤维的特性,因此,被认为是制纤过程中重要的环节[4]。
亚麻制纤的历史非常悠久,传统的方法主要是雨露法和温水浸泡法。雨露法长期占用耕地,而温水浸泡法对环境污染严重。20世纪80年代,随着生物学的发展,研究者们开始关注添加微生物或生物酶进行亚麻脱胶。酶法亚麻脱胶效率高,纤维生产率高,纤维的强力损失较小,但成本高制约了酶法脱胶工业化的进程。近年来课题组探索了短时浸渍脱胶方法,力图在保证酶法脱胶优势的基础上减少酶的用量,降低生产成本[5-6]。本文分别研究了浸泡法和短时间浸渍法亚麻脱胶的适宜加酶量和pH值,对比研究了脱胶过程中,还原糖、总糖的变化及脱胶后纤维的分离程度。为酶法脱胶的机制研究及推动酶法亚麻脱胶提供理论参考。
1 实验部分
1.1 实验材料
亚麻(黑龙江省金鼎亚麻纺织集团),果胶酶(天津市利华酶制剂技术有限公司),3,5-二硝基水杨酸、 结晶酚、结晶乙酸钠、冰乙酸(天津市凯通化学实验有限公司,均为分析纯),蒽酮 (上海源叶生物科技有限公司)。
1.2 实验方法
1.2.1还原糖含量的测定方法
采用3,5-二硝基水杨酸法[7]测定还原糖含量:将1 mL样品溶液,1 mL蒸馏水及1 m 3,5-硝基水杨酸(DNS)试剂混合均匀,沸水浴5 min后骤冷,定容至25 mL,混合均匀,520 nm波长下测吸光值,空白为不加样品。
1.2.2总糖含量的测定方法
采用蒽酮比色法[8]测定总糖含量:将1 mL样品溶液,1 mL蒸馏水及10 mL蒽酮液混合均匀,沸水浴10 min后骤冷,620 nm波长下测吸光值,空白为不加样品。
1.2.3亚麻原茎的预处理
5 cm 长的亚麻茎段→121 ℃湿热灭菌→干燥→碾压处理→蒸馏水浸泡12 h→干燥。
1.2.4亚麻原茎短时浸渍脱胶
将预处理后的亚麻原茎5 g在脱胶酶液中浸泡2 min后取出,去除多余溶液,置于密闭容器内,恒温脱胶。
1.2.5短时浸渍法脱胶亚麻纤维中还原糖和总糖的提取
将不同脱胶时间的亚麻茎1 g剪成较小的茎段,加入到20 mL HAC-NaAC缓冲液中,然后进行30 min的超声处理,再沸水浴30 min。
1.2.6亚麻原茎浸泡法脱胶
经预处理后的亚麻原茎按浴比1∶20 加入 pH 值5.5的果胶酶液,于36 ℃ 静置脱胶处理。脱胶过程中每隔12 h测定溶液中的还原糖、总糖含量和纤维的分离程度。
1.2.7亚麻纤维分离程度的判断方法
亚麻纤维的分离程度采用Freid评分法[9]进行测定。根据纤维分离的程度评分,共4个等级。0为不分散,1为稍有分散,2为基本分散,3为分散良好。“+”表示略高于该水平。
2 结果与讨论
2.1 酶质量浓度对浸泡法亚麻脱胶的影响
分别采用质量浓度为10、5和2 g/L的酶液对亚麻原茎进行浸泡法脱胶,脱胶周期内,每12 h测定脱胶液的还原糖、总糖含量,及亚麻纤维的分离程度,浸泡法脱胶过程中酶质量浓度对还原糖含量的影响见图1、浸泡法脱胶过程中酶质量浓度对总糖含量的影响见图2,酶浓度对纤维分离度的影响(Fried值)见表1。
由图1、2可见,不同酶质量浓度脱胶过程中,还原糖和总糖含量变化趋势较为一致。随着浸泡法脱胶的进行,脱胶液中还原糖含量均缓慢增加,脱胶48~60 h与脱胶72~84 h还原糖含量表现出2次迅速升高,脱胶84 h还原糖含量均达到最高值,这与一些研究者的报道脱胶液中还原糖含量呈“M”形并不相符[10-12],这可能是本文所采用的亚麻茎经过灭菌处理,排除了麻茎携带的微生物对脱胶液中还原糖含量的影响。而总糖含量的变化呈“M”形,“M”形的2个峰值分别出现在48 h和72 h。脱胶过程中酶质量浓度越高,麻茎中的果胶类物质被分解的越多,脱胶液中还原糖和总糖含量也越高。

图1 浸泡法脱胶过程中酶质量浓度对还原糖含量的影响
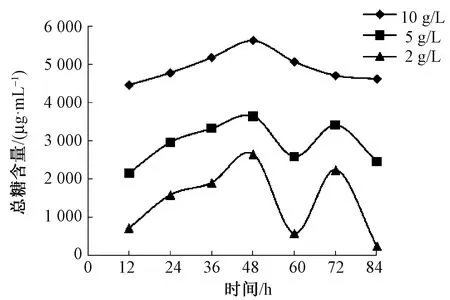
图2 浸泡法脱胶过程中酶质量浓度对总糖含量的影响
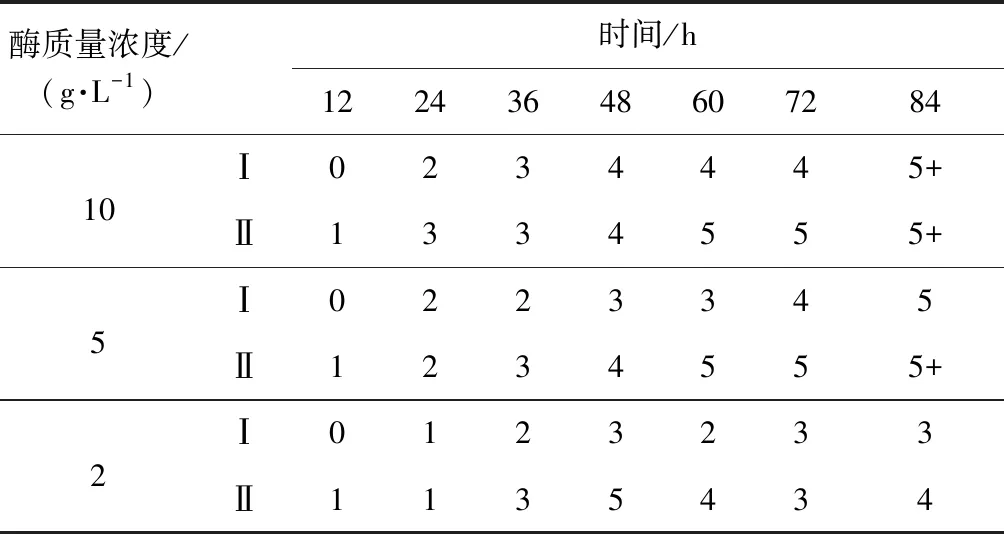
酶质量浓度/(g·L-1) 时间/h1224364860728410Ⅰ0234445+Ⅱ1334555+5Ⅰ0223345Ⅱ1234555+2Ⅰ0123233Ⅱ1135434
注:Fried值为3次测试的均值; Ⅰ:浸泡法脱胶,Ⅱ: 短时浸渍法脱胶。
由表1可见,酶质量浓度越高,纤维分离程度(Fried值)增加越迅速,酶质量浓度10 g/L时,亚麻纤维在48 h Fried值达到4,酶质量浓度5 g/L时,亚麻纤维则在72 h Fried值才达到4,至脱胶84 h,酶质量浓度10、5 g/L脱胶的纤维均分离良好,Fried值达到5,但2 g/L脱胶的纤维Fried值仅为3。综合考虑选择5 g/L作为亚麻浸泡脱胶的适宜酶质量浓度。
2.2 酶质量浓度对短时浸渍法亚麻脱胶的影响
采用短时浸渍法亚麻脱胶,考察不同的酶质量浓度对提取液中还原糖、总糖含量及纤维分离程度的影响。短时浸渍法脱胶过程中酶质量浓度对还原糖含量的影响见图3、短时浸渍法脱胶过程中酶质量浓度对总糖含量的影响见图4。
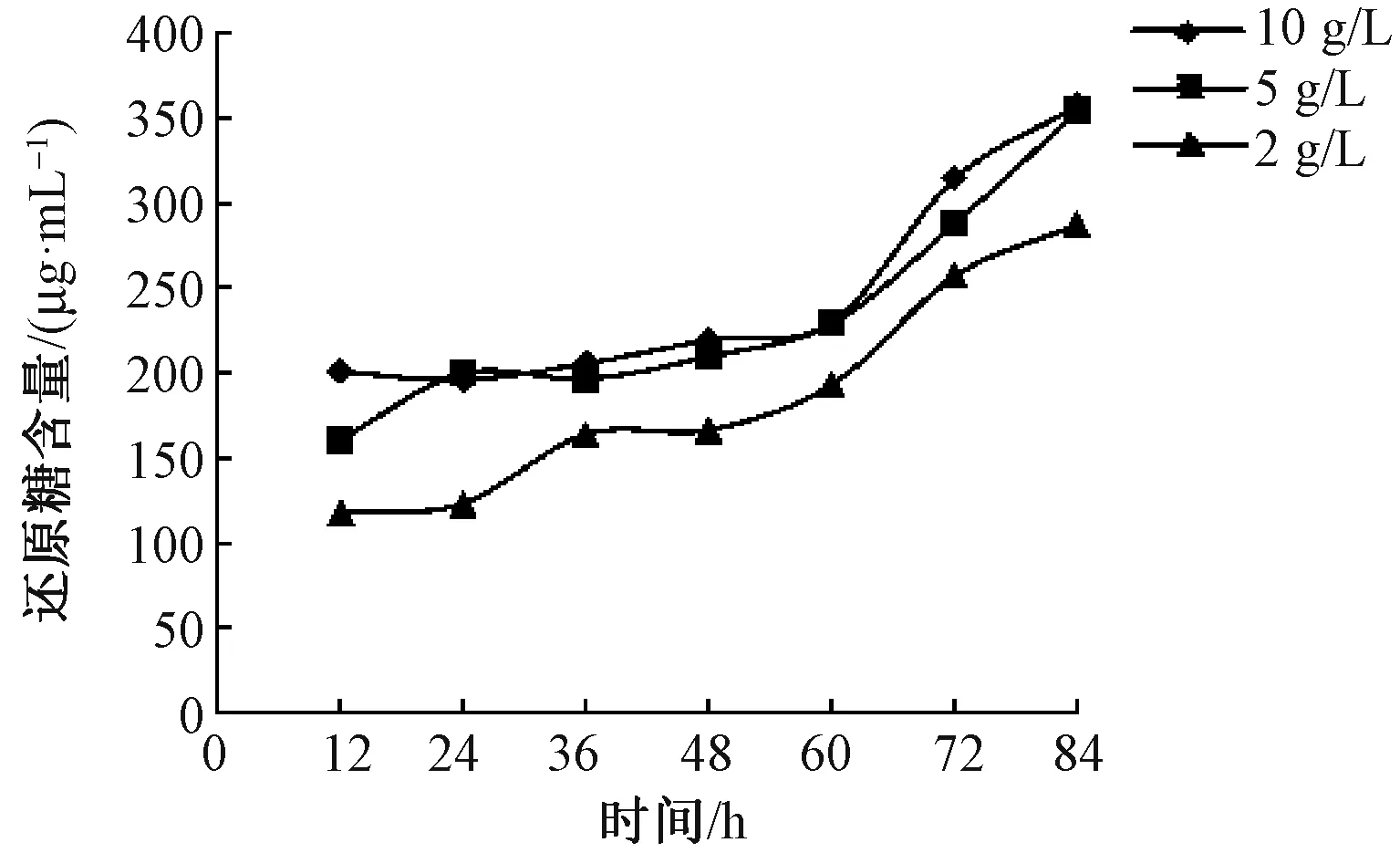
图3 短时浸渍法脱胶过程中酶质量浓度对还原糖含量的影响
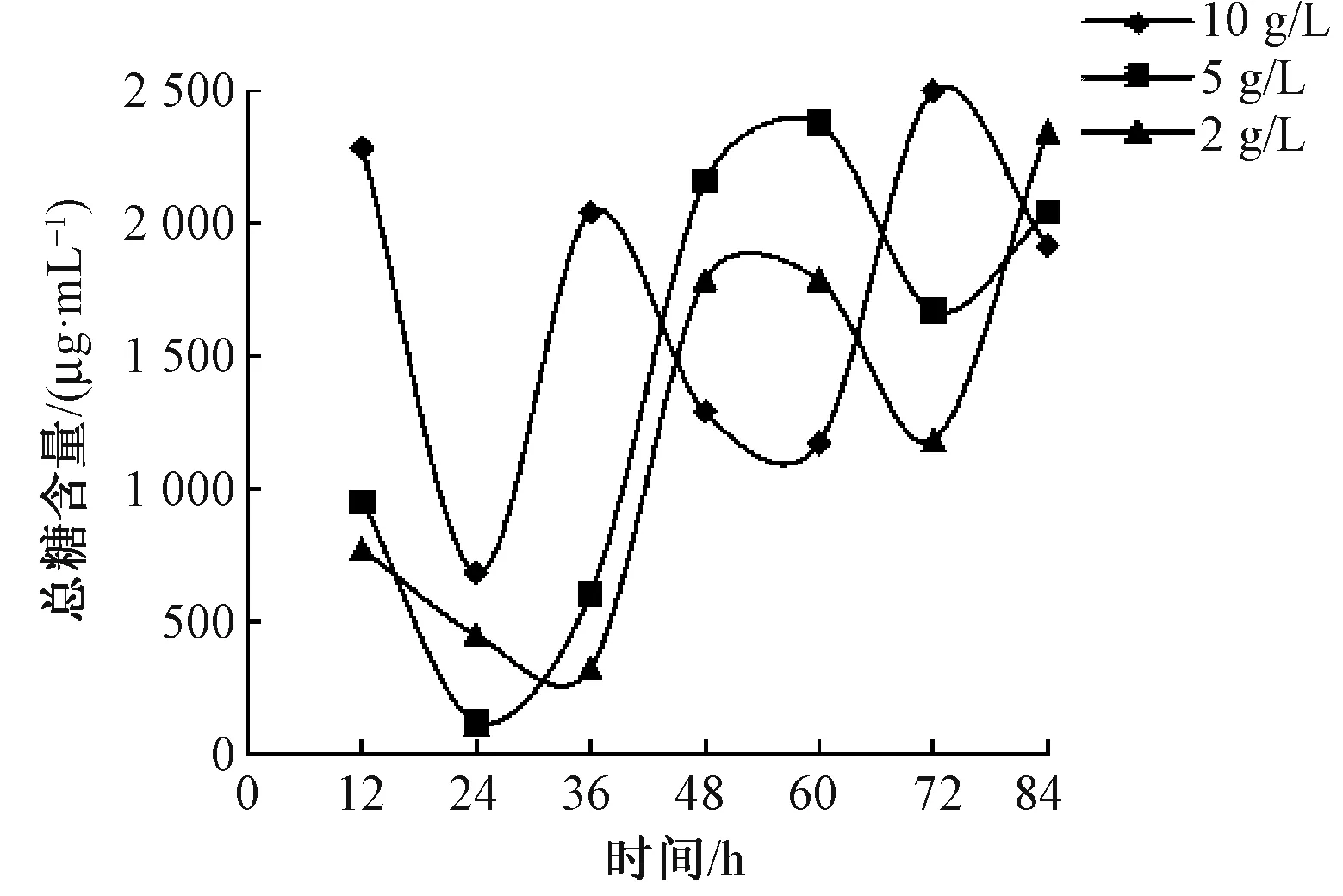
图4 短时浸渍法脱胶过程中酶浓度对总糖含量的影响
由图3、4可见,短时浸渍法脱胶提取液中还原糖和总糖含量均较浸泡法脱胶的低;脱胶过程中还原糖含量呈逐步增加的趋势,随酶质量浓度的增加,脱胶提取液中还原糖含量明显提高,但与浸泡法脱胶不同,较高酶质量浓度(10、5 g/L)对还原糖含量的影响并不显著。脱胶过程中总糖含量呈近“W”形,脱胶84 h总糖含量相差不大。结合纤维分离度,选择5 g/L为适宜的酶质量浓度。
2.3 pH值对浸泡法亚麻脱胶的影响
分别采用pH值为3.7,4.0,4.4,4.8和5.2的酶液进行浸泡法亚麻脱胶,浸泡法脱胶过程中pH值对还原糖含量的影响见图5、浸泡法脱胶过程中pH值对总糖含量的影响见图6。酶液pH值对纤维分离度的影响(Fried值)变化见表2。
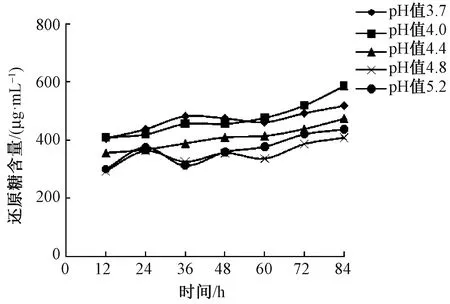
图5 浸泡法脱胶过程中pH值对还原糖含量的影响
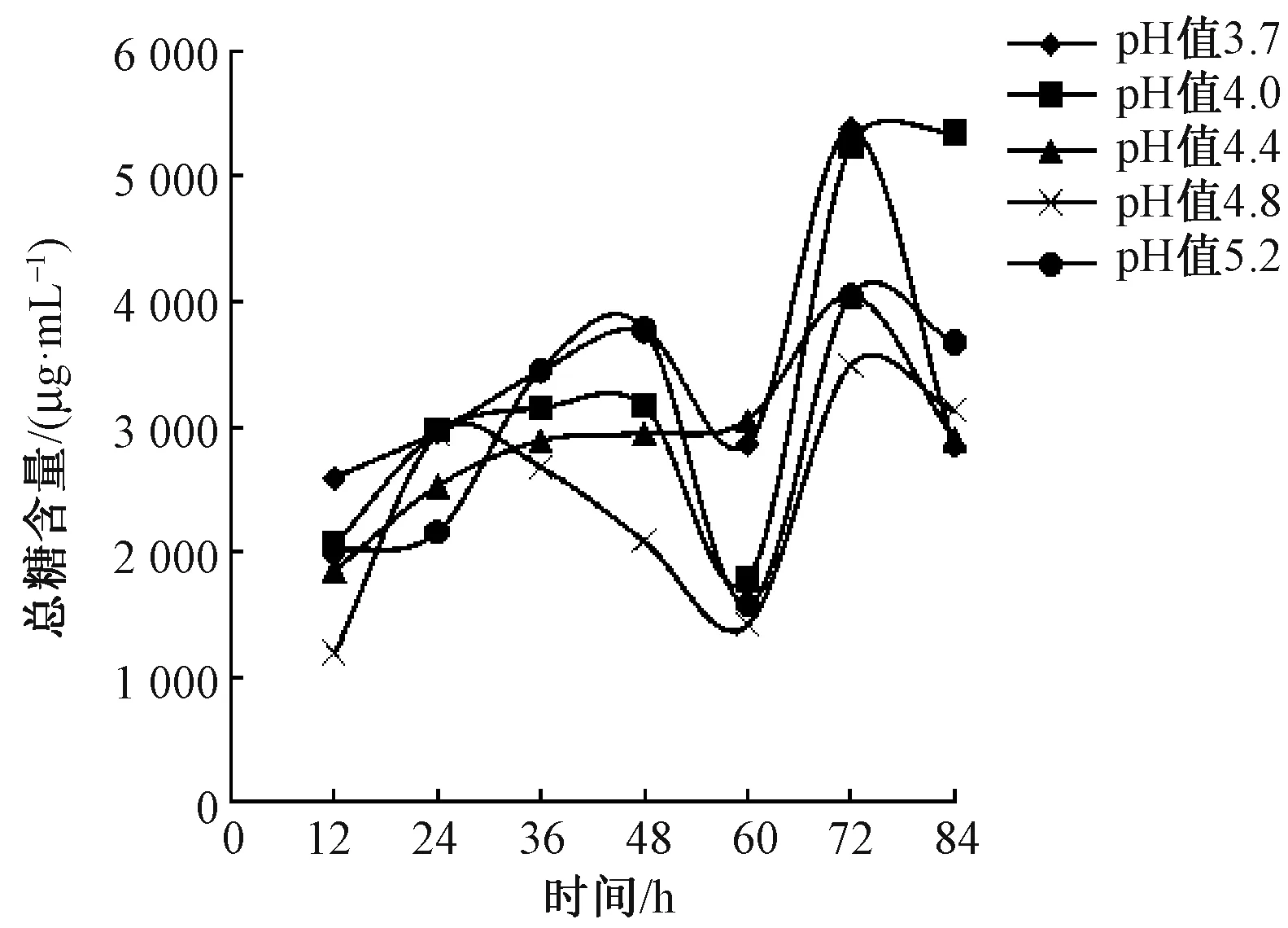
图6 浸泡法脱胶过程中pH值对总糖含量的影响
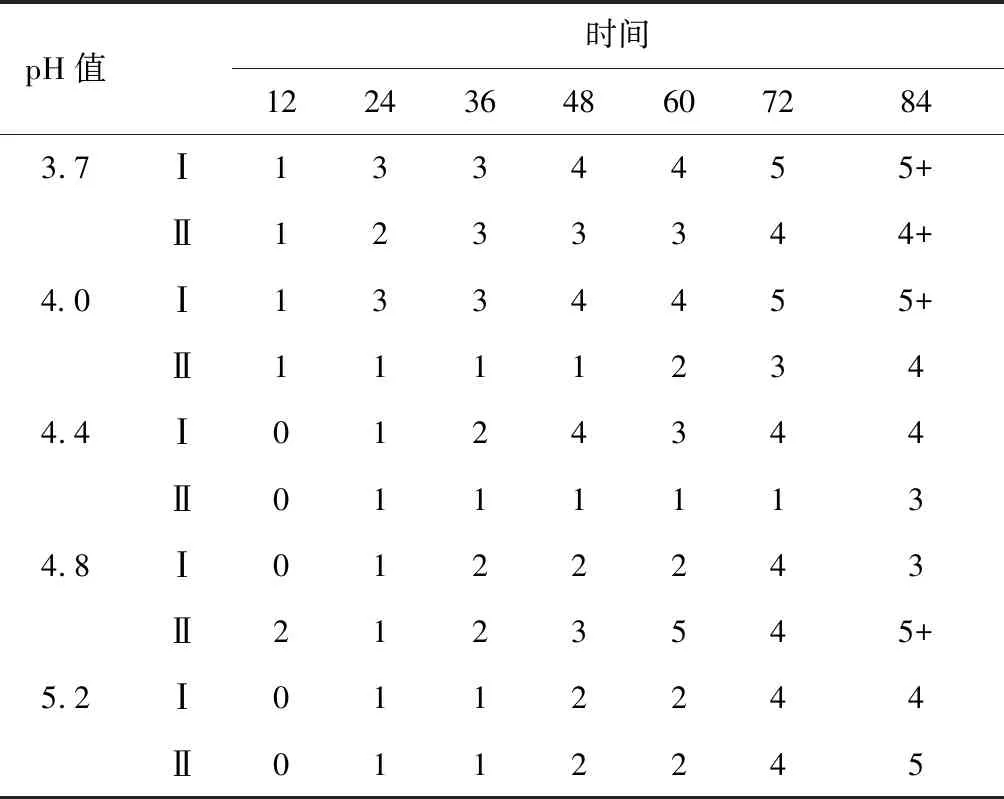
pH值时间 122436486072843.7Ⅰ1334455+Ⅱ1233344+4.0Ⅰ1334455+Ⅱ11112344.4Ⅰ0124344Ⅱ01111134.8Ⅰ0122243Ⅱ2123545+5.2Ⅰ0112244Ⅱ0112245
注:Fried值为3次测试的均值; Ⅰ:浸泡法脱胶,Ⅱ:短时浸渍法脱胶。
由图5、6可见,随着脱胶的进行还原糖含量缓慢升高,pH值3.7和pH值4.0脱胶液中还原糖含量在脱胶过程中始终保持较高的水平,至脱胶84 h,pH值3.7和pH值4.0脱胶液中还原糖含量分别为518.23 μg/mL 和586.54 μg/mL。脱胶液中总糖含量的变化基本成“M”形,最低点为脱胶60 h,至脱胶84 h,pH值4.0脱胶液中总糖含量最高,为5 352.81 μg/mL。由表2可见,酶液pH值为3.7和 4.0脱胶亚麻纤维Fried值增加较快,纤维分离度最好,分别在脱胶60 h和72 h Fried值达到5分。因此,浸泡法亚麻脱胶适宜pH值为3.7~4.0。
2.4 pH值对短时浸渍法亚麻脱胶的影响
分别采用pH值为3.7,4.0,4.4,4.8和5.2的酶液进行短时浸渍法亚麻脱胶,短时浸渍法脱胶过程中pH值对还原糖含量的影响见图7、短时浸渍法脱胶过程中pH值对总糖含量的影响见图8。

图7 短时浸渍法脱胶过程中pH值对还原糖含量的影响

图8 短时浸渍法脱胶过程中pH值对总糖含量的影响
随着短时浸渍法脱胶的进行,脱胶提取液中还原糖含量呈增加的趋势,脱胶后期(72~84 h)还原糖含量增加迅速,pH值4.8~5.2酶液的还原糖含量均超过440 μg/mL。由图8可见,短时浸渍法脱胶总糖含量的变化与浸泡法脱胶的相似,均呈近“M”形,但不同pH值的脱胶提取液中总糖含量的变化趋势并不一致,这也可能是由于短时浸渍法提取总糖时的误差造成的。至脱胶84 h pH值4.0和pH值4.8脱胶提取液中总糖含量为最高。结合纤维分离度选择适宜pH值为4.8。
3 结 论
①以亚麻茎为原料,分别采用浸泡法和短时浸渍法脱胶制备亚麻纤维,以纤维分离度评分为指标,浸泡法和短时浸渍法脱胶适宜酶质量浓度均为5 g/L,适宜pH值分别为3.7~4.0和4.8。
②对比研究浸泡法和短时浸渍法制备亚麻纤维过程还原糖、总糖含量的变化。浸泡法脱胶体系中还原糖和总糖含量明显高于浸泡法脱胶。2种脱胶体系中还原糖含量均呈逐渐上升趋势,脱胶后期(72~84 h)还原糖含量增加较快,至84 h达到最高值。浸泡法脱胶体系中总糖含量呈近“M”形。
③短时浸渍法脱胶的纤维分离度优于浸泡法脱胶,而短时浸渍法脱胶酶液用量约为浸泡法的40%,具有成本效益,但短时浸渍法脱胶纤维的一致性较浸泡法差,这也是课题组需要解决的问题。

